
- •8.1 От чего зависит теплоемкость идеального газа?
- •8.2 Связь между истинной и средней теплоёмкостью.
- •8.3 Виды теплоёмкостей
- •8.4 Первый закон термодинамики
- •8.5 Уравнение адиабаты идеального газа
- •8.6 Теплота, работа и внутренняя энергия в простейших процессах
- •8.7 Связь между универсальной и удельной газовыми постоянными
- •8.8 Уравнения состояния идеального и реальных газов
- •8.9 Изображение процессов в p-V и t-s диаграммах
- •8.10 Политропный процесс
8.1 От чего зависит теплоемкость идеального газа?
Идеальный газ – это газ, у которого молекулы не имеют объема (мат. точки), между ними отсутствуют силы взаимного притяжения.
Теплоёмкость (с) – кол-во теплоты, необходимое для изменения температуры единицы вещества на 1ᵒС.
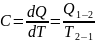
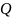 -
теплота
Дж
-
теплота
Дж
 – температура
– температура
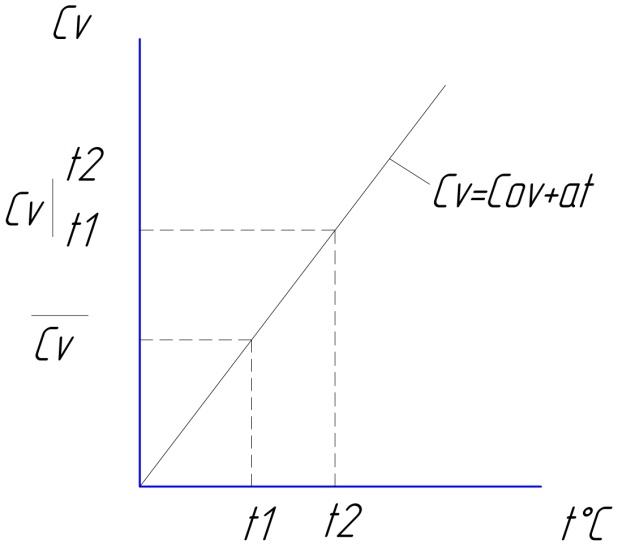
Теплоемкость идеального газа зависит только от температуры. С ростом температуры теплоёмкость увеличивается, что объясняется тем, что по мере повышения температуры системы происходит перераспределение подведенной энергии в форме теплоты, все более и более в пользу колебательных частиц. Зависимость теплоёмкости от температуры определяется опытным путем. Результаты в виде таблиц, графиков и эмпирических формул.
№опыта п/п |
tᵒ |
Cр
|
1 |
|
|
… |
|
|
n |
|
|
Значение теплоёмкости в таблице истинно, то есть задано для конкретной температуры.
Линейная зависимость теплоёмкости от температуры имеет вид:
Cp=C0p+at
C0p и а – эмпирические коэффициенты, определены опытным путем
И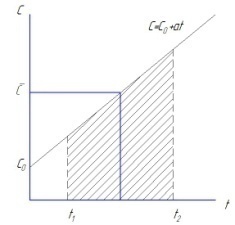 ногда
в оценочных расчетах теплоемкость
идеального газа на основании результатов
молекулярной кинетической теории газа
берется величиной постоянной , не
зависящей от температуры.
ногда
в оценочных расчетах теплоемкость
идеального газа на основании результатов
молекулярной кинетической теории газа
берется величиной постоянной , не
зависящей от температуры.
8.2 Связь между истинной и средней теплоёмкостью.
Зависимость теплоёмкости от температуры определяется опытным путем. Результаты в виде таблиц, графиков и эмпирических формул.
№опыта п/п |
tᵒ |
Cр |
1 |
|
|
… |
|
|
n |
|
|
Значение теплоёмкости в таблице истинно, то есть задано для конкретной температуры.
Линейная зависимость теплоёмкости от температуры имеет вид:
Cp=C0p+at
C0p и а – эмпирические коэффициенты, определены опытным путем
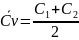
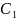 =
=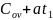
 =
=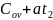
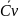 =
=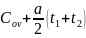
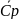 =
=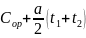
В тех случаях когда опытные значения теплоемкости при различных температурах не удается апрксимировать одной прямой, теплоёмкость зависит от температуры существенно нелинейно. В этом случае для средней теплоёмкости используется формула
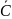 =
=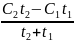
,
-табличные
значения истинных теплоемкостей
соответствующих температур
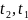 .
.
8.3 Виды теплоёмкостей
Теплоемкость – это количество теплоты необходимое для изменения температуры единицы количества вещества на 1оС(К). 1оС=1К. Теплоемкость может зависеть от единицы количества вещества и от вида процесса.
По количеству вещества: 1) удельная теплоемкость С, (Дж/кг К); 2) мольная теплоемкость Сμ, (Дж/Кмоль К), С= Сμ/ μ, где μ- молекулярная масса (1 Кмоль –это количество вещества в 1 кг, численно равное его мольной массе μ); 3) Объемная теплоемкость СW, (Дж/м3К), т.к. объем вещества зависит от его давления и температуры, то в справочниках дается объемные теплоемкости приведенные к НФУ (Рн=101325 Па; Тн=273,15К(~0оС)). С= СW/ρн, где ρн – плотность газа при НФУ.

