
- •Предисловие
- •Введение
- •Глава 1. Питание микроорганизмов
- •1.1. Транспорт веществ в клетку бактерий
- •1.2. Автотрофные способы питания микроорганизмов
- •1.3. Ассимиляция со2 хемогетеротрофными микроорганизмами
- •Глава 2. Метаболизм микроорганизмов
- •2.1. Общая характеристика типов метаболизма
- •2.2. Общая характеристика энергетического метаболизма
- •2.2.1. Аэробное дыхание
- •2.2.2. Процессы анаэробного дыхания
- •Нитратное дыхание, или денитрификация
- •Сульфатное дыхание, или диссимиляционная сульфатредукция
- •Серное дыхание
- •Карбонатное дыхание
- •Анаэробное дыхание с использованием в качестве акцепторов электронов других неорганических ионов
- •Фумаратное дыхание и другие типы анаэробного дыхания с использованием органических веществ в качестве акцепторов электронов
- •2.2.3. Процессы брожения
- •Спиртовое брожение
- •Молочнокислое брожение
- •Маслянокислое и ацетонобутиловое брожение
- •Пропионовокислое брожение
- •Брожение смешанного типа, или муравьинокислое брожение
- •2.2.4. Неполное окисление органических веществ микроорганизмами
- •2.2.5. Разложение микроорганизмами природных высокополимерных органических соединений
- •Разложение целлюлозы
- •Разложение гемицеллюлоз
- •Разложение крахмала и других глюканов
- •Разложение лигнина
- •Разложение пектиновых веществ
- •Разложение хитина и хитозана
- •2.2.6. Использование белков микроорганизмами
- •Аэробное расщепление аминокислот
- •Сбраживание аминокислот микроорганизмами
- •2.2.7. Использование микроорганизмами азотистых оснований
- •Анаэробное разложение (сбраживание) азотистых оснований
- •Аэробное окисление азотистых оснований
- •2.2.8. Окисление липидов и фосфолипидов микроорганизмами
- •2.2.9. Разложение углеводородов микроорганизмами
- •Разложение алканов (парафинов) микроорганизмами
- •Разложение ароматических углеводородов (аренов) микроорганизмами
- •2.2.10. Разложение ксенобиотиков микроорганизмами
- •2.2.11. Окисление неорганических соединений бактериями
- •Процесс нитрификации
- •Окисление восстановленных соединений серы
- •Окисление ионов железа
- •Окисление молекулярного водорода
- •Окисление оксида углерода
- •2.2.12. Использование микроорганизмами одноуглеродных соединений
- •2.2.13. Использование микроорганизмами солнечной энергии
- •Фотосинтез у прокариот
- •Глава 3. Конструктивный метаболизм микроорганизмов
- •3.1. Биосинтез аминокислот
- •3.2. Биосинтез нуклеотидов
- •3.3. Биосинтез липидов
- •3.4. Биосинтез углеводов
- •3.5. Биосинтез пептидогликана
- •Глава 4. Фиксация молекулярного азота (азотфиксация, диазотрофия) микроорганизмами
- •4.1. Биохимия азотфиксации
- •Глава 5. Биолюминесценция бактерий
- •Глава 6. Регуляция метаболизма у бактерий
- •6.1. Регуляция активности ферментов
- •6.2. Регуляция на уровне генов, или регуляция синтеза ферментов
- •Литература
- •Оглавление
6.1. Регуляция активности ферментов
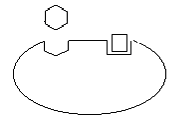
Наиболее быстрым и тонким механизмом регуляции активности ферментов является регуляция, которой подвергаются аллостерические ферменты. Аллостерические ферменты – белки с высокой молекулярной массой, состоящие в большинстве случаев из нескольких субъединиц одного или разного типа. Каждая субъединица содержит, как правило, каталитический центр, который связывается с субстратом, и регуляторный или аллостерический центр. Последний соединяется с веществами-эффекторами, которые могут повышать или понижать активность фермента. Связывание эффектора с аллостерическим центром вызывает конформационные изменения молекулы фермента, происходящие на уровне третичной структуры, в результате чего изменяется сродство фермента к субстрату (рис. 56).
Каталитический центр
Аллостерический центр
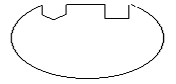
Рис. 56. Субъединица аллостерического фермента
Эффекторами могут быть конечные продукты данного метабо-лического пути, субстраты ферментов, а также некоторые конечные продукты родственных метаболических путей. Если действие эффектора приводит к понижению каталитической активности фермента, такой эффектор называется отрицательным, или ингибитором. Положительным называют эффектор, действие которого повышает каталитическую активность фермента. Положительным эффектором, или активатором, чаще всего бывает субстрат данного регуляторного фермента.
Наиболее простой случай аллостерической регуляции – регуляция конечным продуктом активности первого или ключевого фермента неразветвленного биосинтетического пути. Если конечный продукт накапливается в избытке, он подавляет активность первого фермента. Этот процесс называется ретроингибированием, или ингибированием по принципу обратной связи. Примером такого типа регулирования является ингибирование биосинтеза изолейцина. Превращение L-треонина в L-изолейцин включает пять ферментативных реакций:
L-треонин
α-кетомасляная кислота
L-изолейцин
Ф2 Ф3 Ф4 Ф5
Ф1
Первый фермент на пути синтеза L-изолейцина L-треонинде-заминаза является аллостерическим и ингибируется только L-изолей-цином. На поверхности молекулы L-треониндезаминазы имеется два вида участков: каталитический – для связывания субстрата (L-треонина) и регуляторный – для связывания эффектора (L-изолейцина):
Каталитический центр L-треонин
Аллостерический центр


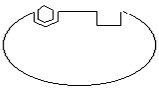
L-треониндезаминаза
П ри
накоплении в клетке L-изолейцина
он связывается с аллостерическим центром
фермента L-треониндезаминазы,
подавляя его активность, и синтез
L-изолейцина
прекращается:
ри
накоплении в клетке L-изолейцина
он связывается с аллостерическим центром
фермента L-треониндезаминазы,
подавляя его активность, и синтез
L-изолейцина
прекращается:
L-треонин
Ф1
Ф2 Ф3 Ф4 Ф5
L-изолейцин
α-кетомасляная кислота




L-треонин
L-изолейцин
L-треониндезаминаза
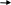

В разветвленных метаболических путях активность аллостерических ферментов регулируется сложнее, так как от активности первого фермента зависит биосинтез нескольких конечных продуктов. Например,
Ф8 Ф9
 X
Z AA1
X
Z AA1
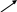 Ф1
Ф2 Ф3 Ф7
Ф1
Ф2 Ф3 Ф7


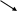 A B
C D
A B
C D
Ф4
E F AA2
Ф5 Ф6
В этом случае на поверхности молекулы фермента (Ф1), катализи-рующего первый этап биосинтетического пути, имеются различные аллостерические центры, с каждым из которых связывается один из конечных продуктов, выполняющих функцию эффектора. Ингибирование активности этого фермента может происходить двояко:
- мультивалентное ингибирование – необходимо связывание с аллостерическими центрами всех конечных продуктов. Каждый конечный продукт (эффектор) по отдельности, связавшись со «своим» аллостерическим центром, не меняет активности фермента.
- кумулятивное, или аддитивное ингибирование – присоединение к ферменту одного конечного продукта частично снижает его активность, с присоединением каждого последующего конечного продукта эффект ингибирования нарастает:



Ф8 Ф9
X Z AA1
Ф1 Ф2 Ф3 Ф7
A B C D
 Ф4
Ф4
E F AA2
 Ф5
Ф6
Ф5
Ф6

В

 некоторых разветвленных биосинтетических
путях ингибирование первого фермента
осуществляется не конечными продуктами
каждой из ветвей, а промежуточным
продуктом, образующимся непосредственно
перед разветвлением. Накопление его в
свою очередь контролируется конечными
продуктами. Такой вид ингибирования
получил название
последовательного:
некоторых разветвленных биосинтетических
путях ингибирование первого фермента
осуществляется не конечными продуктами
каждой из ветвей, а промежуточным
продуктом, образующимся непосредственно
перед разветвлением. Накопление его в
свою очередь контролируется конечными
продуктами. Такой вид ингибирования
получил название
последовательного:


 Ф8
Ф9
Ф8
Ф9
X Z AA1
Ф1 Ф2 Ф3 Ф7
A B C D
 Ф4
Ф4
E F AA2

 Ф5
Ф6
Ф5
Ф6
П римером
такого ретроингибирования является
ингибирование фермента
3-дезокси-D-арабиногептулозо-7-фосфатсинтазы
(ДАГФ-синтазы) у бактерий B.
subtilis
префенатом:
римером
такого ретроингибирования является
ингибирование фермента
3-дезокси-D-арабиногептулозо-7-фосфатсинтазы
(ДАГФ-синтазы) у бактерий B.
subtilis
префенатом:
Фосфоенолпируват
+
Эритрозо-4-фосфат
фенилаланин

ДАГФ-синтаза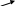
хоризмат
префенат




тирозин
Существуют разветвленные метаболические пути, в которых регу-ляция осуществляется таким образом, что одновременно существуют и активация и ингибирование:




 A B
C D
A B
C D

 E F
G H I
E F
G H I


М
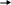 етаболит
B
является общим для двух путей синтеза
конечных продуктов D и I. При накоплении
вещества D оно ингибирует аллостерический
фермент, который катализирует превращение
А в В (А В), но вещество F является
активатором этой же реакции. Вещество
D поэтому продолжает синтезироваться.
Количество вещества В после активации
становится достаточным для синтеза
продукта I. Затем, когда синтез продукта
I будет завершен, он блокирует реакцию
E F. Концентрация продукта F падает и
поэтому активность фермента реакции А
В снижается. Такой двойной контроль
обеспечивает необходимое количество
продукта В, которое создает условия для
синтеза двух конечных продуктов D и I.
етаболит
B
является общим для двух путей синтеза
конечных продуктов D и I. При накоплении
вещества D оно ингибирует аллостерический
фермент, который катализирует превращение
А в В (А В), но вещество F является
активатором этой же реакции. Вещество
D поэтому продолжает синтезироваться.
Количество вещества В после активации
становится достаточным для синтеза
продукта I. Затем, когда синтез продукта
I будет завершен, он блокирует реакцию
E F. Концентрация продукта F падает и
поэтому активность фермента реакции А
В снижается. Такой двойной контроль
обеспечивает необходимое количество
продукта В, которое создает условия для
синтеза двух конечных продуктов D и I.
В настоящее время в селекции микроорганизмов – продуцентов аминокислот и других биологически активных продуктов используются методы получения мутантов, нечувствительных к ретроингибированию. Такие мутанты все время синтезируют нужный конечный продукт.
Кроме ретроингибирования регуляция активности ферментов может осуществляться путем их ковалентной модификации. При этом одни ферменты модифицируются под действием других ферментов, что приводит к повышению или снижению их активности. Модификация ферментов происходит в процессе их аденилирования, фосфорилирования или ацетилирования. Регуляцию активности ферментов таким способом можно рассмотреть на примере фермента глутаминсинтетазы, катализирующего превращение у бактерий глутамата в глутамин в реакции восстановительного аминирования. Аминогруппа глутамина с помощью фермента глутаматсинтетазы может быть перенесена на 2-оксоглутарат. Таким образом, глутаминсинтетаза и глутаматсинтетаза нужны бактериям для включения ионов аммония в органические соединения. Этот процесс осуществляется в тех случаях, когда концентрация ионов аммония в среде мала (меньше 1мМ/л). При повышении концентрации этих ионов в среде, в которой культивируются бактерии, происходит подавление синтеза фермента глутаминсинтетазы и снижение активности имеющегося фермента в клетках. Снижение активности фермента глутаминсинтетазы происходит под действием особого аденилирующего фермента, осуществляющего его химическую модификацию. Когда в клетках бактерий достаточно глутамина, то происходит стимулирование аденилирущего фермента и, соответственно, активность фермента глутаминсинтетазы снижается. В результате этого синтез глутамина прекращается. При удалении из среды ионов аммония в клетках бактерий создается недостаток глутамина и фермент глутаминсинтетаза снова становится активным в результате отщепления групп адениловой кислоты (АМФ) под действием деаденилирующей системы.
