
- •I. Гравиметрический анализ
- •Сущность метода
- •Процессы, приводящие к загрязнению осадков
- •1.3. Условия получения чистых осадков и гравиметрических форм
- •Условия получения чистых осадков и гравиметрических форм
- •1.4. Расчёты в гравиметрии
- •1.4.1. Расчет результатов анализа
- •1.4.2. Расчет величины навески анализируемой пробы
- •1.4.3. Расчет количества осадителя
- •1.4.4. Расчет потерь при осаждении и промывании твердой фазы
- •1.4.5. Расчёт потерь от растворимости осадка в избытке осадителя,
- •2. Титриметрический анализ. Общие вопросы
- •2.1. Сущность метода
- •2.2. Способы выражения концентрации растворов
- •2.3. Стандартные растворы
- •2.4. Методы установления точной концентрации рабочих растворов
- •2.5. Кривые титрования
- •2.6. Расчет результатов анализа
- •2.7. Расчет погрешности результата титриметрического анализа
- •3. Методы титриметрического анализа
- •Кислотно-основное титрование (протолитометрия)
- •Сущность метода
- •Индикаторы кислотно-основного титрования
- •Кривые титрования
- •Кривые титрования сильного протолита сильным протолитом
- •Кривые титрования слабого протолита сильным протолитом
- •Кривые титрования многопротонных кислот
- •Кривые титрования оснований
- •3.1.3.6. Индикаторные погрешности кислотно-основного титрования
- •Вычисление индикаторных погрешностей
- •3 Части 100 %
- •1 Часть %
- •Окислительно-восстановительное титрование (редоксиметрия)
- •Сущность и классификация методов редоксиметрии
- •Способы обнаружения конца титрования
- •3.2.3. Расчет кривых титрования
- •Расчет индикаторных погрешностей
- •Методы редоксиметрии
- •Перманганатометрия
- •Йодометрия
- •Дихроматометрия
- •Ванадатометрия
- •Броматометрия
- •Комплексометрическое титрование (комплексометрия)
- •3.3.1. Комплексонометрия
- •3.3.1.1. Способы обнаружения конечной точки титрования
- •3.3.1.2. Применение комплексонометрического титрования
- •3.3.1.3. Расчет кривых титрования
- •3.3.1.3. Расчет кривых титрования
- •3.4. Осадительное титрование (седиметрия)
- •3.4.1. Расчет кривых титрования
- •3.4.1. Расчет кривых титрования
- •3.4.2. Способы обнаружения конечной точки титрования
- •Меркурометрия
- •Лабораторные работы по количественному анализу
- •4.1. Гравиметрический метод
- •4.1.1. Определение содержания железа (III) в растворе FeCl3 методом осаждения
- •4.2.Титриметрические методы
- •4.2.1. Метод кислотно-основного титрования
- •4.2.1.1. Работа 1. Приготовление и стандартизация раствора хлороводородной кислоты
- •4.2.1.2. Работа 2. Определение содержания карбоната натрия в растворе
- •4.2.1.2. Работа 2. Определение содержания карбоната натрия в растворе
- •4.2.2. Методы окислительно-восстановительного титрования
- •4.2.2.1. Перманганатометрия . Определение железа (II)
- •4.2.2.1. Перманганатометрия . Определение железа (II)
- •4.2.2.2. Дихроматометрия. Определение содержания железа (III)
- •4.2.2.2. Дихроматометрия. Определение содержания железа (III)
- •Выполнение работы
- •4.2.2.3. Йодометрия. Определение содержания меди (II)
- •Выполнение работы
- •4.2.3. Метод комплексонометрического титрования. Определение общей жёсткости воды
- •Химический анализ реального объекта (творческая работа)
- •5.1. Методология анализа реальных объектов
- •Цель и задачи анализа
- •Изучение литературы
- •Составление схемы анализа и прописи методики
- •Проверка правильности методики анализа
- •Анализ стандартных образцов
- •Анализ «синтетической смеси»
- •Анализ другими методами
- •Методы стандартной добавки к образцу и удвоения навески
- •Результаты анализа и их обсуждение
- •Лабораторный журнал
- •Отчёт по работе
- •Реальные объекты и рекомендованная литература для выполнения творческой работы
- •Список рекомендованной литературы Справочники
- •Монографии
- •Руководства для лабораторных работ
- •Учебники и учебные пособия
- •Математическая обработка результатов анализа
- •Анализ минерального сырья и полезных ископаемых
- •Анализ сплавов
- •Анализ воды
- •Анализ почв
- •Анализ пищевых продуктов
- •Анализ фармацевтической продукции
- •Программа лекционного курса и рекомендованная литература
- •Программа лекционного курса «Аналитическая химия. Часть II» (Количественный анализ. Химические методы)
- •Рекомендованная литература для изучения дисциплины «Аналитическая химия. Часть II» (Количественный анализ. Химические методы) Литература Основная
- •Дополнительная
- •Методические разработки кафедры
1.4.5. Расчёт потерь от растворимости осадка в избытке осадителя,
проявляющего комплексующие свойства
Если анион-осадитель обладает лигандными свойствами по отношению к катиону осадка, то при большом избытке осадителя растворимость осадка, как уже было отмечено выше, возрастает вследствие образования растворимых комплексных соединений. Например, это имеет место при осаждении иона серебра тиоцианат-ионом: АgSCN + 3SCN− = [Аg(SCN)4]3−. В большинстве случаев в избытке осадителя растворяются бинарные осадки простейшего состава 1:1.
Рассмотрим взаимодействие осадка МL с осадителем-лигандом L, опуская ради простоты зарядовые числа ионов. При этом в системе возможны следующие равновесия:
M + L
ML β1
= [ML]/([M]·[L])
= [ML]/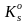 ;
;
M + 2L ML2 β2 = [ML2]/([M]·[L]2) = [ML2]/( [L]);
M + 3L ML3 β3 = [ML3]/([M]·[L]3) = [ML3]/( [L]2);
……………………………………………………………………………
M + qL MLq βq = [MLq]/([M]·[L]q) = [MLq]/( [L]q−1),
где = [М][L] − произведение растворимости осадка МL. Согласно условию материального баланса, растворимость осадка определяется суммарной равновесной концентрацией всех частиц, включающих катион осадка:
S(ML) = [M] + [ML] + [ML2] + ….+ [MLq].
Исключая из этого уравнения равновесные концентрации частиц с помощью выражений для βq и , получим уравнение для расчета растворимости осадка Ме в избытке аниона-осадителя с лигандными свойствами:
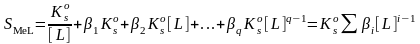 ,
,
где βi ‑ суммарная константа устойчивости комплекса МLi (при i = 0 β0 =1). Растворимость осадка типа МLn рассчитывают по аналогичной формуле (пример 18)
S(МLn) = ∑ βi[L]i-n.
Из рассмотренного примера можно сделать вывод, что эффект повышения растворимости осадка под воздействием избытка осадителя-комплексанта в данных условиях преобладает над эффектом, вызываемым одноименным ионом решетки и действующим в противоположном направлении.
Пример 18. Рассчитать потерю массы осадка АgС1 от его растворимости в 250 мл 2 М НС1, если исходная концентрация АgNO3 в растворе 0,01 моль/л.
Решение. В системе Аg+−Сl− при значительном избытке хлорид-иона образуются растворимые комплексы АgС1, АgС12−, АgС132− и АgСl43−, характеризующиеся суммарными константами устойчивости β1 = 4,9·102; β2 = 5,7·104; β3 = 2,5·105; β4 = 8,3·105. Произведение растворимости (AgCl) = 1,78·10−10. При I < 0,01 M коэффициенты активностей ионов близки к единице, поэтому влиянием ионной силы на константы равновесия можно пренебречь. Тогда S(АgС1) = 1,78·10−10(1/2 + 4,9·102 + 5,7·104·2 + 2,5·105·4 + 8,3·1058) = 1,38·10−3 моль/л, и потеря массы осадка составит 1,38·10−3·M(AgCl) 0,25 = 1,38·10−3·143,3·0,25 = 0,494 г. При количественном осаждении АgС1 из 0,01 М раствора АgNO3 масса осадка составила бы 0,01.143,3.0,25 = 0,358 г, т.е. вследствие растворимости в избытке НС1 будет потеряно осадка в количестве (0,0494/0,358)·100 = 14 (%).
2. Титриметрический анализ. Общие вопросы
2.1. Сущность метода
Титриметрический анализ, наряду с гравиметрическим, является классическим методом аналитической химии. Несколько уступая по точности гравиметрическому анализу, он намного превосходит его по скорости определений и находит достаточно широкое использование для определения содержания основных и второстепенных компонентов в веществах и материалах, особенно в производственных контрольно-аналитических лабораториях. В титриметрическом анализе измеряют объем раствора с известной концентрацией реагента (титранта), прореагировавшего с определяемым веществом (аналитом) в соответствии со стехиометрией реакции. Операция добавления реагента называется титрованием.
Момент титрования, когда количество прибавленного титранта точно эквивалентно количеству определяемого вещества, называют точкой эквивалентности или точкой стехиометричности.
Реакции, используемые в титриметрическом анализе, должны отвечать следующим требованиям:
а) титрант должен быть специфичным, т.е. должен расходоваться только на взаимодействие с определяемым компонентом и не должен вступать в побочные реакции;
б) реакция, на которой основано титрование, должна быть количественной, т .е. взаимодействие между реагирующими веществами должно протекать до конца и титрант должен полностью (или практически полностью) связываться определяемым компонентом;
в) реакция титрования должна быть достаточно быстрой, чтобы внесенный в раствор титрант немедленно связывался с эквивалентным количеством определяемого вещества.
Метод основан на эквивалентном взаимодействии веществ, поэтому далее введём понятие эквивалента вещества и рассмотрим концентрации, которые чаще всего используют в титриметрии.
Точка эквивалентности реакции титрования является теоретическим понятием. В практике титриметрического анализа устанавливают расход титранта (в мл) в конечной точке титрования (KTT), которая является экспериментальной оценкой точки эквивалентности. Способы, при помощи которых устанавливают КТТ, очень разнообразны. В классическом титриметрическом анализе её определяют визуально, обычно по резкому изменению окраски внесенного в раствор специального вещества, называемого индикатором.
В титриметрии используют реакции всех типов – с переносом протона, электрона, электронной пары, а также процессы осаждения. Поэтому титриметрические методы обычно классифицируют по типу реакций, лежащих в их основе:
- кислотно-основное (протолитометрическое) титрование;
- осадительное (седиметрическое) титрование;
- комплексометрическое титрование;
- окислительно-восстановительное (редоксиметрическое) титрование.
Наряду с этой классификацией в практической работе часто применяют разделение титриметрических методов в соответствии с типом реагентов, используемых в качестве титрантов, например, алкалиметрия, ацидиметрия, аргентометрия, комплексонометрия, дихроматометрия, йодометрия, перманганатометрия и т. д.
По способу проведения титрования различают методы прямого, обратного и титрования заместителя.
При прямом титровании определяемое вещество непосредственно титруют рабочим раствором известной концентрации (стандартным раствором). Такой способ применим только при выполнении всех требований, приведённых выше.
Если скорость реакции мала, не удаётся подобрать индикатор или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, используют приём обратного титрования. При обратном титровании к анализируемой пробе прибавляют определённый объем стандартного раствора (v1) c концентрацией с1, взятый в избытке, так что после его полного взаимодействия с определяемым веществом в растворе ещё остается свободный титрант, который оттитровывают другим стандартным раствором (с2), затратив объём v2. Разность между первоначально прибавленным количеством титранта и оставшимся непрореагировавшим избытком показывает количество, израсходованное на взаимодействие с определяемым веществом (c1.v1 – c2.v2).
Если реакция нестехиометрична или протекает медленно, применяют титрование заместителя. Для этого проводят стехиометрическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим титрантом.
Титрант – раствор реагента с известной концентрацией, которым производится титрование.
Титрование – это операция добавления титранта к анализируемому веществу.
Точка эквивалентности – точка при титровании, в которой количество добавленного титранта химически эквивалентно количеству титруемого вещества. Термин «стехиометрическая точка» синоним термину «точка эквивалентности».
Конечная точка титрования (КТТ) – точка, в которой прекращается процесс титрования.
Индикаторы – это вещества, окраска которых изменяется при определённом значении параметра системы.
