
- •I. Гравиметрический анализ
- •Сущность метода
- •Процессы, приводящие к загрязнению осадков
- •1.3. Условия получения чистых осадков и гравиметрических форм
- •Условия получения чистых осадков и гравиметрических форм
- •1.4. Расчёты в гравиметрии
- •1.4.1. Расчет результатов анализа
- •1.4.2. Расчет величины навески анализируемой пробы
- •1.4.3. Расчет количества осадителя
- •1.4.4. Расчет потерь при осаждении и промывании твердой фазы
- •1.4.5. Расчёт потерь от растворимости осадка в избытке осадителя,
- •2. Титриметрический анализ. Общие вопросы
- •2.1. Сущность метода
- •2.2. Способы выражения концентрации растворов
- •2.3. Стандартные растворы
- •2.4. Методы установления точной концентрации рабочих растворов
- •2.5. Кривые титрования
- •2.6. Расчет результатов анализа
- •2.7. Расчет погрешности результата титриметрического анализа
- •3. Методы титриметрического анализа
- •Кислотно-основное титрование (протолитометрия)
- •Сущность метода
- •Индикаторы кислотно-основного титрования
- •Кривые титрования
- •Кривые титрования сильного протолита сильным протолитом
- •Кривые титрования слабого протолита сильным протолитом
- •Кривые титрования многопротонных кислот
- •Кривые титрования оснований
- •3.1.3.6. Индикаторные погрешности кислотно-основного титрования
- •Вычисление индикаторных погрешностей
- •3 Части 100 %
- •1 Часть %
- •Окислительно-восстановительное титрование (редоксиметрия)
- •Сущность и классификация методов редоксиметрии
- •Способы обнаружения конца титрования
- •3.2.3. Расчет кривых титрования
- •Расчет индикаторных погрешностей
- •Методы редоксиметрии
- •Перманганатометрия
- •Йодометрия
- •Дихроматометрия
- •Ванадатометрия
- •Броматометрия
- •Комплексометрическое титрование (комплексометрия)
- •3.3.1. Комплексонометрия
- •3.3.1.1. Способы обнаружения конечной точки титрования
- •3.3.1.2. Применение комплексонометрического титрования
- •3.3.1.3. Расчет кривых титрования
- •3.3.1.3. Расчет кривых титрования
- •3.4. Осадительное титрование (седиметрия)
- •3.4.1. Расчет кривых титрования
- •3.4.1. Расчет кривых титрования
- •3.4.2. Способы обнаружения конечной точки титрования
- •Меркурометрия
- •Лабораторные работы по количественному анализу
- •4.1. Гравиметрический метод
- •4.1.1. Определение содержания железа (III) в растворе FeCl3 методом осаждения
- •4.2.Титриметрические методы
- •4.2.1. Метод кислотно-основного титрования
- •4.2.1.1. Работа 1. Приготовление и стандартизация раствора хлороводородной кислоты
- •4.2.1.2. Работа 2. Определение содержания карбоната натрия в растворе
- •4.2.1.2. Работа 2. Определение содержания карбоната натрия в растворе
- •4.2.2. Методы окислительно-восстановительного титрования
- •4.2.2.1. Перманганатометрия . Определение железа (II)
- •4.2.2.1. Перманганатометрия . Определение железа (II)
- •4.2.2.2. Дихроматометрия. Определение содержания железа (III)
- •4.2.2.2. Дихроматометрия. Определение содержания железа (III)
- •Выполнение работы
- •4.2.2.3. Йодометрия. Определение содержания меди (II)
- •Выполнение работы
- •4.2.3. Метод комплексонометрического титрования. Определение общей жёсткости воды
- •Химический анализ реального объекта (творческая работа)
- •5.1. Методология анализа реальных объектов
- •Цель и задачи анализа
- •Изучение литературы
- •Составление схемы анализа и прописи методики
- •Проверка правильности методики анализа
- •Анализ стандартных образцов
- •Анализ «синтетической смеси»
- •Анализ другими методами
- •Методы стандартной добавки к образцу и удвоения навески
- •Результаты анализа и их обсуждение
- •Лабораторный журнал
- •Отчёт по работе
- •Реальные объекты и рекомендованная литература для выполнения творческой работы
- •Список рекомендованной литературы Справочники
- •Монографии
- •Руководства для лабораторных работ
- •Учебники и учебные пособия
- •Математическая обработка результатов анализа
- •Анализ минерального сырья и полезных ископаемых
- •Анализ сплавов
- •Анализ воды
- •Анализ почв
- •Анализ пищевых продуктов
- •Анализ фармацевтической продукции
- •Программа лекционного курса и рекомендованная литература
- •Программа лекционного курса «Аналитическая химия. Часть II» (Количественный анализ. Химические методы)
- •Рекомендованная литература для изучения дисциплины «Аналитическая химия. Часть II» (Количественный анализ. Химические методы) Литература Основная
- •Дополнительная
- •Методические разработки кафедры
3. Методы титриметрического анализа
Кислотно-основное титрование (протолитометрия)
Сущность метода
Кислотно-основной титриметрический анализ основан на реакции взаимодействия между протолитами кислотами и основаниями, которые понимают как обмен протонами между ними.
Титрантами в кислотно-основном титровании служат растворы сильных кислот или сильных оснований (щелочей). Определение веществ титрованием растворами кислот называют ацидиметрией. При этом в растворителе HSolv протекает реакция между ионами лиония и лиата
Solv + H2Solv+ 2 HSolv,
в водном растворе
OH + H3O+ 2 H2O.
Титрование кислот растворами оснований называют алкалиметрией. При этом реакция титрования в растворителе HSolv имеет вид
H2Solv+ + Solv 2 HSolv,
а в водном растворе
H3O+ + OH 2 H2O.
Индикаторы кислотно-основного титрования
Действие индикаторов. Показатель индикатора и интервал перехода окраски. В классическом методе кислотно-основного титрования конечную точку титрования, являющуюся экспериментальной оценкой точки эквивалентности, устанавливают с по-мощью кислотно-основных индикаторов веществ, которые изменяют свой цвет при достижении определенного значения концентрации ионов водорода в титруемом растворе. Если индикатор является слабой кислотой (HIn), то в водном растворе имеем равновесие
HIn + H2O In + H3O+ , (3.1)
причем кислота HIn и сопряжённое ей основание In различаются окраской. В кислой среде преобладает форма HIn (кислотная форма индикатора), а в щелочной среде форма In (основная форма индикатора). К типу кислотных индикаторов относится, например, фенолфталеин.
Если индикатор является слабым основанием, то в водном растворе он участвует в равновесном процессе
In + H2O HIn+ + OH , (3.2)
в этом случае кислотной формой будет HIn+, а основной In. Метиловый оранжевый типичный представитель основных индикаторов. Индикаторы только с одной окрашенной формой называются одноцветными в отличие от двухцветных, у которых обе формы окрашены в разные цвета.
Равновесия (3.1) и (3.2) можно объединить и представить в общем виде как
Ina + H2O Inb + H3O+ .
кислая форма основная форма
Константа этого равновесия называется константой индикатора, которая в концентрационной форме имеет вид
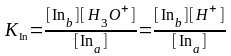 . (3.3)
. (3.3)
 рН = рKIn
(3.4)
рН = рKIn
(3.4)
Значение рKIn называется показателем индикатора. Поскольку индикаторы как протолиты отличаются друг от друга по силе, т. е. обладают различными значениями рKIn, то из соотношения рН = рKIn следует, что они будут изменять свой вид при различных значениях рН в зависимости от KIn (или рKIn ).
Прологарифмируем уравнение (3.3) и изменим знаки на обратные. Получим: lgKInd = lg[Inb] lg[H+] + lg[Ina] или
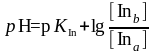 .
(3.5)
.
(3.5)
Это выражение показывает, что при изменении рН раствора изменяется и соотношение между кислотной и основной формами индикатора. Физиологи установили, что если смешать два различно окрашенных раствора с приблизительно равной интенсивностью окраски, то глаз перестает замечать присутствие одного компонента, когда концентрация другого станет примерно в 10 раз больше. Следовательно, если к раствору, в котором индикатор практически полностью находится в кислотной форме, прибавить сильное основание, то первое заметное изменение цвета индикатора наступит при отношении [Inb] : [Ina] = 1 : 10. Если продолжать добавлять основание, это отношение будет нарастать и при pH = pKIn обе формы будут присутствовать в одинаковых кон-центрациях. При последующем повышении рН раствора все больше будет преобладать цвет основной формы, и при [Inb] : [Ina] > 10 : 1 глаз перестает замечать изменение цвета.
Т аким
образом, в соответствии с уравнением
(3.5) изменение цвета индикатора наблюдается
в области рН, заключенной между pKIn+
lg1/10 и pKIn+
lg10, т. е. в интервале
аким
образом, в соответствии с уравнением
(3.5) изменение цвета индикатора наблюдается
в области рН, заключенной между pKIn+
lg1/10 и pKIn+
lg10, т. е. в интервале
pН = рКIn 1 (3.6)
Этот интервал (около 2-х единиц рН), в котором индикатор изменяет свой цвет, называется интервалом перехода окраски соответствующего индикатора. Естественно, наиболее отчетливое изменение цвета будет отмечаться примерно в середине интервала, т. е. при значении рН, близком к показателю индикатора рКIn.
В зависимости от того, является ли индикатор одноцветным или двухцветным и каковы интенсивность окрашивания и цвет его форм, значение рН, при котором переход цвета наиболее отчётлив, может немного отличаться от рКIn. Именно это значение рН, при котором заканчивается титрование, называется показателем титрования рТ.
Характеристики некоторых наиболее часто используемых индикаторов приведены в таблице 2.
В некоторых случаях применяют смешанные индикаторы. Так, метиловый красный и бромкрезоловый зеленый имеют показатели титрования соответственно 5.5 и 4.5, но не резкий переход цвета. Если смешать оба индикатора в подходящих соотношениях, то при рН 5,1 будет наблюдаться отчетливый переход цвета от красного к зеленому.
Кислотно-основной индикатор это растворимое органическое соединение, являющееся в водном растворе слабым протолитом, сопряженные кислота или основание которого обладают разной окраской.
Интервал перехода окраски индикатора это интервал, в котором индикатор изменяет свой цвет.
Показатель титрования (рТ) это значение рН, при котором заканчивается титрование.
Таблица 2. Характеристики некоторых кислотно-основных индикаторов
Индикатор |
рКIn |
Интервал перехода окраски |
рТ |
Цвет |
|
кислотная форма |
основная форма |
||||
Метиловый оранжевый Фенофталеин Бромтимоловый синий Метиловый красный Бромкрезоловый зелёный |
3,5
8,7 7,1
5,0
4,9 |
3,24,4
8,09,8 6,07,6
4,26,2
3,95,4
|
4,0
9,0 7,0
5,5
4,5 |
красный
б/цветный жёлтый
красный
жёлтый |
желтый
розовый синий
жёлтый
синий |
