
- •I. Гравиметрический анализ
- •Сущность метода
- •Процессы, приводящие к загрязнению осадков
- •1.3. Условия получения чистых осадков и гравиметрических форм
- •Условия получения чистых осадков и гравиметрических форм
- •1.4. Расчёты в гравиметрии
- •1.4.1. Расчет результатов анализа
- •1.4.2. Расчет величины навески анализируемой пробы
- •1.4.3. Расчет количества осадителя
- •1.4.4. Расчет потерь при осаждении и промывании твердой фазы
- •1.4.5. Расчёт потерь от растворимости осадка в избытке осадителя,
- •2. Титриметрический анализ. Общие вопросы
- •2.1. Сущность метода
- •2.2. Способы выражения концентрации растворов
- •2.3. Стандартные растворы
- •2.4. Методы установления точной концентрации рабочих растворов
- •2.5. Кривые титрования
- •2.6. Расчет результатов анализа
- •2.7. Расчет погрешности результата титриметрического анализа
- •3. Методы титриметрического анализа
- •Кислотно-основное титрование (протолитометрия)
- •Сущность метода
- •Индикаторы кислотно-основного титрования
- •Кривые титрования
- •Кривые титрования сильного протолита сильным протолитом
- •Кривые титрования слабого протолита сильным протолитом
- •Кривые титрования многопротонных кислот
- •Кривые титрования оснований
- •3.1.3.6. Индикаторные погрешности кислотно-основного титрования
- •Вычисление индикаторных погрешностей
- •3 Части 100 %
- •1 Часть %
- •Окислительно-восстановительное титрование (редоксиметрия)
- •Сущность и классификация методов редоксиметрии
- •Способы обнаружения конца титрования
- •3.2.3. Расчет кривых титрования
- •Расчет индикаторных погрешностей
- •Методы редоксиметрии
- •Перманганатометрия
- •Йодометрия
- •Дихроматометрия
- •Ванадатометрия
- •Броматометрия
- •Комплексометрическое титрование (комплексометрия)
- •3.3.1. Комплексонометрия
- •3.3.1.1. Способы обнаружения конечной точки титрования
- •3.3.1.2. Применение комплексонометрического титрования
- •3.3.1.3. Расчет кривых титрования
- •3.3.1.3. Расчет кривых титрования
- •3.4. Осадительное титрование (седиметрия)
- •3.4.1. Расчет кривых титрования
- •3.4.1. Расчет кривых титрования
- •3.4.2. Способы обнаружения конечной точки титрования
- •Меркурометрия
- •Лабораторные работы по количественному анализу
- •4.1. Гравиметрический метод
- •4.1.1. Определение содержания железа (III) в растворе FeCl3 методом осаждения
- •4.2.Титриметрические методы
- •4.2.1. Метод кислотно-основного титрования
- •4.2.1.1. Работа 1. Приготовление и стандартизация раствора хлороводородной кислоты
- •4.2.1.2. Работа 2. Определение содержания карбоната натрия в растворе
- •4.2.1.2. Работа 2. Определение содержания карбоната натрия в растворе
- •4.2.2. Методы окислительно-восстановительного титрования
- •4.2.2.1. Перманганатометрия . Определение железа (II)
- •4.2.2.1. Перманганатометрия . Определение железа (II)
- •4.2.2.2. Дихроматометрия. Определение содержания железа (III)
- •4.2.2.2. Дихроматометрия. Определение содержания железа (III)
- •Выполнение работы
- •4.2.2.3. Йодометрия. Определение содержания меди (II)
- •Выполнение работы
- •4.2.3. Метод комплексонометрического титрования. Определение общей жёсткости воды
- •Химический анализ реального объекта (творческая работа)
- •5.1. Методология анализа реальных объектов
- •Цель и задачи анализа
- •Изучение литературы
- •Составление схемы анализа и прописи методики
- •Проверка правильности методики анализа
- •Анализ стандартных образцов
- •Анализ «синтетической смеси»
- •Анализ другими методами
- •Методы стандартной добавки к образцу и удвоения навески
- •Результаты анализа и их обсуждение
- •Лабораторный журнал
- •Отчёт по работе
- •Реальные объекты и рекомендованная литература для выполнения творческой работы
- •Список рекомендованной литературы Справочники
- •Монографии
- •Руководства для лабораторных работ
- •Учебники и учебные пособия
- •Математическая обработка результатов анализа
- •Анализ минерального сырья и полезных ископаемых
- •Анализ сплавов
- •Анализ воды
- •Анализ почв
- •Анализ пищевых продуктов
- •Анализ фармацевтической продукции
- •Программа лекционного курса и рекомендованная литература
- •Программа лекционного курса «Аналитическая химия. Часть II» (Количественный анализ. Химические методы)
- •Рекомендованная литература для изучения дисциплины «Аналитическая химия. Часть II» (Количественный анализ. Химические методы) Литература Основная
- •Дополнительная
- •Методические разработки кафедры
I. Гравиметрический анализ
Сущность метода
Гравиметрический метод основан на измерении массы вещества, называемого гравиметрической формой.
Гравиметрической формой называется соединение определяемого компонента, масса которого непосредственно измеряется.
Эту форму чаще всего получают осаждением определяемого компонента из раствора в виде малорастворимого соединения. Осадок отделяют фильтрованием или центрифугированием, высушивают или прокаливают и взвешивают. По массе полученного осадка вычисляют массу или процентное содержание определяемого компонента в анализируемом объекте. Реже определяемый компонент выделяют в виде летучего соединения (метод отгонки).
Однако гравиметрическую форму можно получить также другими способами. Так например, при определении зольности твердого топлива его навеску сжигают и взвешиванием измеряют массу оставшейся золы. Для определения адсорбированной или кристаллизационной воды анализируемое вещество нагревают до температуры, при которой эта вода улетучивается. Гравиметрической формой служит здесь нелетучий остаток; массу воды находят по уменьшению массы вещества при нагревании. Можно также поглощать пары воды подходящим абсорбентом, например безводным перхлоратом магния. Гравиметрической формой служит тогда абсорбент с поглощенной водой, а о массе воды судят по увеличению массы абсорбента.
Гравиметрический анализ применяют для определения основных компонентов исследуемого объекта, содержащихся в нем в больших и средних количествах. Основное достоинство этого метода − высокая точность результатов определений. Погрешность, с которой измеряют массу на обычных аналитических весах, составляет ± 0,0001 г (0,1 мг), а масса осадков, с которыми чаще всего работают, − порядка 0,1 г. Следовательно, относительная погрешность гравиметрического определения, возникающая только от самого взвешивания, составляет (0,0001/0,1) х100% = 0,1%.
Однако при выполнении операций анализа, кроме погрешностей взешивания, возникают и другие погрешности. Они могут быть вызваны потерями вещества в ходе анализа, загрязнениями гравиметрической формы посторонними веществами вследствие соосаждения и другими причинами. Все это увеличивает общую погрешность гравиметрического метода, которая в большинстве случаев составляет 0,2−0,4 %.
При использовании полу- и микровесов, позволяющих взвешивать с погрешностью соответственно ± 5.10−5 и ±1.10−6 г и специальных мерах для уменьшения и устранения других видов погрешностей точность некоторых гравиметрических определений (электрогравиметрического например) может достигать 0,01%. Подобная точность требуется, однако, только в особых случаях, например при изучении стехиометрического состава веществ и материалов (в частности полупроводников), при определении атомных масс элементов, средних и высоких содержаний благородных металлов.
Наиболее существенный недостаток гравиметрического метода анализа − продолжительное время определения, которое делает его неподходящим для тех случаев, когда экспрессность является одним из главных требований. Этого, в частности, требует химико-аналитический контроль производства на многих предприятиях. Поэтому гравиметрические методы постепенно уступают место физико-химическим и физическим методам анализа, которые позволяют одновременно определять и второстепенные компоненты, а также микропримеси.
Однако в тех случаях, когда основным требованием к анализу является высокая точность, предпочтение отдают гравиметрическому методу. Такая необходимость часто возникает в научных исследованиях, при проверке правильности других методов химического анализа, а также при выполнении единичных определений.
Очень часто малорастворимое соединение, в форме которого осаждается определяемый компонент (осаждаемая форма), не обладает точно определенным составом и не может быть использовано для того, чтобы по нему вычислить количество этого компонента.
Осаждаемой формой называется соединение, в форме которого осаждается определяемый компонент.
В таких случаях при помощи соответствующей химической и термической обработки оно должно быть превращено в другое вещество со строго определенным составом, которое можно взвешивать и использовать для вычисления массы определяемого компонента.
Так, в слабокислой среде (рН 4) ион Fе3+ можно осадить в виде основного ферриацетата Fе(ОН)х(СН3СОО)у, в котором содержание гидроксил- и ацетат-ионов колеблется в зависимости от количества реагентов, рН, температуры осаждения и других факторов. При прокаливании это соединение полностью превращается в оксид железа Fе2Oз и в этой форме взвешивается.
Следовательно, основной ферриацетат представляет осаждаемую форму для определения железа (III), которой соответствует гравиметрическая форма Fе2Oз. В некоторых случаях осаждаемая и гравиметрическая формы могут совпадать (например, при определении Ва2+ в виде ВаSО4).
Соединение, используемое в качестве осаждаемой формы, должно отвечать следующим требованиям:
а) обладать достаточно малой растворимостью;
б) получаться в возможно более чистом виде;
в) не содержать примесей, которые только частично улетучиваются при высушивании и прокаливании;
г) образовываться в форме, удобной для последующей обработки (фильтрования, прокаливания). Особенно подходящими в последних двух отношениях являются осадки, состоящие из хорошо сформированных достаточно крупных кристаллов (крупнокристаллические осадки).
При высушивании или прокаливании осаждаемой формы нужно, чтобы она полностью превращалась в соответствующую гравиметрическую форму, которая должна удовлетворять следующим требованиям:
а) иметь точно определенный известный стехиометрический состав и не изменяться при хранении (не окисляться кислородом воздуха, не поглощать влаги или СО2, не разлагаться самопроизвольно);
б) включать определяемый компонент, который обладает малым гравиметрическим фактором (в этом случае возможные ошибки, допущенные в ходе работы, в гораздо меньшей степени отразятся на результатах определения компонента).
Гравиметрическим фактором F (стехиометрический фактор, фактор пересчёта) называют отношение молярных масс определяемого компонента и гравиметрической формы с учетом коэффициентов реакции превращения определяемого компонента в гравиметрическую форму.
В общем случае
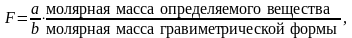 (1.1)
(1.1)
где а и b небольшие целые числа, на которые нужно умножить молярные массы, чтобы числа молей в числителе и знаменателе были химически эквивалентны.
Гравиметрический фактор вычисляют (Пример 1) с точностью до четвертой значащей цифры. Его можно найти также в справочных руководствах по аналитической химии.
Пример I. Сколько граммов С1 содержится в 0,204 г осадка АgС1?
Решение. Из формулы АgСl видно, что n(АgС1) = п(Сl).
Поскольку
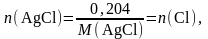 а
а
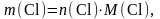 то
то
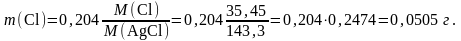
Число 0,2474 =

Осаждаемая форма это соединение, в форме которого осаждается определяемый компонент.
Гравиметрическая форма это соединение определяемого компонента, масса которого непосредственно измеряется.
Гравиметрический фактор (F) это отношение молярных масс определяемого компонента и гравиметрической формы с учетом коэффициентов реакции превращения определяемого компонента в гравиметрическую форму.
