- •Тема№3. Протиінфекційний імунітет Імунітет і його основна функція
- •Загальна характеристика антигенів
- •Основні властивості речовин-антигенів
- •Антигени бактерій і вірусів
- •Антитіла (імуноглобуліни). Характеристика основних класів імуноглобулінів
- •Динаміка утворення антитіл
- •Теорії синтезу антитіл
- •Структура імунної системи організму
- •Антигенпрезентуючі клітини
- •Структура і функція головного комплексу гістосумісності
- •Генетична карта головного комплексу гістосумісності
- •Механізми захисту організму від збудників захворювань
- •Альтернативний шлях активації
- •Класичний шлях активації комплементу
- •Механізм імунного захисту організму
- •Імунні системи шкіри і слизових оболонок
- •Генетичні та ідіотипні механізми регуляції імунної відповіді
- •Класифікація гіперчутливості за Coombs I Gell
- •Основні клінічні алергічні проби
- •Способи гіпо - і десенсибілізації організму
- •Гіперчутливість сповільненого типу
- •Трансплантаційний імунітет
- •Аутоімунні реакції
- •Особливості протипухлинного імунітету
- •Імунодефіцитні стани. Дослідження імунного статусу людини. Імунокорекція Класифікація імунодефіцитів і їх характеристика
- •1. Імунодефіцити в-системи імунітету
- •2. Імунодефіцити т-системи імунітету
- •4. Вади системи фагоцитозу
- •5. Вади системи комплементу
- •Лікування імунодефіцитних станів
- •Дослідження імунного статусу організму
- •Оцінка гуморального імунітету - стану в-системи
- •1. Визначення концентрації імуноглобулінів у сироватці (тест Манчіні)
- •5. Кількісні тести визначення в-лімфоцитів
- •1. Шкірні проби гіперчутливості сповільненого типу
- •2. Стимуляція лімфоцитів in vitro
- •3. Кількісні тести визначення т-лімфоцитів
- •4. Визначення субпопуляцій т-лімфоцитів
- •5. Функціональна оцінка т-хелперів
- •7. Цитотоксична активність к- і пк-клітин
- •Принципи імунокорекції
Механізми захисту організму від збудників захворювань
Механізми неспецифічної резистентності організму
Ознайомившись з основними дійовими особами імунної системи, розглянемо, яким же чином наш організм захищається від збудників захворювань, мутантних клітин, пухлин, яким чином підтримується гомеостаз? Здатність організму протистояти інвазії мікроорганізмами обумовлена двома механізмами: розвитком імунних реакцій на основі гуморальних (антитіл) і клітинних факторів і так званою природньою або неспецифічною резистентністю.
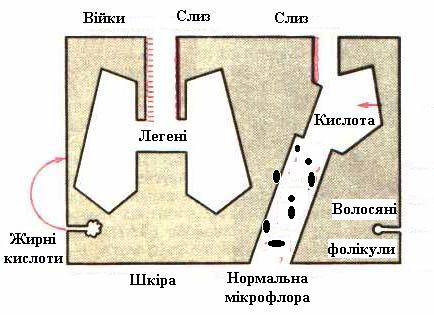
Коли мова йде про імунологічні механізми захисту, то розуміють, що кожен організм реагує на конкретний мікроорганізм по своєму, специфічно. Водночас природній, неспецифічний захист передбачає в основному одноманітні механізми реакції на будь-які збудники. Ці механізми теж обумовлені як гуморальними, так і клітинними компонентами. Причому вони пов'язані з дією речовин, які впливають на гуморальні і клітинні фактори господаря таким чином, щоб стимулювати неспецифічну резистентність. Як правило, ці речовини не діють безпосередньо на мікроорганізми. Першою лінією захисту від збудників є непошкоджена шкіра (рис. 7.15). На поверхні шкіри мікроби зазнають згубного впливу молочної кислоти, поту і ненасичених жирних кислот сальних залоз. Бактерії, які прилипли до шкіри, видаляються при злущенні епідермісу. Слизові оболонки виділяють слиз, який діє як захисний ба р'єр, перешкоджає прикріпленню бактерій до епітеліальних клітин і сприяє їх видаленню. Слиз із носа, сльози, слина і сеча містять бактерицидний фермент лізоцим. Крім того слина і молоко мають лактопероксидазну систему, яка діє бактерицидно.
|
Рис. 7.15. Перша лінія захисту від інфекції. |
Мікроби та інші чужорідні частинки разом із слизом видаляються також механічно за рахунок коливальних рухів миготливо го епітелію з кашлем і при чханні.
У шлунку проникненню бактерій перешкоджають соляна кислота й ферменти, бактерицидними властивостями володіють продукти розщеплення жовчних кислот, що утворюються в тонкому кишечнику, кислий вміст піхви, простатичний сік і сім'яна рідина.
Велике значення має мікробний антагонізм, асоційований із нормальною мікрофлорою людини. Про що йшлося на попередніх лекціях. а) гуморальні фактори
До гуморальних факторів неспецифічної резистентності відносять: лейкіни - речовини одержані з нейтрофілів, які згубно впливають на грампозитивну флору, еритрин, отриманий з еритроцитів, що вбиває дифтерійну паличку, b-лізини, які виділяються тромбоцитами і затримують ріст в основному спороносних мікробів, пропердин, що сприяє лізису клітин. У загрудинній залозі, селезінці, нирках містяться спермін і спермідин, які інактивують мікобактерії туберкульозу.
Дуже важливим гуморальним фактором є лізоцим (мурамідаза). Лізоцим міститься в багатьох секретах людини: слині, сльозах, слизу, молоці, в різних тканинах організму. Концентрація лізоциму в сльозах в 150 раз вища, ніж у сироватці. Вважають, що основна кількість лізоциму синтезується тканинними макрофагами і юними нейтрофілами. Лізоцим продукується теж в синовіальних оболонках, хрящовій тканині, сльозовій, слинній і молочній залозах. Щоденно в плазму здорової людини надходить приблизно 150 мг лізоциму. Ця речовина має багато біологічних функцій. Так, наприклад, зниження концентрації лізоциму в слині може обумовити розвиток запальних процесів порожнини рота, а закупорка сльозової протоки призводить до інфекційних захворювань рогівки ока. Лізоцим стимулює фагоцитарну реакцію організму, синтез антитіл. Зменшення його кількості в крові викликає зниження рівнів комплементу, пропердину, b-лізинів у сироватці крові. Лізоцим має виражену бактерицидну і бактеріостати чну дію на різні види мікробів, особливо грампозитивну флору. Великий вплив на резистентність до інфекції має вміст вільного заліза в організмі. Відомо, що залізо необхідне для росту бактерій. Чим більше вільного заліза в організмі, тим активніше розвиваються мікроорганізми. Але вільного заліза в організмі порівняно мало, що пояснюється присутністю у здорової людини білків, які зв'язують його (лактоферин, трансферин). У той же час багато патогенних бактерій синтезують хелатуючі залізо речовини - сидерофори, які здатні забирати залізо у білків, що зв'язали його (від трансферину, лактоферину, сидерофорів інших бактерій).У вірулентних бактерій сидерофори тісно зв'язані з клітинною стінкою і є ЛПС. Чим більше є в крові вільного заліза або трансферину, насиченого Fe2+, тим швидше розвиваються вірулентні бактерії. У різних клінічних ситуаціях, які супроводжуються надлишковою концентрацією заліза в організмі, може зростати ймовірність виникнення інфекції. Такі стани гіперферемії спостерігають у хворих з гемолітичною анемією, при руйнуванні печінкових клітин, що містять феритин, при надлишку заліза, пов'язаного з екзогенним джерелом. Наприклад, найчастіше причиною смерті при серповидно-клітинній анемії є бактеріальні інфекції (бактеріальні менінгіти, сальмонельоз, бартонельоз).
Трансферинова недостатність може бути причиною схильності до інфекції, яка, зрозуміло, пов'язана з появою значної кількості вільного заліза. Тому так часто трагічно закінчуються перитоніти, що супроводжуються внутрішньою кровотечею. У відповідь на бактеріальну інфекцію чи на стимуляцію бактеріальни ми ендотоксинами організм обмежує присутність заліза в крові шляхом гальмування абсорбції заліза з кишечника, трансферин відкладає залізо у феретині, а висока температура при інфекційному процесі пригнічує продукцію сидерофорів.
Не можна обминути і значення у неспецифічній резистентнос ті деяких вітамінів. Відомо, що надлишок вітаміну А індукує неспецифічні механізми захисту, а недостатня його кількість сприяє інфікованості господаря збудником. Встановлено, що недостатність цього вітаміну обумовлює плоскоклітинну метаплазію дихального епітелію і таким чином призводить до порушення захисних механізмів проти респіраторних захворювань. Вже протягом тривалого часу ведеться дискусія з приводу ефективності вітаміну С в запобіганні простудних захворювань і підвищенні стійкості до інфекційних хвороб. Великий внесок у дослі дження цієї проблеми зробив відомий вчений Л.Полінг, який свої спостереження опублікував у знаменитій книзі "Вітамін С і простуда". Він показав, що тварини, які мають ендогенне джерело вітаміну С, не хворіють простудою. Можливим механізмом впливу вітаміну С на резистентність організму є підсилення ним хемотаксису поліморфноядерних лейкоцитів. Стимуляція вітаміном С функції лейкоцитів може корегувати ваду, яка спостерігається при синдромі Чедіяка-Хігасі. Цей синдром супроводжується частими гнійними інфекціями, що виникають внаслідок аномальної функції лейкоцитів (порушено злиття фагосом із лізосомами).
б) фагоцитоз
Велике значення у неспецифічному захисті організму відіграє явище фагоцитозу (рис. 7.16), яке вперше було відкрите видатним вітчизняним вченим І.І. Мечниковим. Захоплення і перетравлювання бактерій здійснюється двома типами клітин - мікро(рис. 7.17)- і макрофагами (рис. 7.18). До мікрофагів відносять поліморфноядерні нейтрофіли. Вони належать до так званих "професіональних фагоцитів". Поліморфноядерні лейкоцити - це нетривало існуюча популяція клітин, яка першою з`являється у вогнищі запалення. У результаті стимуляції через дихальний вибух накопичується велика кількість метаболітів і гідролітичних продуктів, спрямованих на знищення бактерій як в клітинах, так і поза їх межами. У певних умовах можливе пошкодження оточуючих тканин похідними кисню. Гранулоцити виробляють більше 10 ферментів (кислі протеїнази, міелопероксидазу, лактоферин, лужну фосфатазу, лізоцим тощо) достатніх для деградації більшості ліпідів, полісахаридів і білків чутливих бактерій. Нейтрофіли продукують основні метаболіти арахідонової кислоти (лейкотриєни, простагландини), але менш активні, ніж моноцити.
|
Рис. 7.16. Фагоцитоз. |
|
Рис. 7.17. Мікрофаги. |
|
Рис. 7.18. Макрофаги. |
Макрофаги утворюють моноцитарно-фагоцитарну систему фагоцитів. Ця система розміщена всюди: у сполучній тканині, навколо базальних мембран кровоносних судин, у легенях (альвеолярні макрофаги), в печінці (клітини Купфера) тощо. Макрофаги здатні до міграції і цілеспрямованого хемотаксису. Речовини, що визначають напрям руху макрофагу, називають хемоантрактантами. До них належать: фрагменти системи комплементу, глобуліни, лімфокіни, продукти деградації фібрину, колагену і клітин. Поступове підключення різних хемоантрактантів забезпечує постійний приплив нових макрофагів із судинного русла. Велике значення для знешкодження чужорідного антигена мають фактори, які гальмують міграцію макрофагів і затримують їх у вогнищі запалення: інтерферон, гіалуронова кислота, лімфокіни, імунні комплекси, гепарин, глюкокортикоїди, цитостатики.
Підсилюють же міграцію макрофагів нуклеїнат натрію, левамізол, a-амінокапронова кислота.
Щоб відбувся фагоцитоз мікроорганізм повинен адсорбуватись на поверхні нейтрофілу або макрофагу. Вважають, що розпізнавання макрофагами клітин-мішеней може бути пов'язане через взаємодію вуглеводзв'язуючих білків (лектиноподібні молекули). Відомо, що принциповою ознакою лектину є здатність зв'язуватись із певним цукром. На поверхні макрофагу виявлено поки що три типи лектиноподібних рецепторів, що беруть участь у макрофагонагляді - маннозний, галактозний і фукозний. Від них залежить і адсорбція бактерій на фагоциті, яка може здійснюватись трьома способами: 1. Бактерії на своїй поверхні несуть лектини, які зв'язуються з комплементарними вуглеводами на поверхні фагоцита.
2. Лектини є складовою частиною мембрани фагоцита і зв'язують вуглеводні залишки бактерій.
3. Формування мостиків між бактеріями і фагоцитами здійснюється за рахунок зв'язків лектин-вуглевод. (Ці хімічні структури можуть бути як на мембрані фагоциту, так і на поверхні бактерії).
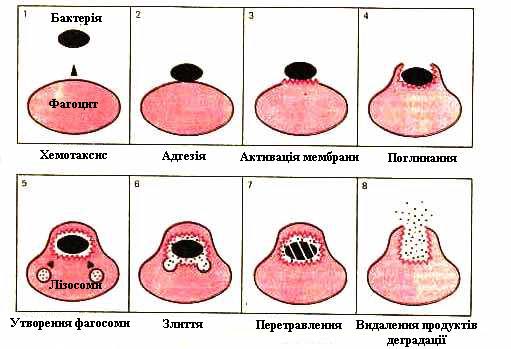
Частинка, яка адсорбувалася на мембрані фагоцита, започатковує фазу поглинання шляхом активізації актин-міозинової скорочувальної системи, що призводить до утворення псевдоподій навколо неї. У міру того, як близькорозміщені рецептори приєднуються до мікроба, плазматична мембрана насувається на нього, поки він не опиниться у вакуолі (фагосомі). Після того події розгортаються швидко, і протягом хвилини плазматичні гранули зливаються з фагосомою і впорскують у неї свій вміст. Знищення чужорідних клітин здійснюється за двома механізмами - кисень залежним і кисень незалежним. При кисень залежному механізмі утворюються біологічноактивні речовини, які згубно діють на фагоцитований субстрат: надпероксидний аніон, пероксид водню, гідроксильні радикали тощо. При кисень незалежному механізмі створюються оптимальні умови для функціювання катіонних білків, які руйнують бактерійну мембрану. Певне значення тут мають лізоцим, лактоферин, низьке значення pH. Таким чином, у фагоцитозі виділяють такі основні стадії: (рис. 7.19)
|
Рис. 7.19. Стадії фагоцитозу. |
Наближення фагоцита і мікроба в результаті позитивного хемотаксису.
Адгезія мікроорганізма на поверхні фагоцита.
Активація мембрани фагоцита, що обумовлює поглинання мікроорганізму.
Внутриклітинне перетравлення чужорідної частинки і видалення продуктів розпаду за межі клітини.
Встановлено, що частинки фагоцитуються, якщо вони більш гідрофобні, ніж фагоцити. Наприклад, мікобактерії і лістерії - гідрофобні, тому вони добре фагоцитуються. У той же час пневмококи і клебсіели більш гідрофільні і тому слабо фагоцитуються. Мікроорганізми виробили цілий ряд пристосувань, які захищають їх від цієї лінії захисту організму. Наприклад, мікобактерії туберкульозу і лепри, бруцели, потрапивши в цитоплазму макрофагу, здатні навіть розмножуватись (туберульозні палички пригнічують злиття фагосом з лізосомами, оболонка збудника лепри стійка до дії ферментних систем фагоцита). Деякі рикетсії здатні залишати фагосоми й існувати безпосередьо в цитоплазмі, легіонели пригнічують механізм дихального вибуху і таке інше.
Явище, коли мікроорганізми не перетравлюються у фагоциті, отримало назву незавершеного фагоцитозу .
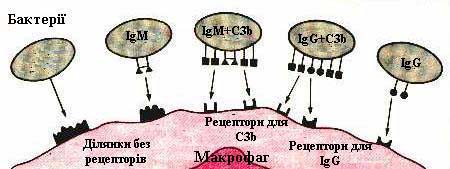
Стимулюють фагоцитарну активність лейкоцитів антитіла, компоненти комплементу (рис. 7.20), лімфокіни, простагландини та інше .
|
Рис. 7.20. Фактори, які стимулюють фагоцитарну активність. |
Таблиця 4
Чинники, які сприяють різним стадіям фагоцитозу.
Хемотаксис |
Опсонізація |
Руйнування |
Перетравлювання |
С5а |
IgG1, IgG3 |
Лізосоми |
Лізосомні ензими |
Тафтсин |
С3b |
ОН, О, НО, О, ОС1 |
|
ФХЕ |
Фібронектин |
Лактоферин |
|
Лейкотрієни |
IgM |
Лізоцим |
|
Стінки бактерій |
Псевдоподії |
Кислі рН |
|
Підсумовуючи все сказане про фагоцити й фагоцитоз, треба наголосити, що мононуклеарні фагоцити (моноцити і тканинні ма крофаги) є не тільки клітинами першої лінії захисту, а, по суті,. клітинами - фабриками для забезпечення організму продуктами першої необхідності. Вони беруть участь у синтезі всіх компонентів комплементу, біоактивних ліпідів - речовин циклооксигеназного і ліпооксигеназного шляхів. Макрофаги є активними продуцентами протеолітичних ферментів, ліпази, лізосомальної гідролази, дезамінази, лізоциму. Значний внесок макрофаги вносять у постачання білків екстрацелюл ярного матриксу і адгезійних клітинних молекул: фібронектину, тромбоспондану, протеогліканів. Вони синтезують білки, які здатні зв'язувати метали (трансферин, ізоферитини), вітаміни (транскобаламін), ліпіди, фактори росту тощо. Макрофаги беруть участь у процесах коагуляції, продукуючи фактори V, VII, IX, X, а також протромбіназу, інгібітори плазміну; синтезують стероїдні гормони, продукти пуринових і піримідино вих основ. Однак особливого значення набувають і продукти їх синтезу, що мають властивості гормонів. До таких гормональних пептидів відносять еритропоетин, бомбезин, соматотропін, ендорфін, фібробласт активуючі фактори, АКТГ, інтерлейкіни (ІЛ-1, ІЛ-6, ІЛ-8), інтерферони, фактор некрозу пухлин та інше. Якраз ці продукти макрофагів є найбільш важливими комунікаційними й медіаторними молекулами в запальних та імунних реакціях. в) система комплементу
Одночасно з фагоцитозом спрацьовує інша потужна система захисту - система комплементу. Комплемент- це складний комплекс білків (близько 20), які формують каскадну ферментну систему. Компоненти комплементу позначаються літерою С із зазначенням порядкового номера (С1, С2, С3...С9). У нормі в сироватці крові знаходяться найважливіші компоненти комплементу в неактивному стані. Одночасно там присутні і фракції, що здатні пригнічувати певні активовані компоненти цієї системи. Суттю каскадної активації системи комплемента є те, що кожен із перших п'яти компонентів у результаті активації перетворюється на фермент, який розщеплює наступний компонент і надає йому властивостей фермента. Яким же чином реагує система комплементу при появі в організмі чужорідної генетичної інформації? Вона активується по різному залежно від того, чи в організмі вже синтезувались антитіла на даний агент, чи таких антитіл ще немає. Тому і говорять про класи чний шлях активації комплементу (за наявності антитіл) і альтернативний шлях (за їх відсутності). Тож давайте більш детально ознайомимось із механізмом реагування системи комплементу.