- •Тема№3. Протиінфекційний імунітет Імунітет і його основна функція
- •Загальна характеристика антигенів
- •Основні властивості речовин-антигенів
- •Антигени бактерій і вірусів
- •Антитіла (імуноглобуліни). Характеристика основних класів імуноглобулінів
- •Динаміка утворення антитіл
- •Теорії синтезу антитіл
- •Структура імунної системи організму
- •Антигенпрезентуючі клітини
- •Структура і функція головного комплексу гістосумісності
- •Генетична карта головного комплексу гістосумісності
- •Механізми захисту організму від збудників захворювань
- •Альтернативний шлях активації
- •Класичний шлях активації комплементу
- •Механізм імунного захисту організму
- •Імунні системи шкіри і слизових оболонок
- •Генетичні та ідіотипні механізми регуляції імунної відповіді
- •Класифікація гіперчутливості за Coombs I Gell
- •Основні клінічні алергічні проби
- •Способи гіпо - і десенсибілізації організму
- •Гіперчутливість сповільненого типу
- •Трансплантаційний імунітет
- •Аутоімунні реакції
- •Особливості протипухлинного імунітету
- •Імунодефіцитні стани. Дослідження імунного статусу людини. Імунокорекція Класифікація імунодефіцитів і їх характеристика
- •1. Імунодефіцити в-системи імунітету
- •2. Імунодефіцити т-системи імунітету
- •4. Вади системи фагоцитозу
- •5. Вади системи комплементу
- •Лікування імунодефіцитних станів
- •Дослідження імунного статусу організму
- •Оцінка гуморального імунітету - стану в-системи
- •1. Визначення концентрації імуноглобулінів у сироватці (тест Манчіні)
- •5. Кількісні тести визначення в-лімфоцитів
- •1. Шкірні проби гіперчутливості сповільненого типу
- •2. Стимуляція лімфоцитів in vitro
- •3. Кількісні тести визначення т-лімфоцитів
- •4. Визначення субпопуляцій т-лімфоцитів
- •5. Функціональна оцінка т-хелперів
- •7. Цитотоксична активність к- і пк-клітин
- •Принципи імунокорекції
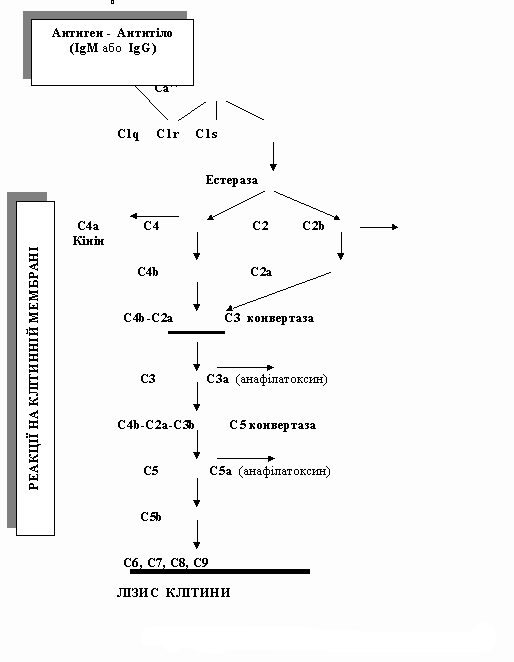
Класичний шлях активації комплементу
Коли в організмі антитіла синтезувались на збудник у систему захисту включається класичний шлях активації комплементу.
 Схема
2.Класичний
шлях активації комплементу.
Схема
2.Класичний
шлях активації комплементу.
Можна вважати, що антитіло виникло як специфічний чинник для реакції з тими мікроорганізмами, які нездатні запустити альтернативнй шлях активаціі комплементу. Як відомо деякі антитіла (IgG i IgM) в районі шарнірної ділянки мають рецептори до CIq компонента комплементу. Особливо активно зв'язує комплемент IgМ. Але ця здатність антитіл проявляється лише після того, як вони своїми активними центрами з'єднуються з антигенами. Таким чином, антитіло, взаємодіючи з мікроорганіз мом, зв'язує і активує перший компонент комплементу C1q. Останній об'єднується з С1r i C1s в єдиний комплекс. Активований C1s взаємодіє з наступним компонентом комплементу С4, в результаті розщеплення якого утворюються два його фрагменти: С4а і C4b. C4b може зв'язатись з комплексом антитіло - С1 або з поверхнею мікроорганізму. У присутності іонів Mg компонент С2 здатний утворювати сполуку з С4b, формуючи субстрат для C1s. Виникає комплекс C4b2a, який має виражену конвертазну активність відносно С3. Цей комплекс володіє такою ж специфічністю, як і попередньо згадувана нами конвертаза альтернативного шляху - С3bBb. З цього моменту весь процес подальшої активації комплементу відбувається таким же чином, як і в альтернативному шляху. Одна молекула C3b приєднується до комплексу C4b2a і перетворює його у фермент, який здатний розщепити компонент С5. Врешті-решт через послідовну активацію молекул С6, С7, С8, С9 виникає мембраноатакуючий комплекс, що руйнує мікробну мембрану. Конвертаза класичного шляху активації комплементу, як і C3bBb, перебуває під контролем відповідних факторів (G, C4bp, CR1).
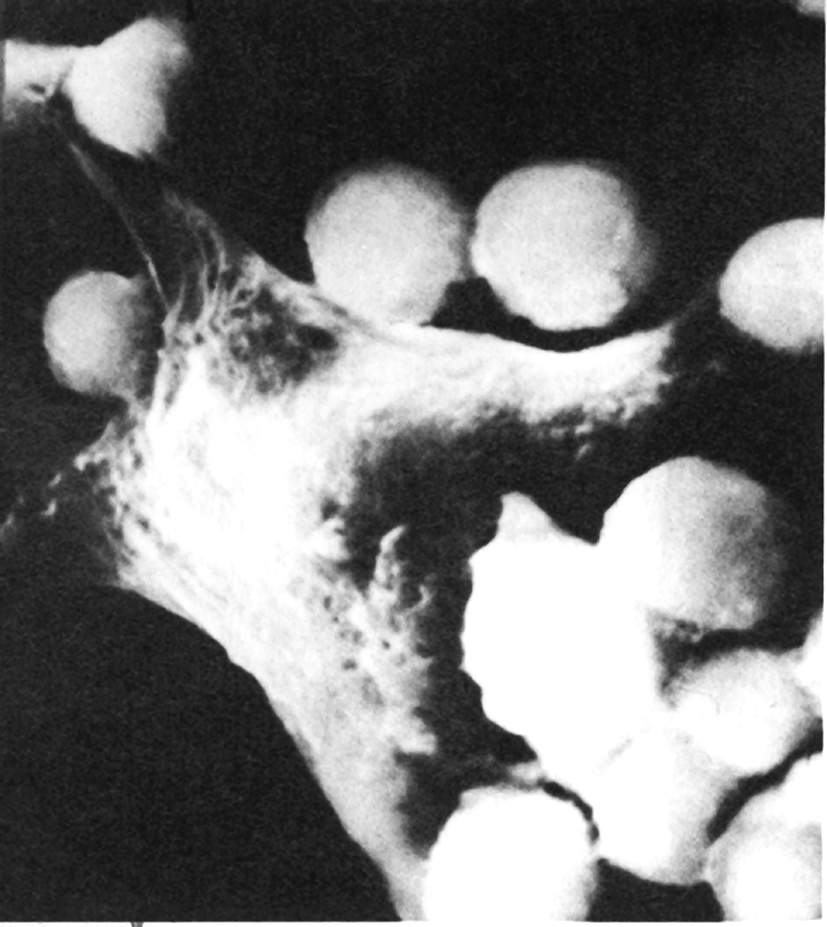
Таким чином, сценарій захисту організму виглядає так. Все розпочинається з активації комплементу альтернативним шляхом. Конвертаза C3bBb закріплюється на поверхні бактерії і розкладає значну кількість С3. Фрагмент С3а виділяється, а численні молекули C3b зв'язуються з мембраною мікроорганізму. Це активує наступний етап з утворенням С5а і мембраноатакуючого комплексу. У подальшому на сцену подій виходять С3а і С5а. Вони сприяють вивільненню медіаторів із тучних клітин і разом з ними залучають у вогнище проникнення мікроба інші компоненти системи комплементу і поліморфноядерні нейтрофіли. Все це обумовлює посилення кровотоку, розширення дрібних судин, а скорочення клітин ендотелію капілярів дозволяє білкам плазми виходити із судин. Нейтрофіли сповільнюють рух біля стінок капілярів, проникають в отвори між ендотеліальними клітинами і пересуваються за градієнтом концентрації хемотаксичних факторів, поки не зустрінуться з бактерією, покритою C3b. Далі відбувається зв'язування мікроорганізму з C3b рецепторами нейтрофіла, С3а і С5а різко активують клітинне дихання і миттєво настає руйнування бактеріальної клітини (рис. 7.23). Ці процеси обумовлюють відповідні симптоми: гіперемію, набряк, біль. Так, гіперемія є наслідком розширення капілярів, набряк - результат ексудації білків плазми. Описані прояви а також накопичення нейтрофілів характерні для гострої запальної реакції.
|
Рис. 7.23. Презентація антигену Т-хелперу. |
Слід зауважити, що сам комплемент здатний безпосередньо інактивувати деякі віруси й за відсутності антитіл, наприклад, ряд ретровірусів. Це можливе тому, що деякі вірусні білки є рецепторами C1q. Ряд даних свідчить, що віруси можуть активувати комплемент і альтернативним шляхом. Крім названих механізмів розповсюдження збудника може бути обмежене ферментами , що вивільнюються із пошкоджених тканин і активують згортальну систему крові. До таких речовин відносять С - реактивний білок, сироватковий амілоїдний А - білок, a1- антитрипсин, a2 - макроглобулін, фібриноген, церулоплазмін тощо.
С - реактивний білок за участю іонов кальцію здатний зв'язуватись з деякими мікроорганізмами, до складу мембрани яких входить фосфорилхолін. Комплекс, який при цьому утворюється, активує систему комплементу класичним шляхом. При цьому С3b зв'язується з мембраною бактерії, яка легко фагоцитується завдяки наявності на поверхні фагоцита рецепторів С3b.
г) інтерферони
Особливе значення в системі неспецифічного захисту організму надається інтерферонам. Розрізняють три основні типи інтерферонів: a-інтерферон (лейкоцитарний), b-інтерферон (фібробласний) і g-інтерферон (імунний). Кожен тип включає підтипи, які розрізняються, наприклад, за чутливістю до рН. 25 представників родини a-інтерферону і два підтипи b-інтерферону гетерогенні і розрізняються за молекулярною масою і амінокислотними послідовностями. Гама-інтерферон не має підтипів.
Альфа-інтерферону притаманна антивірусна і антипроліфера тивна дія. Він пригнічує проліферацію мононуклеарів крові у відповідь на дію антигенів, мітогенів за рахунок специфічної цитотокси чності, підсилює кілерну активність лімфоцитів відносно пухлин, може підвищувати продукцію лейкотриєна В4, гальмувати виділення лейкотриєна С4, що можна використати для пригнічення анафілактичних і запальних реакцій. Бета-інтерферон регулює проліферацію і функціональну активність макрофагів, підсилює їх протипухлинну активність, активує природні кілери. Гама-інтерферон - природній регулятор імунної відповіді - володіє також противірусною і протипухлинною активністю, підвищує вираженість (експресію) антигенів гістосумісності І і ІІ класів. Синтез цього виду інтерферону відбувається під впливом бактерійних і вірусних антигенів, лектинів, певною мірою впливає на виділення інтерферону ІЛ-2, лейкотриєни В4, С4, D4.
При вірусній інфекції клітини активно синтезують інтерферон і секретують його у міжклітинний простір, де він зв'язується з специфічними рецепторами сусідніх незаражених клітин. Інтерферон не діє безпосередньо на віруси. Після його взаємодії з рецепторами клітин настає дерепресія й активація генів, які локалізовані у людини на 21 хромосомі. Це приводить до формування 12 нових внутрішньоклітинних білків, які відсутні в клітинах, на які не подіяв інтерферон. При цьому різко, в десятки разів, зростає синтез двох нових ферментів - синтетази і протеїнкінази. Синтетаза розщеплює мРНК, пригнічуючи подовження поліпептидного ланцюга, водночас активує в цих клітинах протеїнкіназу, що перебуває там у неактивному стані. Протеїнкіназа фофорилює фактор ініціації, інактивує його і тим самим гальмує трансляцію вірусного геному.
Таким чином, під впливом інтерферону в клітинах синтезується два ферменти, один з яких гальмує синтез вірусних білків, а другий розщеплює вірусні РНК, що утворились. Врешті-решт навколо вогнища вірусної інфекції утворюється бар'єр із неінфікованих клітин. Необхідно зауважити, що інтерферони відіграють значну роль у боротьбі з вірусами, але не в запобіганні вірусних інфекцій.
Чинники, які стимулюють виділення інтерферону. Першим і найбільш важливим інтерфероногеном є вірусна інфекція. Інтерферон виробляється при заражені практично будь-яким вірусом, як РНК- так і ДНК-містким, причому РНК-місткі віруси - хороші індуктори, тоді як ДНК-геномні, за винятком поксвірусів слабий. Кінетика синтезу інтерферону однакова для всіх вірусів загалом його продукція починається приблизно через 4 години після зараження і досягає вершини, коли синтез вірусних білків відбувається з максимальною швидкістю, і потім знижується .
Другим сильним стимулятором синтезу інтерферону є дволанцюгова РНК. Це природні дволанцюгові РНК, в тому числі РНК реовірусів, реплікативні форми РНК- містких вірусів, а також синтетичні дволанцюгові полірибонуклеотиди. У той же час ні од ноланцюгова РНК чи ДНК, ні дволанцюгова ДНК або гібридні РНК-ДНК не здатні бути інтерфероногенами. Активні інтерферо ногени повинні бути відносно стійкими до рибонуклеази.
Наступним основним класом індукторів інтерферону є віруси, які нездатні реплікуватись. Наприклад, віруси в непермісивних клітинах або інактивовані віруси. Частково можна пояснити цей факт наявністю у цих вірусів дволанцюгової РНК, яка здатна із них вивільнюватись. Напевне тому інактивований ультрафіоле том реовірус у 200 разів ефективніший, ніж стимулятор інтерферону порівняно з неінактивованим, тому що в зараженій клітині перший розпадається із вивільненням дволанцюгової РНК. Недавно було відкрито новий аспект індукції інтерферону вірусами і їх компонентами. Доведено, що деякі структурні білки (білок фібрил аденовіруса і глікопротеїн HN віруса Сендай) володіють мітогенною активністю відносно В-лімфоцитів і стимулюють утворення інтерферону в клітинах селезінки.
Іншими інтерфероногенами, які запускають синтез невеликої кількості інтерферону можуть бути бактеріальні ендотоксини, збудники трахоми, мікоплазми, найпростіші, рикетсії, полімери поліакрилової кислоти, малеїнова кислота тощо.
Ще одну важливу групу стимуляторів виділення інтерферону складають метаболічні активатори. У першу чергу до них відносять мітогени для нестимульованих лімфоцитів і специфічні антигени для імунних лімфоцитів, промотори пухлинного росту (бутират, бромдезоксиуридин, дексаметазон, диметилсульфоксид), речовини, які пригнічують утворення мРНК або синтез білка. Дія інтерферонів, як і гормонів, реалізується на плазматичній мембрані клітини під час їх сполучення з особливими рецептора ми. Чітко встановлено, що інтерферон у середині клітини, в якій він синтезується, не є біологічно активним. Спочату він повинен виділитись, а потім знову адсорбуватись клітинами.
д ) природні кілери
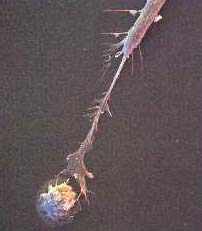
Віруси, як відомо, здатні розмножуватись тільки в клітинах господаря, використовуючи їх репродуктивні механізми. Без сумніву, господар зацікавлений знищити ці заражені клітини до того, як вірус почне в них розмножуватись. Якраз це контролюють і виконують особливі клітини організму - природні кілери (ПК) (рис. 7.22). Вони здатні розпізнавати вірусні антигени, які з'являються на мембрані інфікованих клітин. Завдяки цій властивості ПК клітини вибирають серед безлічі клітин тільки ті, які уражені вірусом.
|
Рис. 7.22. Природні кілери. |
Процес відбувається таким чином. Як тільки рецептор природного кілера зв'язується з клітиною, зараженою вірусом, ПК-клітина активується і впорскує вміст своїх гранул (білок перфорин) у позаплазматичний простір інфікованої клітини. За своєю структурою перфорин подібний до С9 компонента комплемента і, як і він, може вбудовуватись у мембрану клітини - мішені. Там молекули перфорину полімеризуються, при цьому утворюється трансмембранний канал, що і призводить до лізису клітини. Разом з клітиною знищуються і всі віруси, які були в ній. При цьому ПК-клітина залишаєть ся непошкодженою і здатна вступати в контакт із наступною мішенню. Таке явище дістало назву "смертельного поцілунку".
Природні (нормальні) кілери - незалежна від тимусу самостійна популяція мононуклеарних клітин. Вони містяться у великій кількості в периферичній крові, селезінці та інших органах. Цитотоксичність ПК, виділених із цих органів - різна. Найбільша активність зафіксована у лімфоцитів периферичної крові, найменша - в клітинах кісткового мозку. Вважають, що природні кілери виконують в організмі різноманітні функції: контролюють ріст первинних і метастатичних пухлинних клітин, контролюють розвиток мікробних і вірусних інфекцій, виробляють медіатори, беруть участь в імунорегулюючих процесах, контролюють проліферацію і диференціацію гемопоетичних клітин, започатковують розвиток трансплантаційного імунітету. Важливо підкреслити, що природні кілери стійкі до іонізуючої радіації і не фагоцитуються.
Останнім часом велика увага приділяється фібронектину , у якого виявлено виражену імуногенну активність. У цьому складному білку матеріалізовано зв'язок системи імунітету із внутрішнім середовищем організму. Фібронектин здатний одними активними центрами приєднуватись до рецепторів клітин (макрофагів, нейтрофілів тощо), а іншими зв'язувати імунні комплекси (через C1q) або грампозитивні бактерії. Фібронектин має спеціальні структури для приєднання до фібрину, гепарину, колагену. Він володіє опсонізуючою функцією, здатний фіксувати і обмежувати розповсюдження мікробних антигенів і імунних комплексів у тканинах організму. Таким чином, в організмі постійно існує і функціонує розгалужена система вродженого природнього захисту від чужорідних агентів, основу якої складають різноманітні активні речовини, що знаходяться в сироватці крові, секретах, тканинах, органах. Складовою цієї системи є також нормальна мікрофлора організму, яка має виражені антагоністичні властивості відносно багатьох збудників. Мікрофаги, макрофаги та природні кілери здатні успішно знищувати чужорідні та змінені власні клітини, бактерії, віруси. Все це створює першу лінію захисту організму, яка успішно протистоїть збудникам інфекційних захворювань.
Як приклад синергійної взаємодії різних факторів неспецифіч ної та специфічної резистентності, наводимо основні чинники, що забезпечують протимікробний захист слизових оболонок (табл. 4).
Таблиця 5
Основні чинники протиінфекційного захисту слизових оболонок.
Факти вроджені, неспецифічні |
Фактори специфічні, набуті |
|||
фізичні |
гуморальні |
клітинні |
гуморальні |
Клітинні |
Рух війок |
Лізоцим |
РЕС |
Секреторні |
В-ліфмоцити |
Змивання |
Лактоферин |
Фагоцитоз |
антитіла IgA, |
|
Виділення |
Інтерферон |
Нейтрофіли |
Ig M |
|
Чхання |
Пропердин |
Еозинофіли |
Тканинні – |
Е-ліфмоцити |
Кашель |
Пептиди |
Макрофаги |
антитіла IgG, |
|
Злущення |
Пероксидаза |
|
IgE |
|
епітелію |
Комплемент |
|
|
|