
- •Розділ 1. Виникнення хімії та принципи періодизації історії хімії
- •1.1. Виникнення хімії
- •1.2. Географія виникнення хімії
- •1.3. Періодизація історії хімії
- •Розділ 2. Від давнини до р. Бойля
- •Хімічні знання в передалхімічний період
- •2.2. Теоретичні уявлення стародавніх людей про природу
- •2.2.1. Грецькі елементи-стихії
- •2.2.2. Грецька атомістика
- •2.3. Алхімічний підперіод
- •2.3.1. Олександрія
- •Арабський період алхімії
- •2.3.3. Хімія в Індії та Китаї
- •2.3.4. Алхімія в Європі
- •Виникнення та розвиток іатрохімії
- •2.4.1. Обумовленість виникнення
- •2.4.2. Представники іатрохімії
- •2.4.3. Зачатки технічної хімії у XVI та XVII століттях
- •Розділ 3. II період історіЇ хімії. Учення про склад (Період об’єднання хімії)
- •3.1 Умови розвитку природознавства в другій половині XVII століття
- •3.2. Роберт Бойль. Експериментальна хімія та атомістика XVII століття
- •3.3. Теорія флогістону
- •Пневматична хімія
- •Уявлення про хімічну спорідненість у XVII – XVIII столітті
- •3.6. Підперіод анти флогістонної системи. Хімічна революція
- •3.6.1. Французька революція та наука
- •3.6.2. Біографія Лавуазьє
- •2.6.3. Боротьба Лавуазьє з алхімією та теорією флогістону
- •3.6.4. Експериментальні принципи Лавуазьє
- •3.6.5. Лавуазьє та атомістика XVIII століття
- •3.6.6. Ломоносов, як попередник Лавуазьє
- •3.7. Нова школа та хімічна номенклатура
- •Розділ 4. Розвиток методів хімічного аналізу
- •4.1. Виникнення хімічного аналізу
- •Розвиток аналітичної хімії у XVIII столітті
- •4.2.1. Виникнення способу аналізу за допомогою паяльної трубки
- •4.2.2. Виникнення хімічної мінералогії
- •4.2.3. Становлення хімічного аналізу твердих мінеральних тіл вологим шляхом
- •4.2.4. Виникнення аналізу мірою
- •4.3. Розвиток хімічного аналізу в першій половині XIX століття
- •4.3.1. Розробка спеціальних методичних основ хімічного аналізу
- •4.3.2. Становлення систем хімічного аналізу
- •4.3.3. Розвиток методів та системи об’ємного аналізу
- •4.3.4. Відкриття спектрального аналізу
- •5.1.2. Закон еквівалентів Ріхтера (сполучних ваг)
- •5.1.3. Закон простих співвідношень. Виникнення хімічної атомістики. Джон Дальтон
- •5.1.4. Закони сполучення газів між собою, Гей-Люсак
- •5.1.5. Гіпотеза Авогадро
- •5.1.6. Закон ізоморфізму
- •5.1.7. Закон Дюлонга та Пті
- •5.1.8. Гіпотеза Праута
- •5.1.9. Електрохімічні дослідження. Закони електролізу
- •5.2. Атомістичні уявлення Берцеліуса
- •5.3. Атомна реформа Каніцаро
- •Розділ 6. Періодична система елементів (розвиток III періоду іСторії хімії)
- •6.1. Відкриття та класифікація хімічних елементів до середини XIX століття
- •6.1.1 Накопичення знань про елементи
- •6.1.2. Відкриття елементів та розвиток хімії
- •6.1.3. Хибні відкриття
- •6.2. Теорія валентності
- •6.2.1. Зародження теорії валентності (атомності)
- •6.2.2. Багатовалентність
- •6.3. Спроби класифікації та систематизації хімічних елементів до відкриття періодичного закону
- •6.4. Періодична система елементів д.І.Менделєєва
- •6.4.1. Передумови відкриття періодичного закону
- •6.4.2. Біографічні дані Дмитра Івановича Менделєєва та його роботи до 1869 року
- •6.4.3. Перша спроба системи елементів. Зміна форми таблиці
- •6.4.4. Тріумф закону
- •Розділ 7. Історія органічної хімії від виникнення до утвердження структурної теорії
- •7. 1. Періодизація історії органічної хімії
- •7.2. Зародження органічної хімії
- •7.3. Аналітичний (другий) період
- •7.3.2. Відкриття ізомерії
- •7.3.4. Доструктурні теорії
- •7.3.4.1. Теорії радикалів
- •7.3.4.2. Теорії типів
- •7.4. Розвиток уявлень про валентність та хімічний зв’язок
- •7.5. Виникнення та розвиток класичної теорії хімічної будови
- •7.5.1. Передумови її виникнення
- •7. 5. 2. Теорія хімічної будови та її розвиток. Питання пріоритету
- •7.6. Теорії спорідненоємності
- •7.7. Стереохімія
- •7.8. Органічний аналіз у структурний період
- •7.9. Препаративна органічна хімія. Тріумф органічного синтезу
- •7.10. Прикладна органічна хімія
- •8.1.2. Періодизація історії фізичної хімії
- •8.2 Виникнення термодинаміки. Хімічна термодинаміка
- •8.3. Розчини та електролітична дисоціація
- •8.3.1. Рауль і кріоскопія
- •8.3.2. Електролітична дисоціація
- •8.4. Кінетика та каталіз хімічних реакцій
- •8.4.1 Закони газового стану. Кінетична теорія
- •8.4.2 Хімічна кінетика
- •8.4.3 Каталіз
- •8.5. Фізична органічна хімія
- •8.5.1. Вступ
- •8.5.2. Теорія резонансу
- •8.5.3. Теорія перехідних станів
- •Розділ 9. Неорганічна хімія та хімічна технологія від початку третього періоду до наших днів
- •9.1. Вступ
- •9.2. Нова металургія
- •9.3. Порошкова металургія
- •9.4. Хімія неметалів
- •9.5. Елементоорганічна хімія
- •Розділ 10. Розвиток хімічної науки та хімічної промисловості в Україні
- •10.1 Вступ. Донауковий період хімії в Україні
- •10.2. Роль наукових і освітянських центрів у становленні та розвитку хімії в Україні
- •10.2.1. Предтечі університетів.
- •10.2.2. Університети в Україні до 1917 р.
- •10.3. Національна Академія Наук України. Профільні інститути.
- •10.4. Хімічна промисловість на Україні
- •10.4.1. Азотна промисловість на Україні
- •10.4.2. Промисловість фарбників та напівпродуктів на Україні
- •Головні хімічні підприємства України
- •Розділ 2. Від давнини до р. Бойля . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .13
- •Розділ 4. Розвиток методів хімічного аналізу . . . . . . . . . . . . . . . . . . . . . . . 58
7. 5. 2. Теорія хімічної будови та її розвиток. Питання пріоритету
Багато іноземних істориків хімії, особливо німці, вважали, що творцем структурної хімії був Кекуле, а заслуга Бутлерова була лише в тому, що він термін конституція тіл запропонував замінити на структуру тіл. Так, саме Кекуле (паралельно з Купером) встановив чотирьохвалентнісь вуглецю та його здатність сполучатися між собою в ланцюги. Але хіміки того часу, Лоран, Жерар,. Кольбе, та й сам Кекуле до 1864 року під конституцією розуміли перш за все просторове розміщення атомів. Саме Бутлеров першим зрозумів, що просторовою (фізичною ) будовою на перших порах можна знехтувати, оскільки хіміки ще не мали методів її встановлення. Він відкинув на невизначений час питання про просторову будову, котру, як він вважав, можуть у майбутньому встановити фізики, а натомість запропонував розглядати лише хімічну будову.
Основне положення теорії Бутлерова : хімічні властивості речовин визначаються не лише складом, а й хімічною будовою, тобто тим, які атоми та як між собою зв’язані хімічним зв’язком. З цього положення випливає висновок, що хімічна будова випливає з властивостей (вона доступна для пізнання та визначення), а будова прогнозує (визначає) властивості. Саме завдяки цьому положенню навіть на Заході останнім часом деякі вчені (Інгольд, Рассел ) стали визнавати пріоритет Бутлерова в створенні теорії будови. Бутлеров вважав, що структурна формула виражає не тільки будову, а й властивості. На перше місце в процесі вивчення хімічної будови Бутлеров висував реакції синтезу.
Інше важливе положення теорії Бутлерова – про взаємний вплив атомів, про що на Заході ніхто й ніколи навіть не підіймав питання.
Таким чином, питання про пріоритет випливає з поняття, що є основою структурної теорії. Якщо за основу сприймати чотирьохвалентність вуглецю та його здатність утворювати ланцюги, тоді пріоритет, безумовно, за Кекуле, якщо ж за основу класти хімічну будову та взаємний вплив атомів, тоді пріоритет за Бутлеровим.
Розглядаючи науку в історичному аспекті, треба пам’ятати, що тут усе взаємопов’язане та взаємообумовлене: якби не було відкриттів Кекуле, не було б відкриттів і Бутлерова, якби не було відкриттів Бутлерова, не було б і внеску Вант – Гофа (стереоізомерія) і так далі і тому подібне.
Питання про пріоритет – питання політики та етики. Наука взагалі колективна творчість, тому вона інтернаціональна: Лавуазьє і Берцеліус не в останню чергу досягли видатних результатів тому, що отримували та обмінювались інформацією з ученими всього світу. Такий обмін інформацією, взаємні зв’язки та персональне спілкування сприяє прогресу. При цьому, на нашу думку, вченого перш за все повинно цікавити не те, хто зробив перший крок, а те, як зробили наступний. З точки зору етики питання про пріоритет узагалі не повинно ставитись, бо для вченого важливо не лише не принижувати власної гідності (у тому числі і національної), але й не принижувати гідності колеги незалежно від його національності. Перефразуючи біблію чи прислів’я – не копай іншому яму ..., можна сказати: якщо хочеш, щоб об тебе не витирали ноги, не витирай свої об інших.
На доповідь Бутлерова науковий світ майже не прореагував, але його теорія дуже швидко знайшла загальне визнання , бо самому Бутлерову та його школі вдалося майже повністю розв’язати питання про ізомери. Він практично зразу запропонував позиційну ізомерію скелета. Правда, він допускав ще одну ізомерію, пов’язану з різницею одиниць спорідненості (зв’язків) в атомі вуглецю. Пояснюючи цю гіпотезу, Бутлеров в 1862 році запропонував тетраедричну (правда не симетричну) модель атома вуглецю. Однак досліди самого Бутлерова та інших вчених [наприклад, Карл Шорлеммер ( 1834 – 1892 ) – німецький хімік, що працював в Англії, в 1864 році несподівано для самого себе виявив, що ізомерія двох етанів, водневого етилу ( С2Н5 Н) та диметилу (СН3 СН3) – фікція] дозволили Бутлерову вже в 1863 році в статті про ізомерію відмовитися від цієї гіпотези. В цій статті він пояснив випадки позиційної ізомерії, які були загадкою для Кольбе та Кекуле. В 1863 році він випадково та несподівано одержав третичний бутанол:
 CH3
CH3
C H3 CH3 C CH3 [C(CH3)3]
Zn + CO CH3 = O
CH3 CH3 O H
H
Потім вже свідомо та цілеспрямовано було синтезовано декількох його гомологів. Таким чином Бутлеров уперше відкрив існування скелетної ізомерії і в наступному 1864 році передбачив скелетну ізомерію в ряду насичених вуглеводнів для бутану та пентану:
 CH3
CH3
CH3
CH3
CH3
CH3
CH3
CH3
CH2 CH3 CH2 CH CH3
C4H10 = CH2 = CH CH3 ; C5H12 = CH2 = CH2 CH3 = C
CH3 CH3 CH2 CH3 CH3
CH3 CH3
Як бачимо, Бутлеров для зображення структури використовував типові формули. Уже в 1866 році він отримує ізобутан. Саме ці роботи, як і роботи інших учених з ізомерії, сприяли визнанню теорії хімічної будови. Не менше значення для утвердження теорії зіграв і розвиток органічного синтезу.
Важко назвати в історії хімії іншу теорію, яка б отримала ще більше експериментальних підтверджень, ніж структурна теорія. А проте її відкидали Кольбе в Германії, Бертло у Франції та М.О. Меншуткін у Росії. Стриману позицію з відношення до теорії будови займав Менделєєв. Бертло мовчазливо визнав себе переможеним в 90–і роки і перестав писати формули через еквіваленти. Меншуткін в 1885 році став читати замість Бутлерова, що захворів, лекції з органічної хімії, а після смерті Бутлерова заступив його на кафедрі органічної хімії, залишаючись прихильником теорії вуглецевих типів та теорії заміщення. Але вже в другому виданні своїх лекцій з органічної хімії він користується і теорією будови, і теорією заміщення (1891 рік). В 3-му та 4-му виданні своїх лекцій застосовує лише теорію будови і стає її безумовним прибічником. Лише Кольбе вмер, залишаючись супротивником цієї теорії.
Великий внесок у розвиток положення про взаємний вплив атомів уніс учень Бутлерова – Володимир Васильович Марковников (1837 – 1904), який запропонував багато правил про залежність властивостей молекул від їх будови. Його правило про приєднання до подвійного зв’язку повинно бути добре відомим студентам.
П итання
про кратність вуглецевих зв’язків було
поставлене із самого початку зародження
теорії будови. Уже Лошмідт в 1861 році
писав формули етилену та ацетилену з
кратними зв’язками:
итання
про кратність вуглецевих зв’язків було
поставлене із самого початку зародження
теорії будови. Уже Лошмідт в 1861 році
писав формули етилену та ацетилену з
кратними зв’язками:
Загально вживані нині формули СН2 = СН2 та СН СН були вперше запропоновані Ерленмейером в 1865 році. Але паралельно існували ще дві гіпотези: про двох- і трьохвалентний вуглець та про вільні одиниці спорідненості. Останні дві гіпотези поступово відпали під натиском фактів. Один із таких фактів – установлення в 1869 році Марковниковим правила, що елементи води та галоген водневих кислот завжди відщеплюються від двох сусідніх атомів вуглецю. Це, очевидно, показувало, що при відщеплені утворюється подвійний зв’язок. Уже в 1870 році Бутлеров в опублікованій ним статті дійшов висновку, що гіпотеза про кратні зв’язки дає хороші пояснення геометричній ізомерії. З того часу поняття про кратні зв’язки стійко ввійшли в структурну теорію. Але все ж старі теорії час від часу підіймались на щит і пізніше. Наприклад, Фіттіг у кінці 70-х років, Неф у 90-ті, Чічібабін на початку 20-го століття знов повернулися до ідеї двохвалентного вуглецю в ненасичених сполуках. Однак, тільки квантова хімія внесла ясність у це питання.
Кекуле з великим успіхом поширив теорію хімічної будови на ароматичні сполуки. Сам Кекуле через 25 років розповідав, що формула бензолу приснилась йому в кріслі перед каміном, коли він задрімав у ньому. Принаймні, можливо, у нього в пам’яті випливали формули Лошмідта, із роботою якого Кекуле був знайомий.
Ось, наприклад, формули бензолу (А), крезолу (Б) та бензилового спирту (В) у Лошмідта (1861):

А![]() ось формули Кекуле (1865) для бензолу та
бензилового спирту, де стрілочки вказують
на замикання ланцюга:
ось формули Кекуле (1865) для бензолу та
бензилового спирту, де стрілочки вказують
на замикання ланцюга:
 Г
Д
Г
Д
В тому ж 1865 році Кекуле для бензолу запропонував дві схематичні формули (Е) та (Ж), із яких друга повинна була вказувати на чергування місць, що їх займають замісники в похідних бензолу. Однак, оскільки факти свідчили на користь рівноцінності всіх шести місць у бензолі, Кекуле в 1866 році запропонував інше зображення вуглецевого ядра в бензолі (3).
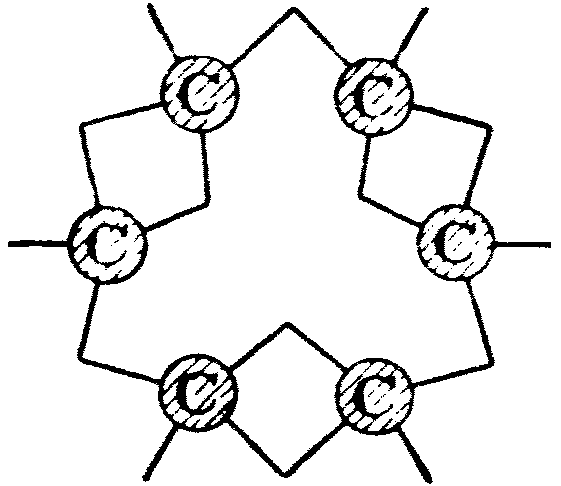







Е Ж З К
У формулі (З) у графічному зображенні бензолу між двома сусідніми атомами вуглецю появляється подвійний зв’язок, а формула може бути представлена у ще простіший спосіб (К). А оскільки ця формула, що вказує на нерівноцінність сусідніх зв’язків, і, таким чином, передбачає супроти фактів існування двох ізомерних орто-заміщених похідних, критикувалась, Кекуле у 1872 році спробував спасти свою формулу, запропонувавши гіпотезу про швидку осциляцію зв’язків у бензолі

 ,
,
у результаті чого всі шість зв’язків СС у бензолі стають однаковими.
Теорія Кекуле залишилась би безплідною для органічної хімії, якби не була підтверджена експериментальними фактами, багато з яких були вже тоді відомі. Так, наприклад, Кекуле пояснив ізомерію гідроксибензойних кислот різним відносним положенням двох замісників – ОН та СООН, як і в разі двохосновних фенолів, всі ізомери яких були передбачені та синтезовані.
Однією з важливих проблем, поставлених теорією Кекуле, було експериментальне визначення положення замісників у шестичленному ядрі – проблема, як її тоді називали, “визначення хімічного місця”. Розв’язання її було знайдено одним з учнів Кекуле Вільгельмом Корнером (Körner, 1839 – 1925), професором Вищої землеробської школи в Мілані, який в 1869 – 1874 роках провів вирішальні дослідження в цьому напрямку. Справа в тому, що у двох заміщеному похідному можна встановити положення замісників, виходячи з того, що похідна 1,2 (орто) утворює при введенні третього замісника дві похідних (1,2,3 та 1,2,4), похідна 1,3 (мета) утворює три похідних (1,2,3; 1,3,4 та 1,3,5), тоді як похідна 1,4 (пара) може призвести до отримання лише однієї похідної (1,2,4) речовини.
Метод Корнера не має, однак, загального застосування, тому що при безпосередньому заміщенні не завжди утворюються передбачувані теорією ізомери; і все ж таки він мав велике значення для становлення теорії ароматичних сполук і дозволив розв’язати проблему, не розв’язану самим Кекуле.
Теорія Кекуле зіграла важливу роль у становленні хімії ароматичних сполук, оскільки вона відповідала експериментальним фактам і вченню про валентність. Але частина хіміків не могли зрозуміти, чому бензол із його осцилюючими подвійними зв’язками має незрозумілу стабільність, адже в аліфатичному ряду подвійний зв’язок є найслабшим місцем, по якому перш за все йдуть реакції. Тому, шукаючи пояснення цій невідповідності, хіміки придумували для молекули бензолу різні формули, поки не з’явилася сучасна квантовохімічна теорія валентності.
Формула Л була запропонована Адольфом Клаусом (1832 – 1900) в 1867 році, М – Дьюаром в 1867 році, Н – Альбертом Ладенбургом (1842 – 1911) в 1869 році, О – Генрі Армстронгом (1848 – 1937) в 1887 та Баєром в 1888 роках, П – Джузеппе Оддо (1865 – 1954) в 1901 році. У вершинах цих фігур стоять групи СН.







Л М Н О П
Остаточне розв’язання питання про будову бензолу знайшла лише квантова хімія.
