
- •Розділ 1. Виникнення хімії та принципи періодизації історії хімії
- •1.1. Виникнення хімії
- •1.2. Географія виникнення хімії
- •1.3. Періодизація історії хімії
- •Розділ 2. Від давнини до р. Бойля
- •Хімічні знання в передалхімічний період
- •2.2. Теоретичні уявлення стародавніх людей про природу
- •2.2.1. Грецькі елементи-стихії
- •2.2.2. Грецька атомістика
- •2.3. Алхімічний підперіод
- •2.3.1. Олександрія
- •Арабський період алхімії
- •2.3.3. Хімія в Індії та Китаї
- •2.3.4. Алхімія в Європі
- •Виникнення та розвиток іатрохімії
- •2.4.1. Обумовленість виникнення
- •2.4.2. Представники іатрохімії
- •2.4.3. Зачатки технічної хімії у XVI та XVII століттях
- •Розділ 3. II період історіЇ хімії. Учення про склад (Період об’єднання хімії)
- •3.1 Умови розвитку природознавства в другій половині XVII століття
- •3.2. Роберт Бойль. Експериментальна хімія та атомістика XVII століття
- •3.3. Теорія флогістону
- •Пневматична хімія
- •Уявлення про хімічну спорідненість у XVII – XVIII столітті
- •3.6. Підперіод анти флогістонної системи. Хімічна революція
- •3.6.1. Французька революція та наука
- •3.6.2. Біографія Лавуазьє
- •2.6.3. Боротьба Лавуазьє з алхімією та теорією флогістону
- •3.6.4. Експериментальні принципи Лавуазьє
- •3.6.5. Лавуазьє та атомістика XVIII століття
- •3.6.6. Ломоносов, як попередник Лавуазьє
- •3.7. Нова школа та хімічна номенклатура
- •Розділ 4. Розвиток методів хімічного аналізу
- •4.1. Виникнення хімічного аналізу
- •Розвиток аналітичної хімії у XVIII столітті
- •4.2.1. Виникнення способу аналізу за допомогою паяльної трубки
- •4.2.2. Виникнення хімічної мінералогії
- •4.2.3. Становлення хімічного аналізу твердих мінеральних тіл вологим шляхом
- •4.2.4. Виникнення аналізу мірою
- •4.3. Розвиток хімічного аналізу в першій половині XIX століття
- •4.3.1. Розробка спеціальних методичних основ хімічного аналізу
- •4.3.2. Становлення систем хімічного аналізу
- •4.3.3. Розвиток методів та системи об’ємного аналізу
- •4.3.4. Відкриття спектрального аналізу
- •5.1.2. Закон еквівалентів Ріхтера (сполучних ваг)
- •5.1.3. Закон простих співвідношень. Виникнення хімічної атомістики. Джон Дальтон
- •5.1.4. Закони сполучення газів між собою, Гей-Люсак
- •5.1.5. Гіпотеза Авогадро
- •5.1.6. Закон ізоморфізму
- •5.1.7. Закон Дюлонга та Пті
- •5.1.8. Гіпотеза Праута
- •5.1.9. Електрохімічні дослідження. Закони електролізу
- •5.2. Атомістичні уявлення Берцеліуса
- •5.3. Атомна реформа Каніцаро
- •Розділ 6. Періодична система елементів (розвиток III періоду іСторії хімії)
- •6.1. Відкриття та класифікація хімічних елементів до середини XIX століття
- •6.1.1 Накопичення знань про елементи
- •6.1.2. Відкриття елементів та розвиток хімії
- •6.1.3. Хибні відкриття
- •6.2. Теорія валентності
- •6.2.1. Зародження теорії валентності (атомності)
- •6.2.2. Багатовалентність
- •6.3. Спроби класифікації та систематизації хімічних елементів до відкриття періодичного закону
- •6.4. Періодична система елементів д.І.Менделєєва
- •6.4.1. Передумови відкриття періодичного закону
- •6.4.2. Біографічні дані Дмитра Івановича Менделєєва та його роботи до 1869 року
- •6.4.3. Перша спроба системи елементів. Зміна форми таблиці
- •6.4.4. Тріумф закону
- •Розділ 7. Історія органічної хімії від виникнення до утвердження структурної теорії
- •7. 1. Періодизація історії органічної хімії
- •7.2. Зародження органічної хімії
- •7.3. Аналітичний (другий) період
- •7.3.2. Відкриття ізомерії
- •7.3.4. Доструктурні теорії
- •7.3.4.1. Теорії радикалів
- •7.3.4.2. Теорії типів
- •7.4. Розвиток уявлень про валентність та хімічний зв’язок
- •7.5. Виникнення та розвиток класичної теорії хімічної будови
- •7.5.1. Передумови її виникнення
- •7. 5. 2. Теорія хімічної будови та її розвиток. Питання пріоритету
- •7.6. Теорії спорідненоємності
- •7.7. Стереохімія
- •7.8. Органічний аналіз у структурний період
- •7.9. Препаративна органічна хімія. Тріумф органічного синтезу
- •7.10. Прикладна органічна хімія
- •8.1.2. Періодизація історії фізичної хімії
- •8.2 Виникнення термодинаміки. Хімічна термодинаміка
- •8.3. Розчини та електролітична дисоціація
- •8.3.1. Рауль і кріоскопія
- •8.3.2. Електролітична дисоціація
- •8.4. Кінетика та каталіз хімічних реакцій
- •8.4.1 Закони газового стану. Кінетична теорія
- •8.4.2 Хімічна кінетика
- •8.4.3 Каталіз
- •8.5. Фізична органічна хімія
- •8.5.1. Вступ
- •8.5.2. Теорія резонансу
- •8.5.3. Теорія перехідних станів
- •Розділ 9. Неорганічна хімія та хімічна технологія від початку третього періоду до наших днів
- •9.1. Вступ
- •9.2. Нова металургія
- •9.3. Порошкова металургія
- •9.4. Хімія неметалів
- •9.5. Елементоорганічна хімія
- •Розділ 10. Розвиток хімічної науки та хімічної промисловості в Україні
- •10.1 Вступ. Донауковий період хімії в Україні
- •10.2. Роль наукових і освітянських центрів у становленні та розвитку хімії в Україні
- •10.2.1. Предтечі університетів.
- •10.2.2. Університети в Україні до 1917 р.
- •10.3. Національна Академія Наук України. Профільні інститути.
- •10.4. Хімічна промисловість на Україні
- •10.4.1. Азотна промисловість на Україні
- •10.4.2. Промисловість фарбників та напівпродуктів на Україні
- •Головні хімічні підприємства України
- •Розділ 2. Від давнини до р. Бойля . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .13
- •Розділ 4. Розвиток методів хімічного аналізу . . . . . . . . . . . . . . . . . . . . . . . 58
7.4. Розвиток уявлень про валентність та хімічний зв’язок
В 1857 році Кекуле дійшов висновку про двохвалентність кисню, трьохвалентність азоту та чотирьохвалентність вуглецю. Під валентністю він розумів кількість одиниць спорідненості, які здатні насичуватися в разі сполучення. Звідси зразу виникає поняття про міжатомний, тобто хімічний зв’язок. Кекуле вже в 1859 році застосував своєрідні графічні формули, які дозволили йому зрозуміти, чому вуглеводні мають загальну формулу
С nH2n
+ 2
:
nH2n
+ 2
:
Шотландець Арчібалд Купер (1831 – 1891) в 1858 році майже одночасно з Кекуле оприлюднив свою теорію, згідно з якою хімічна спорідненість спричинює утворення сполук, найвища ступінь спорідненості вуглецю дорівнює 4, тому він здатен приєднувати еквівалентну кількість водню, хлору, тощо, та сполучатися самим із собою, утворюучи вуглець-вуглецеві зв’язки. Він запропонував зображення зв’язків, як це можна показати на прикладі формули оцтової кислоти:


 О
O Н
О
O Н
 С
C = 12 ; O = 8.
С
C = 12 ; O = 8.
 О2
О2
 С
Н3
С
Н3
Йозеф Лошмідт (1821 – 1895), фізик із Відня, запропонував формули органічних сполук, які, наприклад, для оцтової та для мурашиної кислот мали вигляд :
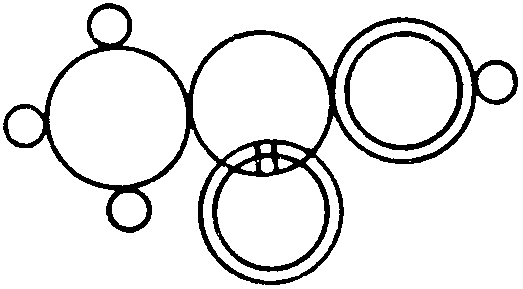
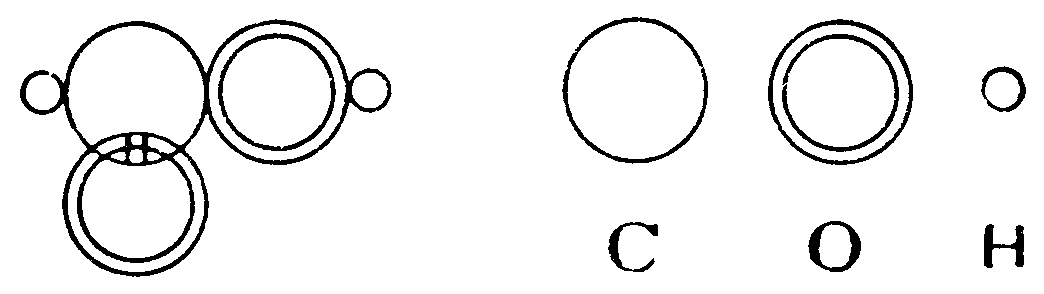
;
За допомогою таких формул дійсно можна було зобразити хімічну будову багатьох органічних молекул і навіть віддзеркалити у формулах ізомерію. Але недолік цих формул у тому, що розподіл зв’язків, як правило, нічим не було аргументовано (на відміну від Бутлерова), тому і Купер, і Лошмідт поряд із правильними дали багато неправильних формул.
7.5. Виникнення та розвиток класичної теорії хімічної будови
7.5.1. Передумови її виникнення
Необхідною умовою її виникнення було створення вчення про валентність, поява поняття хімічного (міжатомного) зв’язку та встановлення правильних поглядів на атоми, молекули, атомні та молекулярні ваги, і , як наслідок , усунення з хімії всіх формул, в яких знаки елементів відповідали еквівалентам. Але найважливішим досягненням за 40 років (1840 – 1880) Бутлеров вважав установлення поняття про молекулу, бо тільки після цього внаслідок прагнення до більш правильного визначення хімічної натури речовин розвинулось поняття хімічної будови.
В органічній хімії до початку 60-х років ясно відчувалась потреба заміни існуючих теорій новою. Краще всіх ситуацію зрозумів сам Бутлеров, який вважав, що потрібен здібний до узагальнення спеціаліст, який був би здатен звільнитися від застарілого, із якого не виробилось нічого такого, що б досить розвинулось. Таким і виявився Бутлеров, який не був заражений традиціоналізмом у такій мірі, як його сучасник Кекуле, він був вихованцем російської школи хіміків, в якій був дуже розвинутий критичний дух, і в рамках якої вже сформувались окремі уявлення та терміни, що потім увійшли в теорію хімічної будови. Бутлеров добре знав теоретичні досягнення Заходу. Переходячи від однієї західної теорії до іншої у пошуках виходу з незадовільного становища, що склалося, він прийшов до своєї власної теорії . Ця теорія, увібравши в себе всі західні досягнення , стала основою органічної хімії на багато років. Вона не тільки чудово пояснювала факти, але й мала колосальну пророчу силу .
Олександр Михайлович Бутлеров (1828 - 1886) закінчив Казанський університет, у студентські роки спочатку захоплювався ентомологією, потім під впливом Карла Клауса та Н.Н. Зініна ( на той час викладачі Казанського університету ) узявся за хімію. В 1857 – 1858 роках побував у Парижі та Берліні , став членом Паризького хімічного товариства. Повернувшись до Казані, пере облаштував хімічну лабораторію, де вів свої дослідження й одночасно викладав. Бутлеров розпочав викладати свої ідеї теорії хімічної будови на лекціях студентам ще в 1860 році , але в повному та відшліфованому вигляді виклав їх під час своєї другої закордонної поїздки у своїй доповіді на З’їзді німецьких природодослідників 16 вересня 1861 року в Шпейєрі. В 1864 році він видав чудовий підручник “Вступ до повного вивчення органічної хімії” , що був повністю оснований на теорії хімічної будови. В 1868 році його було вибрано професором органічної хімії Петербурзького університету. Умер від емболії (тромбозу) унаслідок випадкової та безглуздої травми – дістаючи книжку з верхньої полиці у своєму кабінеті, впав із переносної драбини і забив коліно. До речі відзначити, що Бутлеров був упевнений в існуванні ізотопів елементів із цілими атомними вагами, із чим не погоджувався Менделєєв. Бутлеров навіть ставив досліди, але нічого не зміг довести, бо потрібної експериментальної техніки на той час не було. Не можна не відзначити ще одне досягнення Бутлерова – створення теорії таутомерії (1862 –1865), тобто оборотного перетворення ізомерів. В цьому разі пріоритет Бутлерова визнавали навіть на Заході.
