
- •Розділ 1. Виникнення хімії та принципи періодизації історії хімії
- •1.1. Виникнення хімії
- •1.2. Географія виникнення хімії
- •1.3. Періодизація історії хімії
- •Розділ 2. Від давнини до р. Бойля
- •Хімічні знання в передалхімічний період
- •2.2. Теоретичні уявлення стародавніх людей про природу
- •2.2.1. Грецькі елементи-стихії
- •2.2.2. Грецька атомістика
- •2.3. Алхімічний підперіод
- •2.3.1. Олександрія
- •Арабський період алхімії
- •2.3.3. Хімія в Індії та Китаї
- •2.3.4. Алхімія в Європі
- •Виникнення та розвиток іатрохімії
- •2.4.1. Обумовленість виникнення
- •2.4.2. Представники іатрохімії
- •2.4.3. Зачатки технічної хімії у XVI та XVII століттях
- •Розділ 3. II період історіЇ хімії. Учення про склад (Період об’єднання хімії)
- •3.1 Умови розвитку природознавства в другій половині XVII століття
- •3.2. Роберт Бойль. Експериментальна хімія та атомістика XVII століття
- •3.3. Теорія флогістону
- •Пневматична хімія
- •Уявлення про хімічну спорідненість у XVII – XVIII столітті
- •3.6. Підперіод анти флогістонної системи. Хімічна революція
- •3.6.1. Французька революція та наука
- •3.6.2. Біографія Лавуазьє
- •2.6.3. Боротьба Лавуазьє з алхімією та теорією флогістону
- •3.6.4. Експериментальні принципи Лавуазьє
- •3.6.5. Лавуазьє та атомістика XVIII століття
- •3.6.6. Ломоносов, як попередник Лавуазьє
- •3.7. Нова школа та хімічна номенклатура
- •Розділ 4. Розвиток методів хімічного аналізу
- •4.1. Виникнення хімічного аналізу
- •Розвиток аналітичної хімії у XVIII столітті
- •4.2.1. Виникнення способу аналізу за допомогою паяльної трубки
- •4.2.2. Виникнення хімічної мінералогії
- •4.2.3. Становлення хімічного аналізу твердих мінеральних тіл вологим шляхом
- •4.2.4. Виникнення аналізу мірою
- •4.3. Розвиток хімічного аналізу в першій половині XIX століття
- •4.3.1. Розробка спеціальних методичних основ хімічного аналізу
- •4.3.2. Становлення систем хімічного аналізу
- •4.3.3. Розвиток методів та системи об’ємного аналізу
- •4.3.4. Відкриття спектрального аналізу
- •5.1.2. Закон еквівалентів Ріхтера (сполучних ваг)
- •5.1.3. Закон простих співвідношень. Виникнення хімічної атомістики. Джон Дальтон
- •5.1.4. Закони сполучення газів між собою, Гей-Люсак
- •5.1.5. Гіпотеза Авогадро
- •5.1.6. Закон ізоморфізму
- •5.1.7. Закон Дюлонга та Пті
- •5.1.8. Гіпотеза Праута
- •5.1.9. Електрохімічні дослідження. Закони електролізу
- •5.2. Атомістичні уявлення Берцеліуса
- •5.3. Атомна реформа Каніцаро
- •Розділ 6. Періодична система елементів (розвиток III періоду іСторії хімії)
- •6.1. Відкриття та класифікація хімічних елементів до середини XIX століття
- •6.1.1 Накопичення знань про елементи
- •6.1.2. Відкриття елементів та розвиток хімії
- •6.1.3. Хибні відкриття
- •6.2. Теорія валентності
- •6.2.1. Зародження теорії валентності (атомності)
- •6.2.2. Багатовалентність
- •6.3. Спроби класифікації та систематизації хімічних елементів до відкриття періодичного закону
- •6.4. Періодична система елементів д.І.Менделєєва
- •6.4.1. Передумови відкриття періодичного закону
- •6.4.2. Біографічні дані Дмитра Івановича Менделєєва та його роботи до 1869 року
- •6.4.3. Перша спроба системи елементів. Зміна форми таблиці
- •6.4.4. Тріумф закону
- •Розділ 7. Історія органічної хімії від виникнення до утвердження структурної теорії
- •7. 1. Періодизація історії органічної хімії
- •7.2. Зародження органічної хімії
- •7.3. Аналітичний (другий) період
- •7.3.2. Відкриття ізомерії
- •7.3.4. Доструктурні теорії
- •7.3.4.1. Теорії радикалів
- •7.3.4.2. Теорії типів
- •7.4. Розвиток уявлень про валентність та хімічний зв’язок
- •7.5. Виникнення та розвиток класичної теорії хімічної будови
- •7.5.1. Передумови її виникнення
- •7. 5. 2. Теорія хімічної будови та її розвиток. Питання пріоритету
- •7.6. Теорії спорідненоємності
- •7.7. Стереохімія
- •7.8. Органічний аналіз у структурний період
- •7.9. Препаративна органічна хімія. Тріумф органічного синтезу
- •7.10. Прикладна органічна хімія
- •8.1.2. Періодизація історії фізичної хімії
- •8.2 Виникнення термодинаміки. Хімічна термодинаміка
- •8.3. Розчини та електролітична дисоціація
- •8.3.1. Рауль і кріоскопія
- •8.3.2. Електролітична дисоціація
- •8.4. Кінетика та каталіз хімічних реакцій
- •8.4.1 Закони газового стану. Кінетична теорія
- •8.4.2 Хімічна кінетика
- •8.4.3 Каталіз
- •8.5. Фізична органічна хімія
- •8.5.1. Вступ
- •8.5.2. Теорія резонансу
- •8.5.3. Теорія перехідних станів
- •Розділ 9. Неорганічна хімія та хімічна технологія від початку третього періоду до наших днів
- •9.1. Вступ
- •9.2. Нова металургія
- •9.3. Порошкова металургія
- •9.4. Хімія неметалів
- •9.5. Елементоорганічна хімія
- •Розділ 10. Розвиток хімічної науки та хімічної промисловості в Україні
- •10.1 Вступ. Донауковий період хімії в Україні
- •10.2. Роль наукових і освітянських центрів у становленні та розвитку хімії в Україні
- •10.2.1. Предтечі університетів.
- •10.2.2. Університети в Україні до 1917 р.
- •10.3. Національна Академія Наук України. Профільні інститути.
- •10.4. Хімічна промисловість на Україні
- •10.4.1. Азотна промисловість на Україні
- •10.4.2. Промисловість фарбників та напівпродуктів на Україні
- •Головні хімічні підприємства України
- •Розділ 2. Від давнини до р. Бойля . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .13
- •Розділ 4. Розвиток методів хімічного аналізу . . . . . . . . . . . . . . . . . . . . . . . 58
4.3.4. Відкриття спектрального аналізу
В
окуляр
щілина
коліматор
призма
(1861 рік). В тому ж 1861 році У.Крукс, англійський хімік та фізик (1832-1919), відкрив спектральним шляхом талій, який сам і виділив у чистому вигляді в 1862 році. В 1863 році німецький металург Ф.Рейх із своїм асистентом Р.Т.Ріхтером відкрили індій. Так розпочав свою переможну ходу спектральний аналіз.
призма
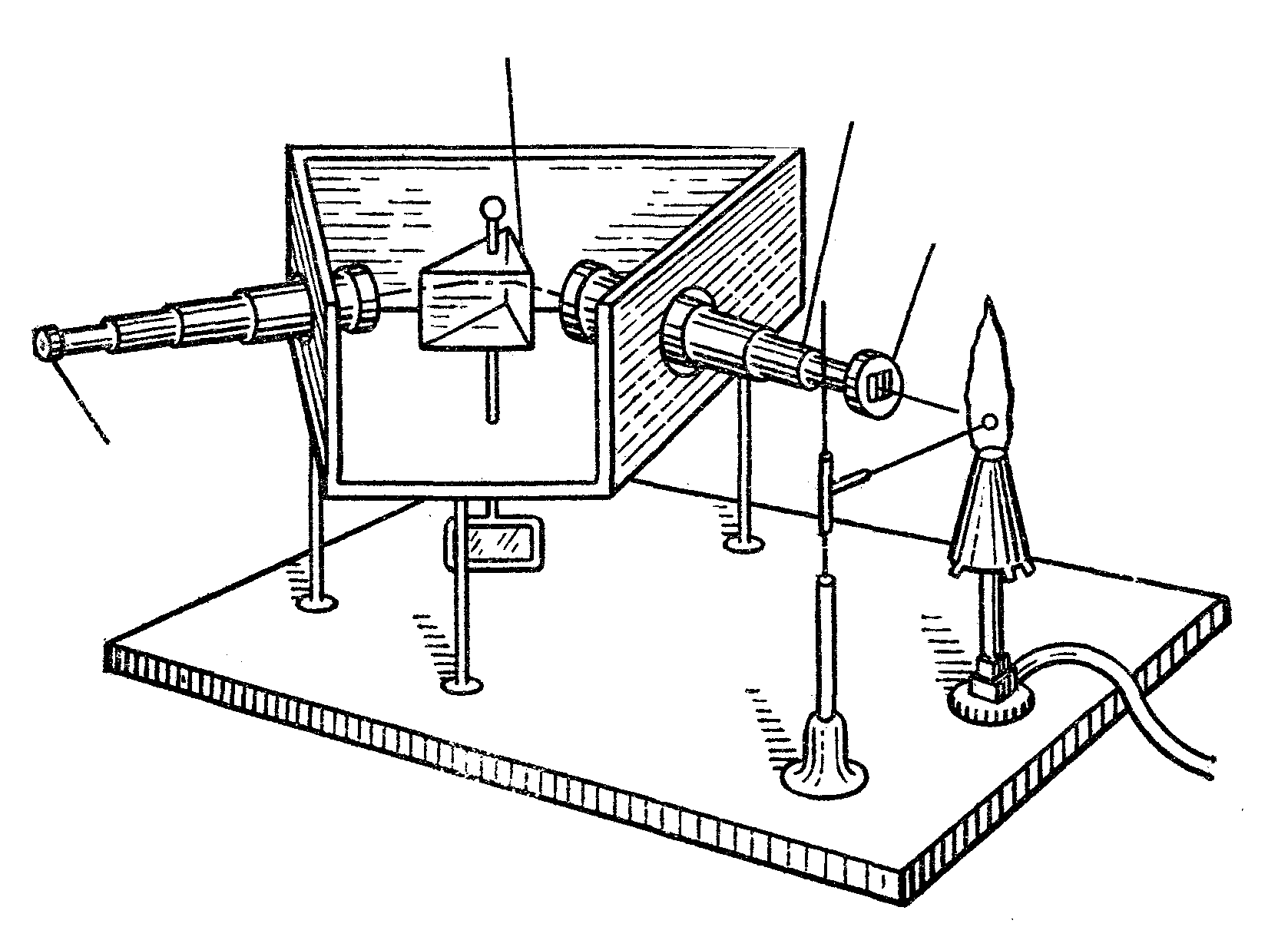
Р
коліматор
ший спектро-
скоп Бунзена та
Кірхгофа
щілина
окуляр
Розділ 5. Структурна хімія. Атомістика
(початок ІІІ – го періоду історії хімії)
5.1. Підперіод кількісних законів
5.1.1. Закон постійності складу (закон постійних співвідношень)
Відкрив цей закон Жозеф Луї Пруст (1754 – 1826). Розпочав займатися хімією в аптеці батька, після закінчення Паризького університету зайняв у 1791 році кафедру хімії у Мадридському університеті, мав прекрасну лабораторію, після захоплення Мадриду французами у 1808 році поїхав у Францію, бо його лабораторія була зруйнована. Поселився в маленькому провінційному містечку, жив бідно. В 1816 році обраний членом Паризької АН. Вів шалену полеміку з Бертоле, який закон Пруста відкидав. Унаслідок дискусії багато хіміків сприйняли точку зору Пруста й визнали його закон. Згідно цього закону всі речовини мають постійний склад незалежно від місця та способу їх одержання.
5.1.2. Закон еквівалентів Ріхтера (сполучних ваг)
Закон каже, що речовини реагують між собою в кількостях, що дорівнюють еквівалентам (сполучним вагам). Сам Ріхтер термін еквівалент не використовував, це поняття ввів Кавендиш. Широко застосував цей термін і склав таблиці еквівалентних ваг англійський хімік Вільям Гайд Воластон (1766 – 1828). Тому історик Фігуровський саме йому приписує авторство закону.
5.1.3. Закон простих співвідношень. Виникнення хімічної атомістики. Джон Дальтон
В кінці XVIII століття вважали атомну будову матерії саму собою зрозумілою. Але це була натурфілософська теорія і її не застосовували для пояснення хімічних явищ. Заслуга у використанні атомної теорії для пояснення закономірностей складу речовин належить англійцю Джону Дальтону (1766 – 1844). Він син ткача й систематичної освіти не отримав, все життя займався викладанням. Виступив проти теорії хімічного розчинення пари води в атмосфері, доказав, що атмосфера – фізична суміш газів, тобто суміш атомів газів. Гази у воді розчинюються пропорційно тиску. Важливі його фізіологічні дослідження сліпоти на окремі кольори, звідти і походить термін дальтонізм.
Аналізуючи склад СО та СО2, а також маслородного газу (С2Н4) та марш-газу (СН4), він дійшов висновку, що вагові кількості кисню у перших двох речовинах та водню у другій парі співвідносяться кратно (тобто на 1 вагу С приходиться у першій речовині кисню 1,3 ваги, у другій – 2,6; на 1 вагу С у третій – 0,16 ваги водню, у четвертій – 0,33):
|
Вагова частка С |
Вагова частка О |
|
Вагова частка С |
Вагова частка Н |
СО |
3 |
3.9≈4 |
СН4 |
6 |
2 |
СО2 |
3 |
7.8≈8 |
етилен |
6 |
1 |
Звідси випливає закон кратних співвідношень: відносні вагові кількості елементів у їх різних сполуках співвідносяться як невеликі цілі числа. Дальтон висуває нову версію атомістичної теорії, згідно з якою сполуки можуть відрізнятися на цілі атоми, і саме ця обставина може пояснити і закон постійності складу, і закон кратних співвідношень. При цьому Дальтон, віддаючи данину поваги Демокриту, зберіг термін атом та ввів поняття простого та складного атома (тепер молекули). Свою теорію він детально виклав у праці “Нова система хімічної філософії”, що вийшла в 1808 році.
В тому ж році Воластон опублікував свою роботу з дослідження кислих та нейтральних карбонатів і показав, що в кислому карбонаті калію їх співвідношення як 1:1, а в нейтральному як 1:2. Тим самим він підтвердив справедливість кратних співвідношень. Крім того, Воластон усіляко сприяв утвердженню атомістичної теорії як пропагандист.
Дальтон уперше склав таблицю атомних ваг, прийнявши вагу атому водню за 1:
-
Водень
1
Кисень
5.66
Азот
4
Вода
6.66
Аміак
5
Селітряний газ
9.66
Селітровий оксид
13.66
Селітрова кислота
15.32
Сірка
17
Сірчаста кислота
22.66
Сірчана кислота
28.32
Вугільна кислота
15.8
Оксид вуглецю
10.2
Вуглець
4.5
Ці ваги досить близькі до еквівалентів, але це не атомні ваги в нинішньому розумінні. Використовуючи досвід Лавуазьє, Дальтон запропонував символіку позначення атомів елементів, використовуючи у деяких випадках перші літери назв у середині кіл, а також складних атомів сполук. При побудові складних атомів він використовував принцип максимальної простоти: якщо два елементи утворюють одну сполуку, тоді складний атом останньої може бути тільки подвійним, якщо дві – тоді складний атом однієї – подвійний, а інший – потрійний; якщо ж три сполуки – одна подвійна і дві потрійні, якщо чотири – одна подвійна, дві потрійні, і одна четверна, тобто:
1А + 1В = 1 подвійний атом С
1А + 2В = 1 потрійний атом Д
2А + 1В = 1 потрійний атом Е
1А + 3В = 1 четверний атом F тощо.
Саме цьому Дальтон складні атоми води та амоніаку вважав подвійними (неправильно), але правильно дав будову вуглекислого газу та СО, а також оксидів азоту та сірки (рис. 5.1), але неправильно метану (СН2) та етилену (СН) (він знав тільки ці вуглеводні). І вже виходячи з цих формул, базуючись на елементному аналізі, він визначав атомні ваги, тобто пройшов шлях, зворотній тому, який від часів Берцеліуса став загально прийнятим: виходячи з даних елементного аналізу, користуючись відомими атомними вагами – до емпіричної формули.



![]()

![]()
![]()

![]()
![]()
![]()
![]()
![]()
H N C O P S Mg Ca Na K Ba Fe Zn
![]()
![]()
![]()
![]()
![]()





Cu Pb Ag Pt Au H2O NH3 NO C2H4 CO




N2O NO2 CO2 CH4





SO3 спирт CH3COOH NH3NO3 атом цукру
(2C + 2H2O) (СО2 + спирт)
Рис. 5.1. Символіка Дальтона
Багато сучасників відносились до Дальтона, як до самоучки, скептично, дивились спогорда і спробували зменшити його заслуги та приписати їх іншим.
Але він дав і дійсні зачіпки для скептичного відношення до нього, особливо це стосується правил складання формул сполук. Та й пропагував свої ідеї він неактивно. Воластон та шведський хімік Томас Томсон (1773 – 1852) у цьому напрямку зробили набагато більше, ніж він сам. До того ж він був надміру самовпевненим і вважав свої ідеї непогрішимими.
