
- •Розділ 1. Виникнення хімії та принципи періодизації історії хімії
- •1.1. Виникнення хімії
- •1.2. Географія виникнення хімії
- •1.3. Періодизація історії хімії
- •Розділ 2. Від давнини до р. Бойля
- •Хімічні знання в передалхімічний період
- •2.2. Теоретичні уявлення стародавніх людей про природу
- •2.2.1. Грецькі елементи-стихії
- •2.2.2. Грецька атомістика
- •2.3. Алхімічний підперіод
- •2.3.1. Олександрія
- •Арабський період алхімії
- •2.3.3. Хімія в Індії та Китаї
- •2.3.4. Алхімія в Європі
- •Виникнення та розвиток іатрохімії
- •2.4.1. Обумовленість виникнення
- •2.4.2. Представники іатрохімії
- •2.4.3. Зачатки технічної хімії у XVI та XVII століттях
- •Розділ 3. II період історіЇ хімії. Учення про склад (Період об’єднання хімії)
- •3.1 Умови розвитку природознавства в другій половині XVII століття
- •3.2. Роберт Бойль. Експериментальна хімія та атомістика XVII століття
- •3.3. Теорія флогістону
- •Пневматична хімія
- •Уявлення про хімічну спорідненість у XVII – XVIII столітті
- •3.6. Підперіод анти флогістонної системи. Хімічна революція
- •3.6.1. Французька революція та наука
- •3.6.2. Біографія Лавуазьє
- •2.6.3. Боротьба Лавуазьє з алхімією та теорією флогістону
- •3.6.4. Експериментальні принципи Лавуазьє
- •3.6.5. Лавуазьє та атомістика XVIII століття
- •3.6.6. Ломоносов, як попередник Лавуазьє
- •3.7. Нова школа та хімічна номенклатура
- •Розділ 4. Розвиток методів хімічного аналізу
- •4.1. Виникнення хімічного аналізу
- •Розвиток аналітичної хімії у XVIII столітті
- •4.2.1. Виникнення способу аналізу за допомогою паяльної трубки
- •4.2.2. Виникнення хімічної мінералогії
- •4.2.3. Становлення хімічного аналізу твердих мінеральних тіл вологим шляхом
- •4.2.4. Виникнення аналізу мірою
- •4.3. Розвиток хімічного аналізу в першій половині XIX століття
- •4.3.1. Розробка спеціальних методичних основ хімічного аналізу
- •4.3.2. Становлення систем хімічного аналізу
- •4.3.3. Розвиток методів та системи об’ємного аналізу
- •4.3.4. Відкриття спектрального аналізу
- •5.1.2. Закон еквівалентів Ріхтера (сполучних ваг)
- •5.1.3. Закон простих співвідношень. Виникнення хімічної атомістики. Джон Дальтон
- •5.1.4. Закони сполучення газів між собою, Гей-Люсак
- •5.1.5. Гіпотеза Авогадро
- •5.1.6. Закон ізоморфізму
- •5.1.7. Закон Дюлонга та Пті
- •5.1.8. Гіпотеза Праута
- •5.1.9. Електрохімічні дослідження. Закони електролізу
- •5.2. Атомістичні уявлення Берцеліуса
- •5.3. Атомна реформа Каніцаро
- •Розділ 6. Періодична система елементів (розвиток III періоду іСторії хімії)
- •6.1. Відкриття та класифікація хімічних елементів до середини XIX століття
- •6.1.1 Накопичення знань про елементи
- •6.1.2. Відкриття елементів та розвиток хімії
- •6.1.3. Хибні відкриття
- •6.2. Теорія валентності
- •6.2.1. Зародження теорії валентності (атомності)
- •6.2.2. Багатовалентність
- •6.3. Спроби класифікації та систематизації хімічних елементів до відкриття періодичного закону
- •6.4. Періодична система елементів д.І.Менделєєва
- •6.4.1. Передумови відкриття періодичного закону
- •6.4.2. Біографічні дані Дмитра Івановича Менделєєва та його роботи до 1869 року
- •6.4.3. Перша спроба системи елементів. Зміна форми таблиці
- •6.4.4. Тріумф закону
- •Розділ 7. Історія органічної хімії від виникнення до утвердження структурної теорії
- •7. 1. Періодизація історії органічної хімії
- •7.2. Зародження органічної хімії
- •7.3. Аналітичний (другий) період
- •7.3.2. Відкриття ізомерії
- •7.3.4. Доструктурні теорії
- •7.3.4.1. Теорії радикалів
- •7.3.4.2. Теорії типів
- •7.4. Розвиток уявлень про валентність та хімічний зв’язок
- •7.5. Виникнення та розвиток класичної теорії хімічної будови
- •7.5.1. Передумови її виникнення
- •7. 5. 2. Теорія хімічної будови та її розвиток. Питання пріоритету
- •7.6. Теорії спорідненоємності
- •7.7. Стереохімія
- •7.8. Органічний аналіз у структурний період
- •7.9. Препаративна органічна хімія. Тріумф органічного синтезу
- •7.10. Прикладна органічна хімія
- •8.1.2. Періодизація історії фізичної хімії
- •8.2 Виникнення термодинаміки. Хімічна термодинаміка
- •8.3. Розчини та електролітична дисоціація
- •8.3.1. Рауль і кріоскопія
- •8.3.2. Електролітична дисоціація
- •8.4. Кінетика та каталіз хімічних реакцій
- •8.4.1 Закони газового стану. Кінетична теорія
- •8.4.2 Хімічна кінетика
- •8.4.3 Каталіз
- •8.5. Фізична органічна хімія
- •8.5.1. Вступ
- •8.5.2. Теорія резонансу
- •8.5.3. Теорія перехідних станів
- •Розділ 9. Неорганічна хімія та хімічна технологія від початку третього періоду до наших днів
- •9.1. Вступ
- •9.2. Нова металургія
- •9.3. Порошкова металургія
- •9.4. Хімія неметалів
- •9.5. Елементоорганічна хімія
- •Розділ 10. Розвиток хімічної науки та хімічної промисловості в Україні
- •10.1 Вступ. Донауковий період хімії в Україні
- •10.2. Роль наукових і освітянських центрів у становленні та розвитку хімії в Україні
- •10.2.1. Предтечі університетів.
- •10.2.2. Університети в Україні до 1917 р.
- •10.3. Національна Академія Наук України. Профільні інститути.
- •10.4. Хімічна промисловість на Україні
- •10.4.1. Азотна промисловість на Україні
- •10.4.2. Промисловість фарбників та напівпродуктів на Україні
- •Головні хімічні підприємства України
- •Розділ 2. Від давнини до р. Бойля . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .13
- •Розділ 4. Розвиток методів хімічного аналізу . . . . . . . . . . . . . . . . . . . . . . . 58
Пневматична хімія
Один із найважливіших напрямків досліджень створили хіміки, які працювали з газами. Тому не треба дивуватись, що хімічне вивчення газів дозволило відкрити фізичні закони залежності об’єму газів від тиску та температури: вплив тиску на об’єм був установлений Бойлем (1660, рис. 3.1) та Маріоттом (1677) , пізніше Вольта (1792) та Гей-Люссак (1802) встановили вплив температури. Ці закони разом із законом Гей-Люссака про співвідношення об’ємів у процесі сполучення газів складають основи пневматології, тобто науки про речовини в газоподібному стані (грецькою мовою πνευμα – газ, дух). Нині пневматологію не розглядають як окрему науку тому, що вона ввійшла у дві дуже важливі науки – фізику та хімію, але інше становище було в XVII – XVIII століттях. Засновником пневматичної хімії вважають Ван-Гельмонта (див. розділ про іатрохімію).
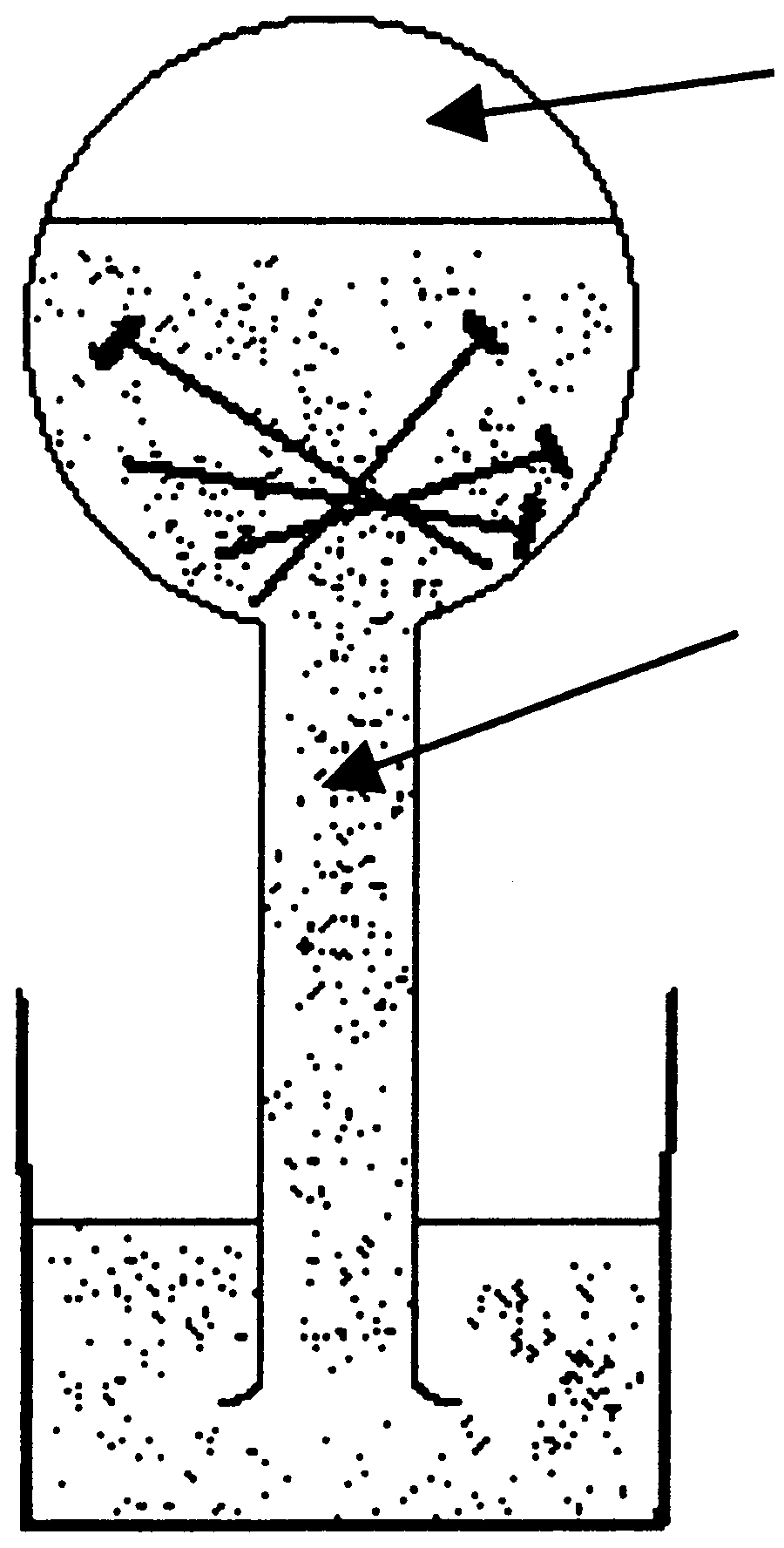
Видатним представником пневматичної хімії треба вважати Роберта Бойля, тому що він перший винайшов прилад (U – подібну трубку ), в якій можна було ізолювати та вивчати газоподібні речовини (див. рис. 3.1). Бойль в 1660 році описав спосіб збирання газів у вузькогорлій колбі, в яку налили розведеної сірчаної кислоти та накидали залізних гвіздків. Колбу перекинули вверх дном та поставили в чашку з тією ж рідиною (рис.3.2). Водень, що виділявся, витісняв кислоту з колби. Замінивши сірчану кислоту азотною, Бойль отримав інший газ (NO).
В 1665 році англійський фізик Роберт Гук (1636 – 1703) дійшов висновку (у своїй книзі “Мікрографія”) , що у повітрі міститься особлива речовина, подібна речовині, що міститься у селітрі у зв’язаному стані. Вона розчиняє горючі тіла за високою температурою, внаслідок чого
 виникає вогонь
– швидкий рух часток. Горіння
виникає вогонь
– швидкий рух часток. Горіння
в замкненому просторі припиняється, як тільки
горюче тіло буде насичене цим розчинником.
H2
1679) у книзі “Про селітру та повітряний спирт
селітри” розчинник Гука називає повітряним
спиртом селітри. Він подав думку, що ця
H2SO4 розб.
переворот у науці (що і сталося в роботах
Лавуазьє) , який вона зробила у військовій справі
у складі селітри. За його думкою селітра
складається з двох частин: кислого селітряного
спирту та лужної речовини. В повітрі міститься
лише складова частина селітряного спирту –
Рис. 3.2. Прилад повітряний спирт селітри. Ця речовина і
Бойля для одер- підтримує горіння і необхідна для дихання.
жання Н2 Останнє Мейов доказав своїми вперше
поставленими дослідами горіння та дихання під ковпаком над водою. Якщо під ковпаком горить свічка й одночасно знаходиться жива миша, тоді горіння швидко припиняється, а миша гине. Мейов робить висновок, що селітряний спирт повітря є головним джерелом життя та дихання.
П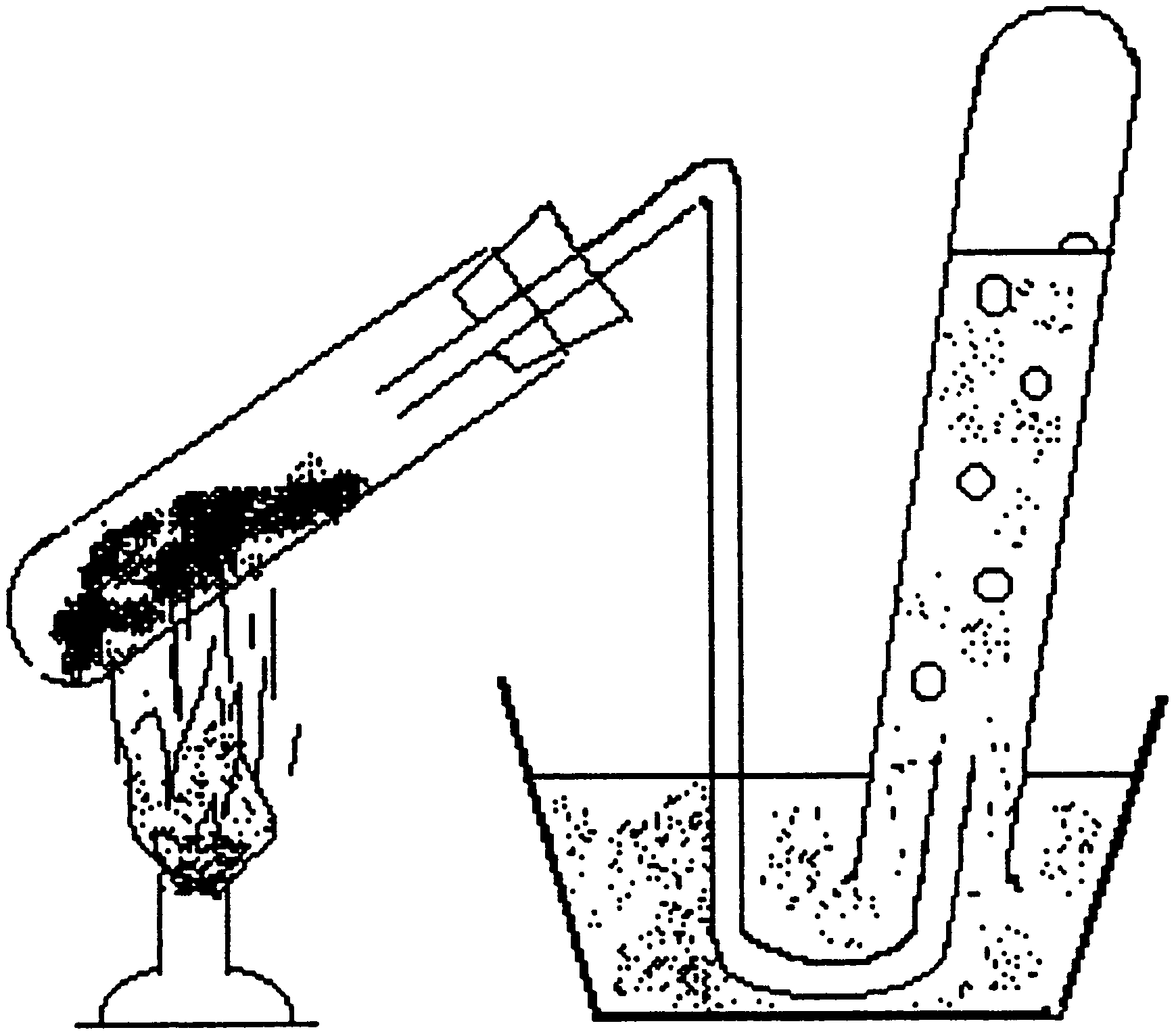 огляди
Мейова ніякого впливу на пояснення
горіння в подальшому не мали з двох
причин: від недостатньої кількості
експериментальних даних та від недовіри
до нових пояснень, які відрізнялись від
пояснень флогістиків, що протрималися
ще 100 років після Мейова. Поширення
поглядів Мейова гальмувалось ще однією
причиною – в його роботах ці погляди
часто чергувались із зовсім протилежними
міркуваннями.
огляди
Мейова ніякого впливу на пояснення
горіння в подальшому не мали з двох
причин: від недостатньої кількості
експериментальних даних та від недовіри
до нових пояснень, які відрізнялись від
пояснень флогістиків, що протрималися
ще 100 років після Мейова. Поширення
поглядів Мейова гальмувалось ще однією
причиною – в його роботах ці погляди
часто чергувались із зовсім протилежними
міркуваннями.
Отримання окремих газів та вивчення їх властивостей стало можливим після винаходу пневматичної ванни, тобто переверненої посудини з водою, в якій можна збирати бульбочки газу (див. рис. 3.3). Таку ванну запропонував Стівен Гейлс (1677 – 1761) , священик та природодослідник (Англія). Він застосував цей прилад для збирання газів при сухій перегонці дерева. Це відбулось в 1723 році. А в 1727 у книзі “Рослинна
Рис. 3.3. Ванна Гейлса статика” він зупиняється на необхідності
кількісного аналізу в дослідженнях, вважаючи, що “ найбільш імовірним шляхом проникнення в природу тіл повинні бути число, вага, міра”. Гейлса можна вважати родоначальником виміру об’ємів газів.
Обов’язково треба згадати Джозефа Блека (1728 – 1799), якого вважав своїм учителем Лавуазье. Блек – шотландець, викладав в університетах Глазго та Единбурга. Блек детально вивчав лісний газ (СО2) і назвав його сполучуваним повітрям, оскільки він поглинався концентрованими лугами та вапном. Він прожарював вапняк, магнезію і виявив, що до них не тільки нічого не приєднується (вогонь), але навпаки, відбувається виділення великої кількості сполучуваного повітря. Однак, ці досліди Блека відкидало багато вчених, бо вони суперечили теорії флогістону. Блек виявив, що свічка у вуглекислому газі не горить. Свічка, що горить у закритій посудині зі звичайним повітрям, гасне, а повітря, що залишилось, вже не підтримує горіння. Але коли Блек абсорбував вуглекисле повітря лугом, повітря, що залишалось, горіння не підтримувало, хоч у ньому вже не було вуглекислого газу.
Блек запропонував вивчити цю проблему своєму учню – шотландцю Даніелю Резерфорду (1749 – 1819), Резерфорд провів дослід : він тримав мишу в обмеженому об’ємі повітря, поки вона не здохла, потім там же тримав свічку, поки вона не погасла. В повітрі ,що після цього залишилось, він помістив запалений фосфор, який там горів дуже недовго. Повітря, що залишилось, він пропустив через луг, щоб поглинути вуглекислий газ. В повітрі, що після цього залишилось, свічка гасла, а миша гинула.
Резерфорд у 1772 році пояснив цей дослід із точки зору флогістону. Поки миша дихала, а свічка горіла, флогістон виділявся та надходив у повітря разом із вуглекислим газом. Повітря, із якого виділили вуглекислий газ, містив так багато флогістону, що був повністю просякнутий ним. Тому Резерфорд назвав газ, якій він виділив, флогістованим повітрям (нині азот). Але Резерфорд, як і Прістлі з Кавендишем, не зрозумів, що це інша речовина. Він вважав, що це те ж повітря, але насичене флогістоном.
Наступний представник пневматичної хімії – Генрі Кавендиш (1731 – 1810), англієць. Був флогістиком, свої результати пояснював із позицій теорії флогістону, навіть не дивлячись на те, що багато його дослідів цій теорії суперечили. Першу свою роботу Кавендиш присвятив різним видам “штучного повітря”. Під штучним він розумів будь – яке повітря, яке містилось в речовинах у зв’язаному стані і могло бути з них виділеним. Так він отримав водень дією кислот на метали і пояснив утворення водню за рахунок розкладання металів, тобто прийняв водень за флогістон. До того ж висновку прийшов і Ломоносов за 20 років до Кавендиша. Але дуже скоро Кавендиш виявив, що горючий газ має вагу зовсім не від’ємну. Зваживши колбу з кислотою та металом до реакції та після реакції, а також об’єм газу, що виділився , він визначив його густину, що дорівнювала 0.09. Тому йому довелось відмовитись від висновку, що флогістон – це чистий водень. Але флогістики були в захваті від цього відкриття.
К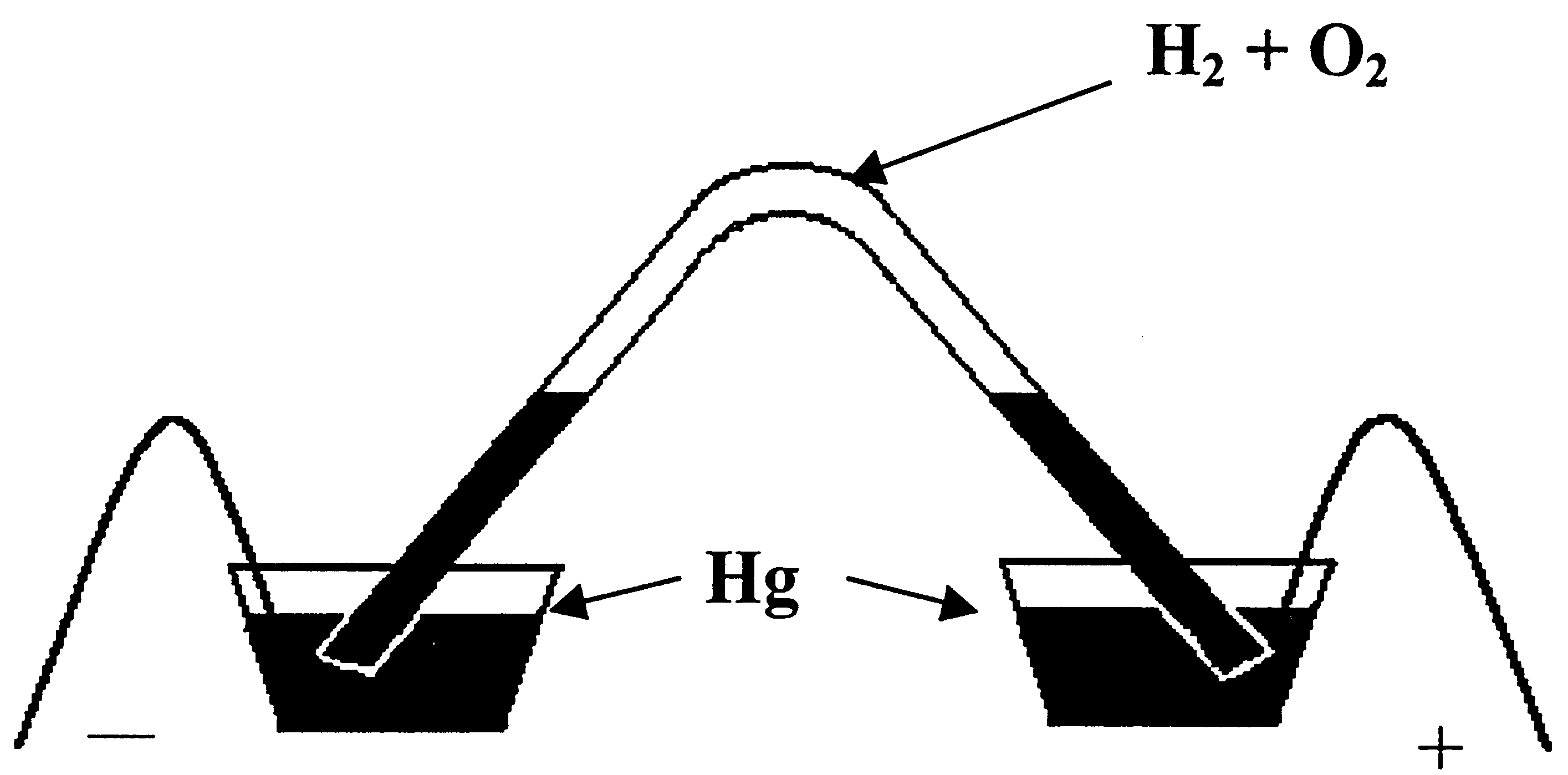 авендиш
– учасник відкриття азоту, який він
отримав у 1772 році, але описав значно
пізніше. Тому формально відкривачем
азоту вважають Резерфорда, тоді як
Кавендиш детально описав властивості
азоту та вогняного повітря (кисню), яке
було відкрите Шеєле. В довгій зігнутій
Г – подібній трубці над ртуттю (див.
рис. 3.4) змішав горюче повітря (Н2)
з дефлогістованим (О2)
і підпалив електричною іскрою. Після
вибуху
утворювалась рідина, подібна воді.
Аналогічним шляхом він пробував зв’язати
флогістоване повітря (N2)
, для чого збагачене
киснем повітря піддавав дії електричних
розрядів. Оксиди азоту, що утворювались,
він поглинав лугом. Кавендиш таким чином
зв’язав весь азот, але в
авендиш
– учасник відкриття азоту, який він
отримав у 1772 році, але описав значно
пізніше. Тому формально відкривачем
азоту вважають Резерфорда, тоді як
Кавендиш детально описав властивості
азоту та вогняного повітря (кисню), яке
було відкрите Шеєле. В довгій зігнутій
Г – подібній трубці над ртуттю (див.
рис. 3.4) змішав горюче повітря (Н2)
з дефлогістованим (О2)
і підпалив електричною іскрою. Після
вибуху
утворювалась рідина, подібна воді.
Аналогічним шляхом він пробував зв’язати
флогістоване повітря (N2)
, для чого збагачене
киснем повітря піддавав дії електричних
розрядів. Оксиди азоту, що утворювались,
він поглинав лугом. Кавендиш таким чином
зв’язав весь азот, але в
Рис. 3.4. Схема приладу Кавендиша трубці залишався маленький
пухирець повітря, що не піддавався дії електричного розряду. І тільки згодом у кінці XIX cтоліття було встановлено, що то був аргон. Усе це Кавендиш описав у роботі “Про новий евдіометр” в 1783 році. Ці ж реакції відбуваються і в евдіометрі Кавендиша – приладі для дослідження складу повітря (див. рис. 3.5).
 Дія
евдіометра Кавендиша базується на
зв’язуванні кисню оксидом азоту за
реакцією 2NO
+ O2
= 2NO2
*.
Діоксид азоту поглинався лугом. За
допомогою цього приладу Кавендиш
відхилив думку про різний склад повітря,
відібраного у різних місцях (у лісі, на
горі, тощо).
Дія
евдіометра Кавендиша базується на
зв’язуванні кисню оксидом азоту за
реакцією 2NO
+ O2
= 2NO2
*.
Діоксид азоту поглинався лугом. За
допомогою цього приладу Кавендиш
відхилив думку про різний склад повітря,
відібраного у різних місцях (у лісі, на
горі, тощо).
Сучасник Кавендиша Джозеф Прістлі (1733 – 1804) – теолог, філософ, хімік, одна з найбільш яскравих фігур серед учених XVIII століття. Життя його було дуже не спокійним, бо він був гарячим прихильником французької революції та мав незалежну позицію відносно англіканської церкви. В 1791
Рис. 3.5. Схема евдіометра році в день 2-ї річниці взяття Бастилії 14 липня Кавендиша його будинок та лабораторія в Бірмінгемі були
розгромлені й спалені фанатиками, а сам він із
сім’єю ледве врятувався й емігрував в США в 1794 році.

* Лавуазьє ще в 1774 році знав цю реакцію, яку використовував для ідентифікації кисню, а в 1777 році вже виступив проти теорії флогістону.
Прістлі вдосконалив пневматичну ванну Гейлса, замінивши воду ртуттю, завдяки чому він зміг збирати гази, які розчиняються у воді, хлористий водень, амоніак та інші. Проводив аналіз повітря в евдіометрі, як і Кавендиш, за допомогою оксиду азоту. В цих дослідах об’єм повітря,зменшувався на 1/5 і воно ставало непридатним для горіння та дихання. Таке ж зменшення об’єму повітря Прістлі спостерігав, якщо в ньому спалювати горючі речовини чи проводити кальцинацію металів.. В деяких випадках утворювалося сполучуване повітря Блека (СО2), яке вилучалось шляхом його розчинення у вапняній воді. Він виявив, що повітря після згорання в ньому органічних речовин непридатне для дихання, але воно знов набуває властивостей звичайного повітря, якщо в ньому розмістити на деякий час живу рослину. Прістлі, діючи селітряним газом (NO) на вологі залізні ошурки, отримав газ, в якому і свічка продовжувала горіння і який не червонів при контакті з повітрям (1771) :
6NO + 2Fe + 3Н2О = 2Fe(OH)3 + 3N2O .
Найбільш важливе відкриття було зроблене Прістлі 1 серпня 1774 року. Нагріваючи червоний оксид ртуті в пробірці за допомогою запалювальної лінзи ( від сонця) він отримав газ, в якому свічка горіла яскравіше, ніж на повітрі , а тліюча скалка яскраво спалахувала. Змішуючи новий газ, який він назвав дефлогістованим повітрям, з оксидом азоту (NO), він отримав жовтогарячий газ, виявивши при цьому, що об’єм суміші зменшився. Прістлі вважав, що цей газ (O2) – суміш азотної кислоти та землі, а флогістоване повітря (азот) – суміш азотної кислоти, землі та флогістону.
Однак за 2 роки до цього кисень був відкритий шведом Шеєле, але опублікував він про це пізніше (1777 р.). Назвав він цей газ вогняним повітрям. Лавуазьє відкрив цей газ в 1775 році і назвав киснем (що народжує кислоти). Ці три гіганти сперечалися між собою за пріоритет відкриття. Суперечка триває до цих пір (уже між країнами).
Для історії хімії важливе інше. Хто використав це відкриття на благо самої науки? Тут усе ясно і суперечки нема! Лавуазьє, і тільки він!
Останнім гігантом, який зробив свій внесок у розвиток пневматичного напрямку, був шведський аптекар Карл Вільгельм Шеєле (1742 – 1786) . Він залишався аптекарем до кінця своїх днів, незважаючи на спокусливі пропозиції з Берліна, Упсали чи Фалуна (центри науки та промисловості Швеції). Хімічна інтуїція його була вражаючою, так історик Дюма справедливо сказав, що Шеєле не міг доторкнутися до якогось тіла, щоб не зробити відкриття. Його відкриття охоплюють всі галузі хімії: агрохімію, неорганічну, органічну, фізіологічну, аналітичну та технічну хімії. Найбільш важливі відкриття Шеєле кисень та хлор. За свої наукові заслуги він отримав багато нагород. Так в 32 роки він був відзначений званням члена Шведської АН, хоча був лише аптекарським помічником. В 1770 році він отримав вогняне повітря:
2HgO = 2Hg + O2
2MeCO3 = 2Me + 2CO2 + O2 ( Me = Ag та Hg )
2Mg( NO2)2 = 2MgO + 4NO2 + O2.
Суміш піролюзиту із сірчаною чи миш’яковою кислотою теж давала кисень:
2MnO2 + 2H2SO4 = 2MnSO4 + H2O + O2.
В 1771 році він відкрив азот. Досліджував повітря та процеси горіння та дихання. До кінця своїх днів залишився флогістиком.
Обробляючи соки рослин вапном, а тоді витісняючи з утворених солей сірчаною кислотою, Шеєле отримав лимонну, яблучну, галову, молочну кислоти. Відкрив також бензойну, сечову, щавлеву кислоти та гліцерин.
Шеєле сприяв розвитку теоретичної хімії, помітивши різні ступені окислення деяких металів: заліза, міді, ртуті. Окрім хлору (за реакцією MnO2 + 4HCl = MnCl2 + 2H2O + Cl2 ) він отримав та вивчив три дуже отруйні гази (HF, Н2S, HCN). Думають, що його рання смерть – результат повільного отруєння хімікатами, бо він мав звичку пробувати на смак ті речовини, із якими він працював.
З наведеного огляду діяльності пневматиків стає очевидним, яким швидким був процес накопичення фактичного матеріалу в кінці XVIII століття в умовах панування теорії флогістону. Нові дані, отримані в цей період, скоро привели до падіння теорії флогістону та до настання епохи хімічної революції.
