
- •Навчально-методичний посібник
- •Ужгород–2011
- •Вступ. Предмет колоїдної хімії
- •Тема 1. Поверхневі явища. Адсорбція
- •1.1.Визначення поверхневого натягу і адсорбції поверхнево-активних речовин на межі рідина–повітря
- •Хід роботи
- •1.2.Дослідження поверхневої активності речовин гомологічного ряду
- •Хід роботи
- •1.3.Визначення питомої поверхні вугілля методом вимірювання ізотерм адсорбції поверхнево-активної речовини
- •1.4.Адсорбція оцтової кислоти вугіллям
- •1.5.Вплив адсорбційних шарів на змочування твердих поверхонь
- •Хід роботи
- •1.6. Визначення критичної концентрації міцелоутворення в розчинах пар
- •А) Визначення ккм по поверхневому натягу
- •Хід роботи
- •Б) Кондуктометричне визначення ккм
- •Хід роботи
- •Тема 2. Утворення дисперсних систем
- •2.1.Одержання золей методом заміни розчинника
- •2.1.1.Одержання золю каніфолі
- •2.1.2.Одержання золю сірки
- •2.1.3.Одержання етерозолю хлориду натрію
- •2.2.Одержання золей при проходженні хімічної реакції
- •2.2.1.Одержання золей галогенідів срібла
- •Хід роботи
- •2.2.2.Одержання золю гідрату оксиду заліза (по методу Крекке)
- •2.2.3.Одержання золю гідрату оксиду заліза (по методу Грема)
- •2.3.Одержання золей методом пептизації
- •2.3.1.Одержання золю гідроксиду алюмінію
- •2.3.2.Одержання золю оксиду ванадію (V)
- •2.3.3.Одержання золю сірчистого кадмію
- •2.3.4.Одержання золю берлінської лазурі
- •2.3.5.Одержання золю гідроксиду хрому (III)
- •2.3.6.Одержання золю фосфату алюмінію
- •2.3.7.Одержання золю фосфату заліза
- •2.5.2.Одержання гелю хлориду свинцю
- •2.6.Діаліз розчину желатину
- •Тема 3. Електроповерхневі властивості дисперсних систем з.1.Визначення величини електрокінетичного потенціалу методом електрофорезу
- •3.2.Визначення знаку заряду колоїдної частинки (капілярний аналіз)
- •3.3.Аналіз суміші барвників
- •3.4.Визначення ізоелектричної точки білків
- •3.5.Вплив домішок солей на положення ізоелектричної точки казеїну
- •Тема 4. Стійкість і коагуляція дисперсних систем
- •4.1.Коагуляція колоїдних розчинів електролітами
- •4.2.Визначення порогу коагуляції золів гідроксиду заліза і йодиду срібла
- •Хід роботи
- •4.3.Визначення коагуляції золю каніфолі хлоридом алюмінію (перезарядження золю і неправильні ряди)
- •4.4.Порівняння висолюючої дії електролітів на розчин желатини
- •4.5.Захисна дія желатини
- •Хід роботи
- •Тема 5. Молекулярно-кінетичні та оптичні властивості дисперсних систем
- •5.1.Визначення концентрації золю каніфолі
- •Візуальний нефелометр
- •Хід роботи
- •5.2.Вивчення кінетики утворення золю сірки
- •Хід роботи
- •5.3.Визначення середнього розміру частинок золю нефелометричним методом
- •Хід роботи
- •5.4.Седиментаційний аналіз
- •Хід роботи Методика аналізу на седиментометрі Фігуровського
- •Методика аналізу на торзійних терезах
- •Тема 6. Структуроутворення дисперсних систем
- •6.1.Визначення молекулярної маси полімерів віскозиметричним способом
- •Хід роботи
- •6.2.Вплив нагрівання на в’язкість суспензії крохмалю
- •6.3.Визначення часу тиксотропного застуднівання гелей гідрату оксиду заліза
- •6.4.Набухання гелів
- •Хід роботи
- •6.5.Дослідження швидкості набухання желатини
- •6.6.Утворення кристалів йодиду свинцю в студні кремніевої кислоти
- •Тема 7. Грубодисперсні системи, їх властивості та застосування
- •7.1.Методи визначення фаз в емульсії
- •А) Метод змішування
- •Б) Метод електропровідності
- •В) Метод забарвлення
- •7.2.Приготування емульсії бензолу у воді
- •7.3.Одержання і дослідження емульсій типу м/в та в/м
- •7.4.Одержання розведених емульсій різних масел у воді методом заміни розчинника
- •7.5.Одержання прозорої емульсії гліцерину в оцтовоаміловому ефірі
- •7.6.Тиксотропні властивості емульсій
- •7.7.Дослідження стійкості піни
- •7.8.Визначення “часу життя” крапель на поверхні розділу масло-вода
- •Перелік питань для підготовки до колоквіумів вступ. Предмет колоїдної хімії
- •Тема 1. Поверхневі явища
- •Тема 1. Адсорбція
- •Тема 2. Утворення дисперсних систем. Методи їх очищення
- •Тема 3. Електроповерхневі властивості дисперсних систем
- •Тема 4. Стійкість і коагуляція дисперсних систем
- •Тема 5. Оптичні та молекулярно-кінетичні властивості дисперсних систем
- •Тема 6. Структуроутворення в дисперсних системах
- •Тема 7. Грубодисперсні системи, їх властивості та застосування
- •Рекомендована література
1.6. Визначення критичної концентрації міцелоутворення в розчинах пар
Величина критичної концентрації міцелоутворення (ККМ) – важлива колоїдно-хімічна характеристика поверхнево-активних речовин (ПАР). Вона зв’язана з олеофільно-гідрофільним балансом молекул ПАР, характеризує їх схильність до утворення міцелярних структур і служить мірою олеофільності цих структур.
Визначення ККМ в розчинах ПАР грунтується на вимірюванні об’ємних або поверхневих властивостей розчинів при вимірюванні концентрацій.
Частинки колоїдної фази – міцели за здатністю адсорбуватись, проводити електричний струм, розсіювати світло і т.д., відрізняються від окремих іонів або молекул ПАР. Тому перехід окремих молекул чи іонів ПАР в агрегований стан з підвищеною концентрацією розчинів різко змінює хід кривої концентраційної залежності поверхневого натягу, електропровідності, світлорозсіювання, густини, коефіцієнта рефракції, в’язкості тощо. Точка перетину двох ліній, з яких одна виражає концентраційну залежність властивостей молекулярно-дисперсного розчину ПАР, а друга – таку ж залежність для розчину з утворенням міцел, приймається за ККМ.
Концентрацію міцелоутворення можна також визначити як момент виникнення у розчину таких властивостей, які зумовлені появою міцел. Так міцелоутворення надає розчинам здатність до солюбілізації, тобто колоїдного розчинення олеофільних речовин, що легко виявити по забарвленню вище ККМ, яке виникає при насиченні розчинів водонерозчинним барвником.
ККМ, визначені для однієї і тієї ж речовини, не завжди співпадають. Це завжди виникає з виникненням різних умов визначення, зумовлених специфікою методу: накладанням зовнішнього електричного поля в методі електропровідності, впливом іонів барвника-індикатора і т.д. Особливо відрізняються (в бік завищення) величини ККМ, визначені дифракцією рентгенівського опромінення, в зв’язку з тим, що цей метод фіксує виникнення пластинчатих міцел, не реагуючи на присутність в розчині міцел сферичного типу.
А) Визначення ккм по поверхневому натягу
Асиметрія молекулярної будови молекули ПАР особливо чітко виявляється в їх специфічній властивості – поверхневій активності на межі розділу фаз, тобто здатності знижувати міжфазову вільну поверхневу енергію в результаті адсорбції згідно термодинамічного рівняння Гіббса:
![]() .
.
На відміну від окремих молекул чи іонів ПАР, які мають граничну асиметричну молекулярну структуру, міцели сферичного типу, які виникають при ККМ, володіють більш симетричною будовою. Завдяки орієнтації міцелоутворюючих частинок групами назовні, такі міцели рівномірно гідратовані з усіх сторін і майже не володіють поверхневою активністю. Тому поверхневий натяг водних розчинів ПАР різко зменшується із зростанням концентрації до величини ККМ, після чого майже не змінюється з підвищенням концентрації. На кривих залежності поверхневого натягу від логарифму концентрації спостерігається різкий злам, абсциса якого відповідає ККМ.
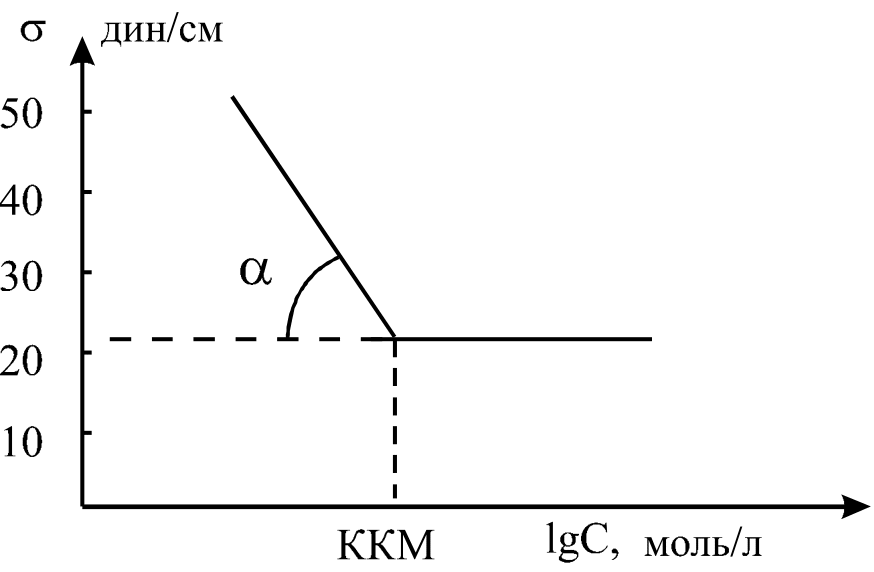
Рис.1.9. Визначення ККМ на ізотермі поверхневого натягу
Метод поверхневого натягу володіє тією перевагою, що точність визначення майже не залежить від виміряної ККМ, тобто вона майже однакова для речовин з довгим або коротким ланцюгом, так як поверхневий натяг у всіх випадках змінюється практично на одну і ту ж величину. Точність вимірювання ККМ іншими методами знижується із зменшенням цієї величини. Середня квадратична похибка при визначенні ККМ по поверхневому натягу становить 2-3%. Крім цього, вимірювання поверхневого натягу дозволяє оцінити поверхневу активність даної речовини і розрахувати величину адсорбції Гіббса (надлишок розчиненої речовини) відповідно до рівняння Гіббса і площу, що займає молекула в насиченому адсорбційному шарі (див. роботу 1.1.1).
