
- •Навчально-методичний посібник
- •Ужгород–2011
- •Вступ. Предмет колоїдної хімії
- •Тема 1. Поверхневі явища. Адсорбція
- •1.1.Визначення поверхневого натягу і адсорбції поверхнево-активних речовин на межі рідина–повітря
- •Хід роботи
- •1.2.Дослідження поверхневої активності речовин гомологічного ряду
- •Хід роботи
- •1.3.Визначення питомої поверхні вугілля методом вимірювання ізотерм адсорбції поверхнево-активної речовини
- •1.4.Адсорбція оцтової кислоти вугіллям
- •1.5.Вплив адсорбційних шарів на змочування твердих поверхонь
- •Хід роботи
- •1.6. Визначення критичної концентрації міцелоутворення в розчинах пар
- •А) Визначення ккм по поверхневому натягу
- •Хід роботи
- •Б) Кондуктометричне визначення ккм
- •Хід роботи
- •Тема 2. Утворення дисперсних систем
- •2.1.Одержання золей методом заміни розчинника
- •2.1.1.Одержання золю каніфолі
- •2.1.2.Одержання золю сірки
- •2.1.3.Одержання етерозолю хлориду натрію
- •2.2.Одержання золей при проходженні хімічної реакції
- •2.2.1.Одержання золей галогенідів срібла
- •Хід роботи
- •2.2.2.Одержання золю гідрату оксиду заліза (по методу Крекке)
- •2.2.3.Одержання золю гідрату оксиду заліза (по методу Грема)
- •2.3.Одержання золей методом пептизації
- •2.3.1.Одержання золю гідроксиду алюмінію
- •2.3.2.Одержання золю оксиду ванадію (V)
- •2.3.3.Одержання золю сірчистого кадмію
- •2.3.4.Одержання золю берлінської лазурі
- •2.3.5.Одержання золю гідроксиду хрому (III)
- •2.3.6.Одержання золю фосфату алюмінію
- •2.3.7.Одержання золю фосфату заліза
- •2.5.2.Одержання гелю хлориду свинцю
- •2.6.Діаліз розчину желатину
- •Тема 3. Електроповерхневі властивості дисперсних систем з.1.Визначення величини електрокінетичного потенціалу методом електрофорезу
- •3.2.Визначення знаку заряду колоїдної частинки (капілярний аналіз)
- •3.3.Аналіз суміші барвників
- •3.4.Визначення ізоелектричної точки білків
- •3.5.Вплив домішок солей на положення ізоелектричної точки казеїну
- •Тема 4. Стійкість і коагуляція дисперсних систем
- •4.1.Коагуляція колоїдних розчинів електролітами
- •4.2.Визначення порогу коагуляції золів гідроксиду заліза і йодиду срібла
- •Хід роботи
- •4.3.Визначення коагуляції золю каніфолі хлоридом алюмінію (перезарядження золю і неправильні ряди)
- •4.4.Порівняння висолюючої дії електролітів на розчин желатини
- •4.5.Захисна дія желатини
- •Хід роботи
- •Тема 5. Молекулярно-кінетичні та оптичні властивості дисперсних систем
- •5.1.Визначення концентрації золю каніфолі
- •Візуальний нефелометр
- •Хід роботи
- •5.2.Вивчення кінетики утворення золю сірки
- •Хід роботи
- •5.3.Визначення середнього розміру частинок золю нефелометричним методом
- •Хід роботи
- •5.4.Седиментаційний аналіз
- •Хід роботи Методика аналізу на седиментометрі Фігуровського
- •Методика аналізу на торзійних терезах
- •Тема 6. Структуроутворення дисперсних систем
- •6.1.Визначення молекулярної маси полімерів віскозиметричним способом
- •Хід роботи
- •6.2.Вплив нагрівання на в’язкість суспензії крохмалю
- •6.3.Визначення часу тиксотропного застуднівання гелей гідрату оксиду заліза
- •6.4.Набухання гелів
- •Хід роботи
- •6.5.Дослідження швидкості набухання желатини
- •6.6.Утворення кристалів йодиду свинцю в студні кремніевої кислоти
- •Тема 7. Грубодисперсні системи, їх властивості та застосування
- •7.1.Методи визначення фаз в емульсії
- •А) Метод змішування
- •Б) Метод електропровідності
- •В) Метод забарвлення
- •7.2.Приготування емульсії бензолу у воді
- •7.3.Одержання і дослідження емульсій типу м/в та в/м
- •7.4.Одержання розведених емульсій різних масел у воді методом заміни розчинника
- •7.5.Одержання прозорої емульсії гліцерину в оцтовоаміловому ефірі
- •7.6.Тиксотропні властивості емульсій
- •7.7.Дослідження стійкості піни
- •7.8.Визначення “часу життя” крапель на поверхні розділу масло-вода
- •Перелік питань для підготовки до колоквіумів вступ. Предмет колоїдної хімії
- •Тема 1. Поверхневі явища
- •Тема 1. Адсорбція
- •Тема 2. Утворення дисперсних систем. Методи їх очищення
- •Тема 3. Електроповерхневі властивості дисперсних систем
- •Тема 4. Стійкість і коагуляція дисперсних систем
- •Тема 5. Оптичні та молекулярно-кінетичні властивості дисперсних систем
- •Тема 6. Структуроутворення в дисперсних системах
- •Тема 7. Грубодисперсні системи, їх властивості та застосування
- •Рекомендована література
Тема 1. Поверхневі явища. Адсорбція
1.1.Визначення поверхневого натягу і адсорбції поверхнево-активних речовин на межі рідина–повітря
Надлишок вільної поверхневої енергії, що припадає на одиницю площі поверхневого шару на межі рідина–повітря, називається поверхневим натягом, а на межі рідина-рідина -граничним натягом.
Метою даної роботи є одержання ізотерм поверхневого натягу та адсорбції для водних розчинів поверхнево-активних речовин на межі з повітрям.
Вимірювання поверхневого натягу здійснюється за допомогою методу максимального тиску бульбашок в приладі Ребіндера.
Хід роботи
Для визначення величини поверхневого натягу за методом Ребіндера (рис.1.1) вимірюють тиск, необхідний для утворення бульбашки або краплі. Посудина 1 з досліджуваною рідиною 2 поміщена в посудину, що служить термостатом 3, за допомогою бокової трубки 5 з’єднується з аспіратором або водоструменевим насосом 6 та манометром 7. Посудина щільно закривається гумовою пробкою, через яку проходить трубка 4, яка закінчується капілярним кінцем.

Рис.1.1. Прилад Ребіндера.
Для виконання вимірювань досліджувану рідину 2 заливають в посудину 1 до рівня, при якому кінець капіляра 4 занурюється в неї не більше, ніж на 1 мм. Надлишок рідини при необхідності відбирають за допомогою капіляра 4. Посудину 1 закривають щільно пробкою з трубкою 4. Випускаючи повільно рідину з аспіратора 6, в посудині 1 над рідиною 2 створюється розрідження (тобто тиск), яке стає достатнім для утворення бульбашки повітря або краплі рідини. Між тиском Р в момент продавлювання бульбашки, зафіксованим на манометрі 7, і величиною поверхневого натягу та кривизною поверхні бульбашки r згідно другого закону Лапласа існує залежність:
![]() ,
,
де r – радіус капілярного кінця трубки, оскільки в момент максимального тиску кривизна поверхні бульбашки став рівна радіусу капіляра.
Для двох рідин: з поверхневим натягом для досліджуваної рідини та 0 для стандартної рідини (дистильованої води) при визначенні тиску з одним і тим же капіляром одержимо:
![]() ;
; ![]() ;
; ![]() ,
,
де h0, h – різниці висот стандартної та досліджуваної рідин в манометрі, звідки
![]() .
.
Перед вимірюванням поверхневого натягу посудину 1 з трубкою добре промивають дистильованою водою. Вимірювання розпочинають з стандартної рідини (дистильованої води). Обережно відкривають кран аспіратора, створюючи розрідження в системі, внаслідок чого рівень рідини в манометрі 7 підніметься. На кінці капіляру 4 поступово утворюється бульбашка повітря, яка при досягненні максимального тиску Р проходить через поверхневий шар і лопає. В цей момент тиск в системі різко знижується і рівень рідини в манометрі опускається. В результаті утворення нової бульбашки висота в манометрі знову збільшується. Таким чином рівень рідини в манометрі весь час коливається.

Рис.1.2. Ізотерми поверхневого натягу та адсорбції
Щоб зменшити коливання рідини в манометричній трубці, домагаються рівномірного проскакування бульбашки з інтервалом 10-20 с. Час утворення та відриву бульбашок повітря регулюють шляхом зміни швидкості витікання води за допомогою крана аспіратора. Якщо покази манометра протягом 2-3 хв не змінюються, їх записують в журнал. Дослід повторюють кілька разів з чистою дистильованою водою, а потім з розчинами поверхнево-активної речовини (наприклад, бутилового спирту) у воді слідуючих концентрацій: 0,5; 0,25; 0,10; 0,05; 0,025; 0,01; 0,005 моль/л. Для кожного розчину зазначають, при якому розрідженні проскакує бульбашка. Вимірювання здійснюють від найменшої концентрації розчину до найбільшої.
За одержаними даними розраховують будують ізотерму поверхневого натягу =f(C). Знаходять величини адсорбції поверхнево-активної речовини при різних концентраціях її в розчині. Для цього найзручнішим методом є графічний. Рівняння Гіббса
![]()
зв’язує
ізотерму поверхневого
натягу і
ізотерму адсорбції Г=f(C),
тому за ізотермою поверхневого натягу
можна розрахувати ізотерму адсорбції
.Для цього до кривої =f(C)
в різних
точках будують дотичні, продовжуючи їх
до перетину з віссю ординат (рис.1.2).
Через точки, до яких побудовані дотичні,
проводять прямі паралельно до осі абсцис
також до перетину їх з віссю ординат.
Вимірюють відрізки Z
по осі ординат. Довжина такого відрізку
Z,
виражена в одиницях поверхневого натягу,
рівна -
![]() ,
оскільки згідно побудови
,
оскільки згідно побудови
![]() .
Звідки
.
Звідки
![]() .
.
Підставивши
значення Z
у рівняння Гіббса, одержимо
![]() .
.
Таким чином розраховують значення величини адсорбції Г для тих концентрацій, для яких у відповідних точках на кривій побудовані дотичні. Їх значення наносять на графік (рис.1.2), з’єднуючи точки Г1=f(C1), Г2=f(C2) і т.д., одержують адсорбційну ізотерму.
Для розрахунку площі, яку займає одна молекула в адсорбційному шарі, необхідно знати Г∞ .Останнє можна розрахувати також графічним методом, користуючись рівнянням Ленгмюра, яке перетворюють слідуючим чином:
![]() ,
,
де Г∞ – величина адсорбції при повному насиченні шару;
К – стала, яка характеризує спорідненість адсорбованої речовини до поверхні адсорбента.
![]() .
.
Останнє рівняння є рівнянням прямої типу y=ax+b.
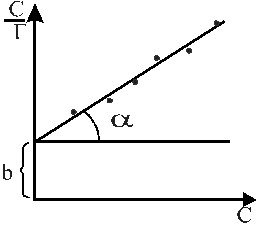
Рис.1.3. Залежність С/Г від концентрації розчину
Для того, щоб знайти Г∞, на осі абсцис відкладають значення концентрації С, а на осі ординат величини С/Г, визначені з рівняння Гіббса, і з’єднують одержані точки прямою (рис.1.3). Тангенс кута , що утворюється даною прямою з віссю абсцис, рівний І/а, тобто Г∞, а відрізок, що відсікається від осі ординат, виражає собою величину І/кГ∞. Якщо позначити число молекул, які покривають 1 см2 поверхні в насиченому адсорбованими молекулами шарі, через N0, то очевидно, знаючи адсорбцію Г∞, можна розрахувати площу q, яка припадає на одну молекулу:
![]() ,
,
де NA- число Авогадро.
Знаючи Г∞, густину d розчиненої речовини (d бутилового спирту становить 0,8 г/cм3) і її молекулярну масу М, можна знайти товщину адсорбційного шару, що відповідає довжині молекули: Г∞ М = d, звідки = Г∞М/d .
Як свідчать результати ряду вимірювань, q є характерною величиною для гідрофільної групи і не залежить від числа атомів, які входять в другу частину молекули. Значення при переході в гомологічному ряді від одного гомолога до наступного гомолога змінюється на величину, що відповідає довжині СН2–групи.
Одержані результати записують в слідуючу таблицю:
Речовина |
Концентрація, моль/л |
h, см |
, ерг/см2 |
Г, моль/см2 |
Г∞ , моль/см2 |
q, см2 |
, см |
|
|
|
|
|
|
|
|
