
- •Навчально-методичний посібник
- •Ужгород–2011
- •Вступ. Предмет колоїдної хімії
- •Тема 1. Поверхневі явища. Адсорбція
- •1.1.Визначення поверхневого натягу і адсорбції поверхнево-активних речовин на межі рідина–повітря
- •Хід роботи
- •1.2.Дослідження поверхневої активності речовин гомологічного ряду
- •Хід роботи
- •1.3.Визначення питомої поверхні вугілля методом вимірювання ізотерм адсорбції поверхнево-активної речовини
- •1.4.Адсорбція оцтової кислоти вугіллям
- •1.5.Вплив адсорбційних шарів на змочування твердих поверхонь
- •Хід роботи
- •1.6. Визначення критичної концентрації міцелоутворення в розчинах пар
- •А) Визначення ккм по поверхневому натягу
- •Хід роботи
- •Б) Кондуктометричне визначення ккм
- •Хід роботи
- •Тема 2. Утворення дисперсних систем
- •2.1.Одержання золей методом заміни розчинника
- •2.1.1.Одержання золю каніфолі
- •2.1.2.Одержання золю сірки
- •2.1.3.Одержання етерозолю хлориду натрію
- •2.2.Одержання золей при проходженні хімічної реакції
- •2.2.1.Одержання золей галогенідів срібла
- •Хід роботи
- •2.2.2.Одержання золю гідрату оксиду заліза (по методу Крекке)
- •2.2.3.Одержання золю гідрату оксиду заліза (по методу Грема)
- •2.3.Одержання золей методом пептизації
- •2.3.1.Одержання золю гідроксиду алюмінію
- •2.3.2.Одержання золю оксиду ванадію (V)
- •2.3.3.Одержання золю сірчистого кадмію
- •2.3.4.Одержання золю берлінської лазурі
- •2.3.5.Одержання золю гідроксиду хрому (III)
- •2.3.6.Одержання золю фосфату алюмінію
- •2.3.7.Одержання золю фосфату заліза
- •2.5.2.Одержання гелю хлориду свинцю
- •2.6.Діаліз розчину желатину
- •Тема 3. Електроповерхневі властивості дисперсних систем з.1.Визначення величини електрокінетичного потенціалу методом електрофорезу
- •3.2.Визначення знаку заряду колоїдної частинки (капілярний аналіз)
- •3.3.Аналіз суміші барвників
- •3.4.Визначення ізоелектричної точки білків
- •3.5.Вплив домішок солей на положення ізоелектричної точки казеїну
- •Тема 4. Стійкість і коагуляція дисперсних систем
- •4.1.Коагуляція колоїдних розчинів електролітами
- •4.2.Визначення порогу коагуляції золів гідроксиду заліза і йодиду срібла
- •Хід роботи
- •4.3.Визначення коагуляції золю каніфолі хлоридом алюмінію (перезарядження золю і неправильні ряди)
- •4.4.Порівняння висолюючої дії електролітів на розчин желатини
- •4.5.Захисна дія желатини
- •Хід роботи
- •Тема 5. Молекулярно-кінетичні та оптичні властивості дисперсних систем
- •5.1.Визначення концентрації золю каніфолі
- •Візуальний нефелометр
- •Хід роботи
- •5.2.Вивчення кінетики утворення золю сірки
- •Хід роботи
- •5.3.Визначення середнього розміру частинок золю нефелометричним методом
- •Хід роботи
- •5.4.Седиментаційний аналіз
- •Хід роботи Методика аналізу на седиментометрі Фігуровського
- •Методика аналізу на торзійних терезах
- •Тема 6. Структуроутворення дисперсних систем
- •6.1.Визначення молекулярної маси полімерів віскозиметричним способом
- •Хід роботи
- •6.2.Вплив нагрівання на в’язкість суспензії крохмалю
- •6.3.Визначення часу тиксотропного застуднівання гелей гідрату оксиду заліза
- •6.4.Набухання гелів
- •Хід роботи
- •6.5.Дослідження швидкості набухання желатини
- •6.6.Утворення кристалів йодиду свинцю в студні кремніевої кислоти
- •Тема 7. Грубодисперсні системи, їх властивості та застосування
- •7.1.Методи визначення фаз в емульсії
- •А) Метод змішування
- •Б) Метод електропровідності
- •В) Метод забарвлення
- •7.2.Приготування емульсії бензолу у воді
- •7.3.Одержання і дослідження емульсій типу м/в та в/м
- •7.4.Одержання розведених емульсій різних масел у воді методом заміни розчинника
- •7.5.Одержання прозорої емульсії гліцерину в оцтовоаміловому ефірі
- •7.6.Тиксотропні властивості емульсій
- •7.7.Дослідження стійкості піни
- •7.8.Визначення “часу життя” крапель на поверхні розділу масло-вода
- •Перелік питань для підготовки до колоквіумів вступ. Предмет колоїдної хімії
- •Тема 1. Поверхневі явища
- •Тема 1. Адсорбція
- •Тема 2. Утворення дисперсних систем. Методи їх очищення
- •Тема 3. Електроповерхневі властивості дисперсних систем
- •Тема 4. Стійкість і коагуляція дисперсних систем
- •Тема 5. Оптичні та молекулярно-кінетичні властивості дисперсних систем
- •Тема 6. Структуроутворення в дисперсних системах
- •Тема 7. Грубодисперсні системи, їх властивості та застосування
- •Рекомендована література
5.2.Вивчення кінетики утворення золю сірки
Для виконання даної роботи використовують фотоелектричний нефелометр. Він складається з оптичної підставки (рис.5.3), на яку встановлюють кожух 1 з джерелом світла, діафрагму 2, підставку 3 з посудиною для золю і два фотоелементи 4 і 5.
Фотоелементи можуть по черзі за допомогою перемикача з’єднуватись з гальванометром.
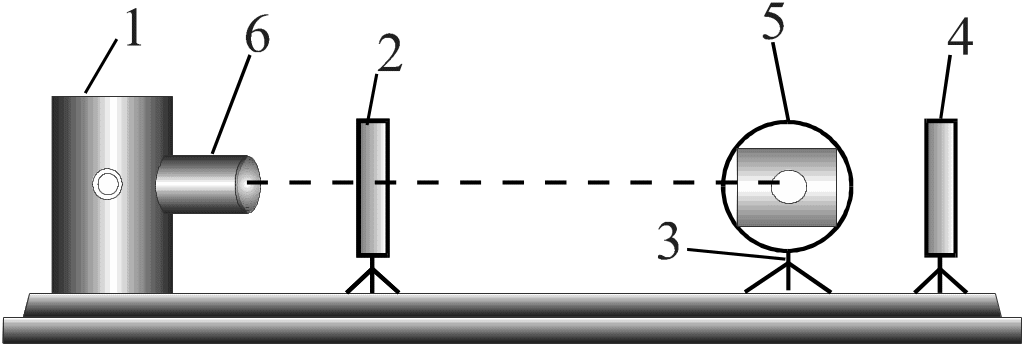
Рис.5.3. Фотоелектричний нефелометр.
Джерелом світла є електрична лампа, яка знаходиться в металічному кожусі; світло проходить через отвір в цьому кожусі, закритий лінзою–конденсатором 6, що концентрує промені на вікно діафрагми. Для регулювання постійної напруги, яка живить лампу, використовують спеціальний стабілізатор напруг або при його відсутності – реостат.
Посудина для колоїдного розчину має вигляд кубу і виготовляється з органічного скла (плексигласу).
Фотоелементи (селенові або купроксидні) встановлюють так, щоб у віконечко фотоелементу 4 потрапляло світло, яке пройшло через колоїдний розчин, а в віконечко фотоелемента 5, перпендикулярне до віконця фотоелемента 4 – світло, розсіяне цим розчином. За допомогою фотоелемента 4 вимірюється інтенсивність світла, що пройшло через розчин; фотоелементом 5 визначається інтенсивність розсіяного світла.
Працюючи з чутливим гальванометром, необхідно поводитись з ним дуже обережно. Стрілка гальванометра повинна бути аретована і вивільнятись тільки на час проведення вимірювань (повертанням за часовою стрілкою голівки аретиру). Перед початком вимірювань слід перевірити правильність встановлення стрілки на нуль (при невключеному приладі) і у випадку необхідності здійснити таке встановлення.
Роботу розпочинають з того, що ретельно промивають кювету і заповнюють її дистильованою водою. Включають струм для живлення лампи і реостатом підтримують постійною напругу порядку 80-100 В. Враховуючи коливання напруги струму, необхідно слідкувати за вольтметром щодо стабільності напруги струму або користуватись стабілізатором. Конденсатор 6 встановлюють так, щоб на кювету падав пучок приблизно паралельних променів. Якщо при цьому одержується занадто сильний потік світла, спрямований на фотоелемент 4 його можна послабити, помістивши безпосередньо перед цим фотоелементом матове скло.
Для встановлення величини похибки на відображення світла частинами приладу і стінками кювети записують покази гальванометра при включенні його на фотоелемент. Записана при цьому цифра є похибкою, яку слід віднімати при вимірюваннях інтенсивності розсіяного світла.
Переключають гальванометр на фотоелемент 4 і вимірюють, потім знімають кювету з водою і знову вимірюють значення по гальванометру. Різниця цих вимірювань дає похибку, яку слід додавати при визначенні інтенсивності світла, яке проходить через досліджувані розчини. Ця похибка зумовлена поглинанням і розсіюванням світла кюветою і розчинником (якщо під час вимірювань стрілка гальванометра вийде за межі шкали, слід зменшити отвір діафрагми або напруги на лампі і повторити вимірювання).
Після цього заповнюють кювету досліджуваним розчином і послідовно знімають покази гальванометра при включенні фотоелементів 4 та 5. Щоб уникнути нагрівання розчинів і зниження чутливості фотоелементів, лампу включають тільки на момент відліку по гальванометру.
Відліки по гальванометрах після внесення в них поправок перераховують на силу фотоструму, яка пропорційна інтенсивності освітлення (чутливість гальванометра вказана на шкалі приладу).
Таким чином можна прирівняти відношення струмів до відношення інтенсивності освітлення обох фотоелементів:
![]() або
або
![]() .
.
