
- •1 Кальцинована сода 4
- •2 Бікарбонат натрію 31
- •3 Гідроксид натрію 36
- •1 Кальцинована сода
- •1.1 Основи технології кальцинованої соди
- •1.1.1 Відділення очистки розсолу
- •1.1.2 Відділення амонізації
- •1.1.3 Відділення карбонізації
- •1.1.4 Відділення кальцинації
- •1.1.5 Відділення регенерації аміаку
- •1.1.6 Відділення випалу вапняку
- •1.1.7 Відділення гасіння вапна
- •1.2 Аналіз кальцинованої соди
- •1.2.1 Визначення втрати при прожарюванні
- •1.2.2 Вміст вуглекислого натрію
- •1.2.3 Вміст хлористого натрію
- •1.3. Аналіз вапняного молока
- •1.3.1 Визначення вмісту оксиду кальцію
- •1.3.2 Вміст карбонату кальцію
- •1.4 Аналіз амонізованого розсолу
- •1.4.1 Визначення прямого титру
- •1.4.2 Визначення загального аміаку
- •1.4.3 Визначення зв’язаного аміаку
- •1.4.4 Визначення вуглекислоти
- •1.4.5 Вміст хлориду натрію
- •1.5 Аналіз содосольового розчину
- •1.5.1 Визначення загальної лужності
- •1.5.2 Визначення вмісту іонів і
- •1.5.3 Визначення вмісту іонів і
- •1.6 Визначення сульфатів в розчинах содового виробництва ваговим методом
- •1.7 Визначення кальцію в дистилерній рідині комплексонометричним методом
- •1.8 Визначення в пробі кальцинованої соди масової частки заліза в перерахунку на оксид заліза (III)
- •2 Бікарбонат натрію
- •2.1 Основи технології бікарбонату натрію
- •2.2 Аналіз бікарбонату натрію
- •3 Гідроксид натрію
- •3.1 Основи технології гідроксиду натрію
- •3.2 Аналіз гідроксиду натрію на вміст основної речовини і карбонату натрію
- •Вимоги до оформлення робіт
- •Контрольні питання
- •Перелік рекомендованої літератури
1.5.2 Визначення вмісту іонів і
Метод базується на осадженні іонів розчином хлористого барію за реакцією
![]()
Іони , що осаджуються в розчині, титрують розчином кислоти з індикатором фенолфталеїном.
Вміст іонів обчислюють за різницею між загальною лужністю і вмістом іонів .
Обладнання і реактиви:
розчин соляної кислоти ( = 1 н);
розчин хлориду барію, нейтральний за фенолфталеїном (
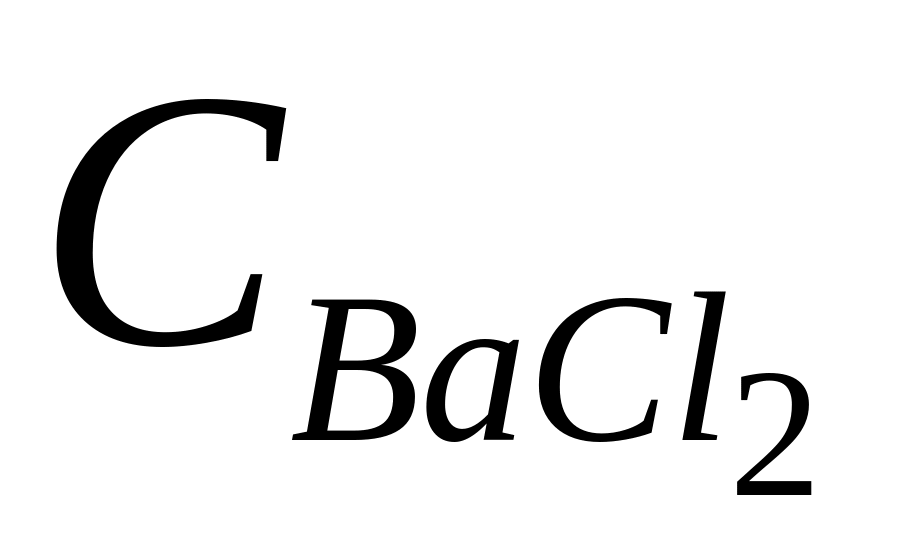 = 20 %);
= 20 %);розчин фенолфталеїну в етанолі (Сф.ф.= 1 %);
піпетка об’ємом 10 мл;
циліндр мірний об’ємом 100 мл;
колба конічна об’ємом 500 мл.
Методика визначення. Пробу в кількості 10 мл відбирають піпеткою і переносять до конічної колби об’ємом 250 мл. Циліндрами відміряють 7080 мл дистильованої води, 25 мл розчину хлориду барію і додають у колбу з розчином, що аналізується. Закривають колбу пробкою, перемішують розчин і залишають на 5 хвилин. Далі додають 3 – 4 краплі розчину фенолфталеїну (якщо після додавання фенолфталеїну рожеве забарвлення не виникає, це свідчить про відсутність іонів ) і титрують розчином соляної кислоти до зникнення рожевого забарвлення індикатора.
Вміст іонів вираховують за формулою:
![]() ,
,
де – вміст іонів , нд; V – об’єм 1 н розчину соляної кислоти за фенолфталеїном, що пішов на титрування, мл.
Вміст іонів визначають за формулою:
![]() ,
,
де
![]() – вміст іонів
,
нд; Л – загальна лужність содосольового
розчину за п. 1.5.1, нд;
–
вміст іонів
за п. 1.5.2.
– вміст іонів
,
нд; Л – загальна лужність содосольового
розчину за п. 1.5.1, нд;
–
вміст іонів
за п. 1.5.2.
1.5.3 Визначення вмісту іонів і
Метод базується на перетворенні бікарбонату натрію в карбонат при дії лугу, осадженні карбонатів хлоридом барію і титруванні надлишку гідроксиду натрію в присутності фенолфталеїну за такими реакціями:
NaHCO3 + NaOH = Na2CO3 + H2O
Na2CO3 + BaCl2 = BaCO3 + 2NaCl
NaOH + HCl = NaCl + H2O
Вміст іонів визначають за різницею між загальною лужністю і вмістом іонів .
Обладнання і реактиви:
розчин соляної кислоти ( = 1 н);
розчин гідроксиду натрію = 1 н;
розчин хлориду барію, нейтральний за фенолфталеїном (
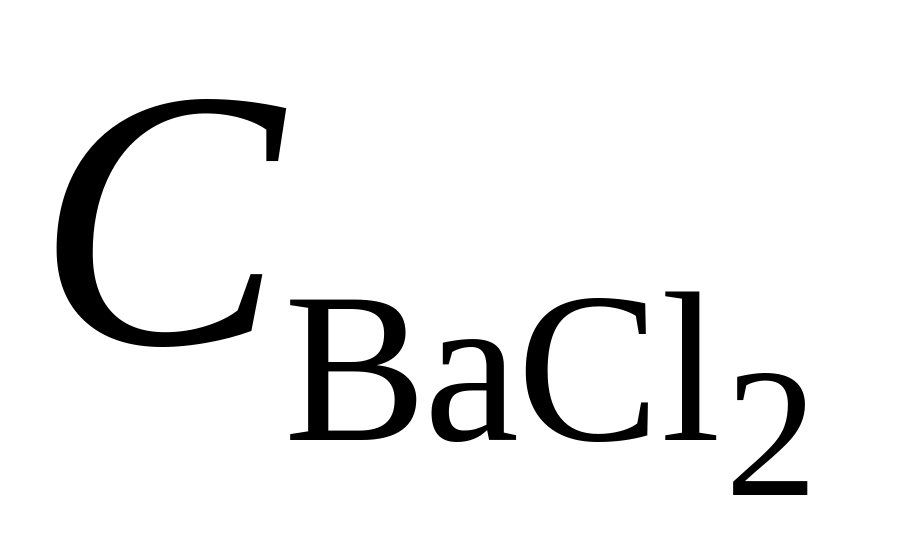 =
20 %);
=
20 %);спиртовий розчин фенолфталеїну (Сф.ф.= 1 %);
піпетка об’ємом 10 мл;
колба конічна об’ємом 250 мл;
циліндр мірний об’ємом 25 мл;
бюретка об’ємом 25 мл.
Методика визначення. Піпеткою відбирають 10 мл досліджуваної проби і переносять до конічної колби об’ємом 250 мл, додають 2530 мл дистильованої води. З бюретки відміряють (точно!!!) 10 мл розчину гідроксиду натрію і доводять до кипіння. Циліндром відміряють 25 мл розчину хлориду барію і додають у колбу з гарячим розчином, закривають колбу пробкою, перемішують і залишають на 5 хвилин. Додають 3 – 4 краплі розчину фенолфталеїну і титрують розчином HCl до зникнення рожевого забарвлення індикатора. Одночасно в тих же умовах проводять „холостий” дослід.
Вміст іонів розраховують за формулою
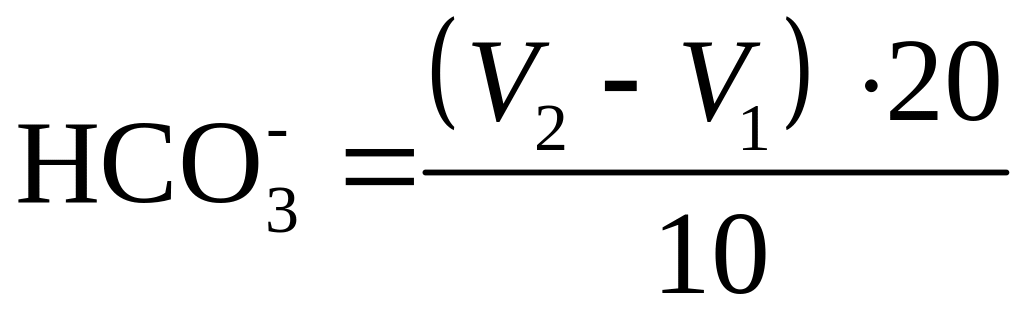 ,
,
а вміст іонів
![]() за формулою
за формулою
![]() .
.
У формулах (1.47) – (1.48)
![]() – вміст іонів
,
нд;
– вміст іонів
,
нд; V2 – об’єм 1 н розчину
HCl, що пішов на титрування „холостого
досліду”, мл; V1 – об’єм
1 н розчину HCl, що пішов на титрування,
мл; Л – загальна лужність содосоляного
розчину за п. 1.5.1, нд.
– вміст іонів
,
нд;
– вміст іонів
,
нд; V2 – об’єм 1 н розчину
HCl, що пішов на титрування „холостого
досліду”, мл; V1 – об’єм
1 н розчину HCl, що пішов на титрування,
мл; Л – загальна лужність содосоляного
розчину за п. 1.5.1, нд.
