
- •Методичні розробки
- •Частина 2
- •Ужгород – 2005
- •Передмова
- •Класифікація хімічних елементів
- •Електронні структури атомів
- •Електронегативність атомів неметалів
- •Явище алотропії
- •Будова простих речовин
- •Хімічні властивості простих речовин
- •Одержання неметалів
- •Огляд елементів
- •Водневі сполуки неметалів
- •Властивості оксидів неметалів
- •Одержання оксидів
- •Кислоти
- •Класифікація кислот
- •Фізичні властивості кислот
- •Номенклатура кислот
- •Хімічні властивості кислот
- •Одержання кислот
- •Використання кислот
- •Важливіші солі кислот
- •Лабораторна робота
- •Загальні властивості металів
- •Елементи-метали в періодичній системі
- •Металічний зв'язок
- •Кристалічна структура металів
- •Фізичні властивості металів
- •Хімічні властивості металів
- •2. Взаємодія з кислотами
- •Знаходження в природі
- •Загальні принципи промислового одержання металів
- •Термічний аналіз
- •Загальні властивості сполук металів
- •Оксиди металів
- •Гідроксиди металів
- •Загальна характеристика
- •Поширення у природі
- •Прості речовини
- •З активними металами р-метали при сплавленні утворюють бінарні сполуки постійного складу, в яких роль р-метал проявляє відповідний групі негативний ступінь окиснення:
- •Сполуки елементів
- •Гідроксиди
- •Якісні реакції на елементи
- •Використання
- •Твердість води та її усунення
- •Усунення постійної твердості води:
- •Лабораторні роботи:
- •Елементи і в підгрупи Властивості елементів та їх простих речовин:
- •Одержання:
- •Елементи іі в підгрупи Властивості елементів та їх простих речовин:
- •1. Взаємодія з неметалами
- •Одержання металів. Цинк та кадмій добувають відновленням їх оксидів вуглецем:
- •Елементи ііі b підгрупи
- •Елементи іv в підгрупи
- •Метали. Титан, цирконій та гафній – сріблясті тугоплавкі метали, на поверхні яких утворюється щільна оксидна плівка, яка захищає їх від окиснення.
- •Елементи V в підгрупи
- •Елементи VI в підгрупи Властивості елементів та простих речовин
- •Елементи viі в підгрупи Властивості елементів та простих речовин
- •Сполуки Mn(II).
- •Елементи VIII в підгрупи Властивості елементів підгрупи заліза
- •Гідроксиди металів(II) утворюються при дії розчинів лугів на солі металів(II) без доступу повітря:
- •Якісні реакції на іони:
- •При зневодненні кристалогідрату хлориду міді() із 2,046 г кристалогідрату одержано 1,614 г безводного хлориду міді(). Визначити число молекул води в кристалогідраті.
- •Література для самостійної роботи студентів
Хімічні властивості кислот
Кислоти у водних
розчинах мають деякі загальні
властивості, обумовлені
наявністю Н+:
їх розчини кислі на смак, однаково
змінюють колір індикаторів, можуть
вступати в реакції іонної обмінної
взаємодії, реакції взаємодії з металами,
реакції розкладу.
Реакції іонної обмінної взаємодії кислоти з:
основою з утворенням солі і води згідно схеми МеОН+НА МеА+Н2О:
NaOH+HCl NaCl+H2O;
у випадку багатокислотних основ в залежності від кількості кислоти можуть утворюватися основні чи середні солі:
Fe(OH)3+HCl Fe(OH)2Cl+H2O;
Fe(OH)3+2HCl Fe(OH)Cl2+2H2O;
Fe(OH)3+3HCl FeCl3+3H2O;
у випадку багатоосновних кислот в залежності від кількості основи можуть утворюватися кислі чи середні солі:
NaOH+H3PO4 NaH2PO4+H2O;
2NaOH+H3PO4 Na2HPO4+2H2O;
3NaOH+H3PO4 Na3PO4+3H2O;
оксидом металу з утворенням солі та води згідно схеми МеО+НА МеА+Н2О:
Na2O+2HNO3 2NaNO3+2H2O K2O+H2SO4 K2SO4+H2O
СaO+2HNO3 Ca(NO3)2+2H2O ZnO+H2SO4 ZnSO4+H2O
Al2O3+6HNO3 2Al((NO3)3+3H2O Fe2O3+3H2SO4 Fe2(SO4)3+3H2O
сіллю з утворенням іншої солі та кислоти згідно схеми МеА+НА МеА+НА; такі реакції можуть проходити тільки у випадку, коли один з продуктів реакції або нерозчинний у воді або газоподібний або слабо дисоціює, наприклад:
а) утворення осаду: AgNO3+HCl AgCl+HNO3
BaCl2+H2SO4 BaSO4+2HCl
Na2SiO3+HCl NaCl+H2SiO3
б) утворення леткої кислоти: 2NaClсух.+H2SO4конц. Na2SO4+2HCl
2NaNO3сух.+H2SO4конц. Na2SO4+2HNO3
FeS+2HCl FeCl2 +H2S
в) утворення малодисоційованої сполуки (слабої (в т.ч. нестійкої) кислоти):
Ca3(PO4)2+ H2SO4 2H3PO4+3CaSO4
СaCO3+2HCl CaCl2+H2CO3 (H2CO3 H2O+CO2)
У випадку, коли багатоосновна кислота діє на яку-небудь сіль цієї ж кислоти, утворюються кислі солі, наприклад:
Ca3(PO4)2+H3PO4 3СaHPO4
Ca3(PO4)2+4H3PO4 3Сa(H2PO4)2
Na2S+H2S NaHS
Na2CO3+H2CO3 2NaHCO3
Реакції взаємодії кислот з металами є окисно-відновними, причому відновником виступає метал, а окисником – кислота.
Кислоти – слабі окисники – вступають в реакцію згідно схеми Ме+НА МеА +Н2 (тобто відбувається реакція заміщення Н металом, в результаті якої утворюється сіль і виділяється водень), причому в реакцію згідно приведеної схеми вступають не всі метали, а тільки ті, які стоять в ряду стандартних електродних потенціалів ліворуч від Н (отже, Cu, Hg, Ag, Au, Pt – не витісняють Н), наприклад:
Zn+2HCl ZnCl2+H2 але Cu+HCl (реакція не відбувається)
Zn+H2SO4(розв.) ZnSO4+H2
Кислоти – сильні окисники – вступають у взаємодію з металами, причому в результаті такої взаємодії утворюється: 1) сіль відповідної кислоти; 2) продукт відновлення кислоти; 3) вода. Наприклад, сильним окисником є концентрована сірчана кислота, а також і концентрована, і розведена азотна кислота.
Взаємодія концентрованої сірчаної кислоти з металами відбувається згідно схеми:
![]() +
Н2
+
Н2![]() О4
(конц.)
О4
(конц.)
![]() О4
+
О4
+
![]() О2
(
О2
(![]() ,
Н2
,
Н2![]() )
+ Н2О.
)
+ Н2О.
Отже, концентрована сірчана кислота окислює металами, утворюючи сульфат відповідного металу, продукт свого відновлення – SO2, S чи H2S (в залежності від відновлювальної здатності металу) та воду.
Відповідний баланс електронів:
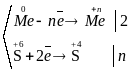 ;
;
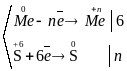 ;
;
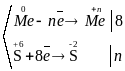
2Fe + 6H2SO4 (конц.) Fe2(SO4)3 + 3SO2 + 6H2O
4Zn + 5H2SO4 (конц.) 4ZnSO4 + H2S + 4H2O
Взаємодія і розведеної, і концентрованої азотної кислоти з металами відбувається згідно схеми:
+
Н![]() О3
О3
![]() О3
+
О3
+
![]() О2
(
О2
(![]() О,
О,
![]() 2O,
2O,
![]() Н4
О3)
+ Н2О.
Н4
О3)
+ Н2О.
Отже, азотна кислота взаємодіє з металами, утворюючи нітрат відповідного металу, продукт свого відновлення – NO2, NO, N2 чи NH3 (який в присутності НNO3 одразу утворює NH4NO3) (в залежності від відновлювальної здатності металу) та воду.
Відповідний баланс електронів:
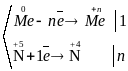 ;
;
 ;
;
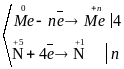 ;
;
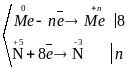
Із електронних балансів видно, що у всіх випадках окисником виступає кислота, а в процесі реакції вона відновлюється, відповідно метал є відновником і в процесі реакції він окислюється.
3Cu + 8HNO3 (розв.) 3Cu(NO3)2 + 2NO + 4H2O
4Zn + 10HNO3 (розб.) 4Zn(NO3)2 + NH4NO3 + 3H2O
Реакції
розкладу:
Оскільки кисневі кислоти є продуктами
приєднання води до відповідних кислотних
оксидів, то при створенні відповідних
умов (зокрема, температури) можливі
обернені реакції розкладу: під час
нагрівання кисневі кислоти розкладаються
на кислотний оксид та воду: H2SO4
![]() H2
О+SO3
H2
О+SO3
4HNO3![]() 2H2O+4NO2+O2
2H2O+4NO2+O2
Окремі кислоти (Н2СО3, Н2SО3) є нестійкими, вони легко розкладаються в момент утворення, і тому можуть існувати тільки у водних розчинах..
Порівняння окисно-відновних властивостей кислот в періодах та групах:
Окисні властивості кисневмісних кислот неметалів в вищих ступенях окиснення різноманітні.
Азотна кислота – і концентрована, і розведена, – сильний окисник, що здатний окислювати практично всі метали (золото і платину розчиняє тільки суміш концентрованих азотної та соляної кислот – “царська водка”), механізм взаємодії був розглянутий вище. Деякі метали – Al, Cr, Fe– при контакті з концентрованою кислотою покриваються плівкою нерозчинних оксидів (пасивуються), тому далі не розчиняються.
Окрім металів, азотна кислота здатна окислювати і неметали згідно схеми
![]() +
Н
О3
+
Н
О3
![]() Оn
+
О2
(
О)
+ Н2О;
Оn
+
О2
(
О)
+ Н2О;
утворений оксид неметалу ( Оn) може сполучатися з частиною води і утворювати відповідну кислоту.
S + 6HNO3(конц.) H2SO4 + 6NO2 + 2H2O
S + 2HNO3(розв.) H2SO4 + 2NO
Азотна
кислота здатна окислювати і інші сполуки,
що мають відновні властивості, наприклад
ті, що містять
![]() ,
,
![]() та
та
![]() .
.
Ортофосфатна кислота H3PO4 (Р розташований під N в V групі періодичної системи) не використовується в якості окисника, хоча може виступати таким, що використовується при одержанні фосфору:
2Ca3(PO4)2+10C+6SiO2 6CaSiO3+10CO+P4
Таким чином, в групах окислювальна здатність елементів послаблюється зверху вниз.
Розташована одному періоді з ортофосфорною сульфатна кислота – концентрована сульфатна кислота – досить сильний окисник (окислює всі метали, окрім благородних, багато неметалів і інші відновники):
Cu+2H2SO4 CuSO4+SO2+2H2O
C+2H2SO4 CO2+2SO2+2H2O
2Р + 5H2SO4(конц.) 2Н3РО4 + 5SO2+ 2H2O
S + 2H2SO4(конц.) 3SO2 + 2H2O
8KI+5H2SO4 4I2+H2S+4K2SO4+4H2O
Хлорна кислота – сильний окисник, здатна взаємодіяти з оксидом сульфуру(ІУ) і вуглецем:
HClO4+4SO2+4H2O 4H2SO4+HCl
HClO4+2C 2CO2+HCl
Таким чином, хоча в цілому порівняння властивостей Н3РО4, H2SO4 і HClO4 затруднене в зв’язку з різними умовами їх існування (концентрації в водних розчинах, стійкості при нагріванні та інших факторів), однак спостерігається тенденція посилення окисних властивостей у елементів одного й того ж періоду зліва направо.
Зручно порівнювати кислотні та окисні властивості кислот одного елементу, який знаходиться в різних ступенях окиснення:
H2S, H2SO3, H2SO4
![]()
Посилення кислотних властивостей із зростанням ступеня окиснення елементу пояснюється тим, що із зростанням позитивного заряду елементу зміцнюється його зв’язок з негативно зарядженим Оксигеном, що призводить до послаблення хімічного звязку О з Н.
Сполуки неметалів в проміжних ступенях окиснення можуть виступати і в якості відновників при взаємодії з енергійними окисниками:
2H2SO3+O2 2H2SO4 2HNO2+O2 2HNO3
5HNO2+2KMnO4+3H2SO4 2MnSO4+5HNO3+K2SO4+3H2O
і в якості окисників:
H2SO3+2H2S 3S+3H2O 2HNO2+2HI I2+2NO+2H2O
Сполуки неметалів в найнижчих ступенях окиснення виступають тільки в якості відновників при взаємодії окисниками:
16HCl+2KMnO4 2KCl+2MnCl2+5Cl2+8H2O
В ряду HF–HCl–HBr–HI зростає сила кислот та їх відновна здатність:
H2SO4(конц.)+2HCl
H2SO4(конц.)+2HBr SO2+Br2+2H2O
H2SO4(конц.)+8HI H2S+4I2+4H2O
