
- •Часть 1
- •Тема: «Сопряжение, как фактор повышения стабильности молекул. Взаимное влияние атомов в молекулах органических соединений и способы ее передачи»
- •«Взаимное влияние атомов в молекулах органических соединений и способы его передачи».
- •Классификация органических реакций. Реакции элетрофильного присоединения и замещения. Кислотно-основные свойства органических соединений
- •Реакционная способность алкенов, алканов, алкадиенов у аренов и гетероциклических соединений.
- •«Кислотные и основные свойства органических соединений»
- •Нуклеофильные реакции карбонильных соединений
- •Реакции нуклеофильного замещения у sp3 – гибридизированного атома углерода. Реакции отщепления.
- •Поли- и гетерофункциональные соединения
- •Кетонная форма енольная форма
Реакционная способность алкенов, алканов, алкадиенов у аренов и гетероциклических соединений.
Основу органических соединений составляют углеводороды. Мы будем рассматривать лишь те реакции, осуществляемых в биологических условиях и соответственно не с самими углеводородами, а с участием углеводородных радикалов.
К ненасыщенным углеводородам мы относим алкены, алкадиены, алкины, циклоалкены и ароматические углеводороды. Объединяющее начало для них π – электронное облако. В динамических условиях также органические соединения склонны подвергаться атаке Е+
О днако взаимодействие для алкинов и аренов приводит к разным результатам по причине разной природы π – электронного облака: локализованного и делокализиванного. Н2
Р еакции АЕ С = С + НОН
Br2
ННаl
Р
 еакция
протекает через образование π и σ –
комплекса.
еакция
протекает через образование π и σ –
комплекса.



 С
= С + Е+ С = С медленно Е
С
= С + Е+ С = С медленно Е
Е+ С – С+
π – комплекс
НОН
С Н2 = СН2 + Н+ СН2 = СН2 СН3 – СН2
π – комплекс σ – комплекс
Н
С
 Н3
= СН2 + +О СН3 – СН2
– ОН
Н3
= СН2 + +О СН3 – СН2
– ОН
Н Н+
Ион этилоксония
П равило Морковникова – присоединение к непредельным углеводородам несимметричного строения НХ определяется относительной устойчивостью промежуточно образующихся карбокатионов
С Н3 СН = Сб-Н2 + НСl СН3 – СН = СН2
НСl
С
 Н3
- +СН – СН3 + Сl- СН3
– СН – СН3
Н3
- +СН – СН3 + Сl- СН3
– СН – СН3
O Сl О
С Н2 = СН – С + НСl СН2 = СН = С
ОН НСl ОН
О О
+
 СН2
– СН – С + Сl¯ СН2
– СН – С
СН2
– СН – С + Сl¯ СН2
– СН – С
Н ОН Сl Н ОН
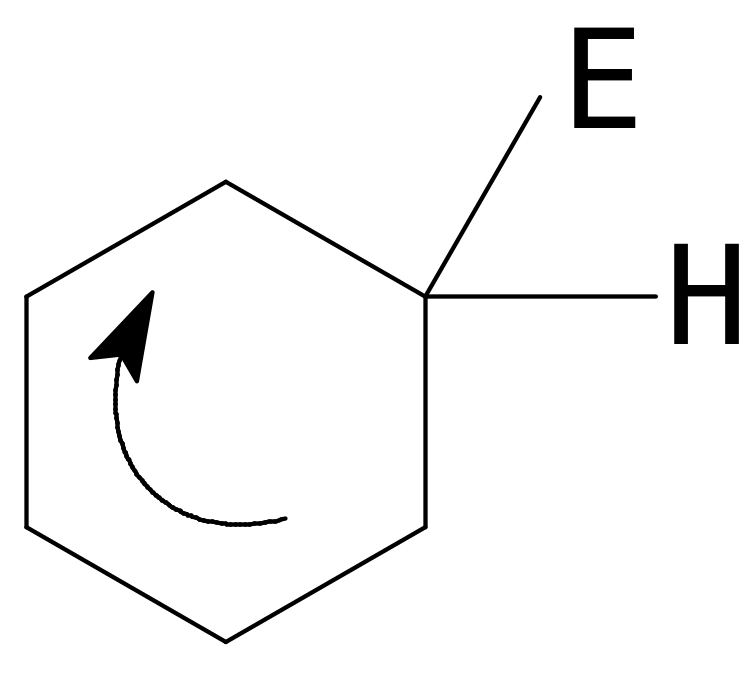
Реакции электрофильного замещения в ароматических системах имеют свои особенности. Первая особенность состоит в том, что для взаимодействия с термодинамически устойчивой ароматической системой требуются сильные электрофилы, которые, как правило, генерируются с помощью катализаторов.
Е
 – У поляризация
Е б+ - Уб- расщепление
Е+ + Ч-
– У поляризация
Е б+ - Уб- расщепление
Е+ + Ч-
Далее идет по знакомому нам механизму

 Е
Е
+
σ-комплекс
π-комплекс
Нарушение ароматичности:
 Е
Е
 ароматичность
восстановлена
ароматичность
восстановлена
- Н+
Реакции алкилирования аренов.
А) Алкилирующим агентов являются галогеналканы с участием кислот Льюиса:
С Н3 – Сl + АlCl3 CH3б+…..Cl…..б-AlCl3 CH3+ +[AlCl4]-
AlCl3 CH3
+ CH3 – Cl + HCl
б) Алкилирующими реагентами являются алкины или спирты в кислой среде:
С Н2 = СН – СН3 + Н+ СН3 – С+Н – СН3 – электрофил
СН – СН3
+ СН3 – С+Н – СН3 СН3
С Н3 – СН – ОН + Н+ (СН3)3 – С+
СН3 СН3 -Н2О
СН3


 С СН3
С СН3
+ (СН3)3С+ СН3
в) Алкилирование в живых организмах также осуществляется с участием карбокатионов, например карбокатиона аллильного типа
 NH2
NH2
СН3 – S+ - СН2 – СН2 – СН – СООН
(СН3)2С = СН – С+Н2
Этот электродил генерируется в живых системах и участвует в биосинтезе некоторых коферментов, жирорастворимых витаминов, терпенов и антибиотиков.
Влияние заместителей на реакционную способность и ориентацию электрофилов в реакциях SЕ. Если в ароматическом ядре находится какой-либо заместитель, то он обязательно оказывает влияние на распределение электронной плотности кольца. ЭД – заместители (орентанты 1-го ряда) СН3, ОН, ОR, NН2, NR2 – облегчают замещение по сравнению с незамещенным бензолом и направляют входящую группу в орто- и пара- положение. Если ЭД сильные (О- ОН NН2), то не требуется катализатор. эти реакции протекают в 3 стадии.
N
 Н2 NН2
Н2 NН2
б
 - б- Вr Br
- б- Вr Br
б + б- +
3Вr2 + 3HBr
+ б- +
3Вr2 + 3HBr
б- Вr
ЭА – заместители (II-го рода) затрудняют реакции замещения электрофильного замещения по сравнению с незамещенным бензолом. SЕ идет в более жестких условиях, входящая группа вступает в мета-положение к заместителям II рода относятся:
СООН, SО3Н, СНО, NН3 +NR3
О
C – OН СООН
б+ б+ FcBr3, t
+ Вr2 + НВr
б- б- Br
б+
Реакции SЕ характерны для гетероциклических углеводородов. Пиррол, фуран, тиофен и их производные относятся к π избыточным системам и достаточно легко вступает в реакции SЕ. Они легко галагенируются, алкилируются, ацилируются, сульфируются, нитруются. При выборе реагентов необходимо учитывать их нестабильность в сильнокислотной среде (ацидофобность).
Пиридин и другие гетероциклические системы с пиридиновым атомом азота являются π недостаточными системами, они гораздо труднее вступают в реакции SЕ, при этом входящий электрофил занимает β-положение по отношению к атому азота.
