
- •Часть 1
- •Тема: «Сопряжение, как фактор повышения стабильности молекул. Взаимное влияние атомов в молекулах органических соединений и способы ее передачи»
- •«Взаимное влияние атомов в молекулах органических соединений и способы его передачи».
- •Классификация органических реакций. Реакции элетрофильного присоединения и замещения. Кислотно-основные свойства органических соединений
- •Реакционная способность алкенов, алканов, алкадиенов у аренов и гетероциклических соединений.
- •«Кислотные и основные свойства органических соединений»
- •Нуклеофильные реакции карбонильных соединений
- •Реакции нуклеофильного замещения у sp3 – гибридизированного атома углерода. Реакции отщепления.
- •Поли- и гетерофункциональные соединения
- •Кетонная форма енольная форма
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАБАРДИНО-БАЛКАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Х.М. БЕРБЕКОВА
МЕТОДИЧЕСКИЕ РАЗРАБОТКИ
К ЛЕКЦИОННОМУ КУРСУ
«БИООРГАНИЧЕСКАЯ ХИМИЯ»
Часть 1
Нальчик, 2004
УДК 547
ББК 24.2
Рецензент
доктор биологических наук, профессор,
зав. кафедрой химии
Кабардино-Балкарской государственной сельскохозакадемии
Беев А.А.
Составитель Балаева С.М.
Методические разработки к лекционному курсу «Биоорганическая химия»
Нальчик, Кабардино-Балкарский госуниверситет, 2004
В издании представлен тезисный текст лекций по биоорганической химии, представляющий комплекс основных закономерностей строения и свойств органических соединений. Часть I.
Рекомендовано РиСОМ университета.
УДК 547
ББК 24.2
Кабардино-Балкарский государственный университет
им. Х.М. Бербекова.
2004 г.
ВВЕДЕНИЕ
Биоорганическая химия – наука, изучающая строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций.
Биоорганическая химия основное внимание уделяет строения и реакционной способности биологически значимых соединений. Предметом биоорганической химии являются биополимеры и биорегуляторы и их структурные элементы.
К биополимерам относятся пептиды и белки, полисахариды (углеводы), нуклеиновые кислоты. В эту группу включают липиды, которые не являются ВМС, но в организме обычно связаны с другими биополимерами.
Биорегуляторы – это соединения, которые химически регулируют обмен веществ. К ним относятся витамины, гормоны, многие синтетические соединения, в том числе лекарственные вещества. Биоорганическая химия базируется на идеях и методах органической химии.
Без знания общих закономерностей органической химии, сложно изучение биоорганической химии. Биоорганическая химия тесно связана с биологией, биологической химией, медицинской физикой.
Совокупность реакций, протекающих в условиях организма, называется метаболизмом.
Вещества, образующиеся в процессе метаболизма, называются – метаболитами.
Метаболизм имеет два направления:
Катаболизм – реакции распада сложных молекул на более простые.
Анаболизм - это процесс синтеза сложных молекул из более простых веществ с затратой энергии.
Термин биосинтез применяется по отношению к химической реакции IN VIVO (в организме), IN VITRO (вне организма)
Существуют антиметаболиты - конкуренты метаболитов в биохимических реакциях.
Материалы методического руководства составлены согласно программе по биоорганической химии для студентов медицинских вузов 2000 года ГОУ ВУНМЦ и опираются на методические разработки к лекционному курсу по биоорганической химии I мединститута им. Сеченова И.М., Москва, 2000. Часть I и II.
Тема: «Сопряжение, как фактор повышения стабильности молекул. Взаимное влияние атомов в молекулах органических соединений и способы ее передачи»
План лекции:
Сопряжение и его виды:
, - сопряжение, - сопряжение. Энергия сопряжения. Сопряженные системы с открытой цепью. Витамин А, каротины. Сопряжение в радикалах и ионах.
Сопряженные системы с замкнутой цепью. Ароматичность, критерии ароматичности, гетероциклические ароматические соединения.
Ковалентная связь: неполярные и полярные связи.
Индуктивный и мезомерный эффект. ЭА и ЭД – заместители.
Атомы
в молекулах органических соединениях
соединены ковалентными связями, которые
называются
и
- связями.
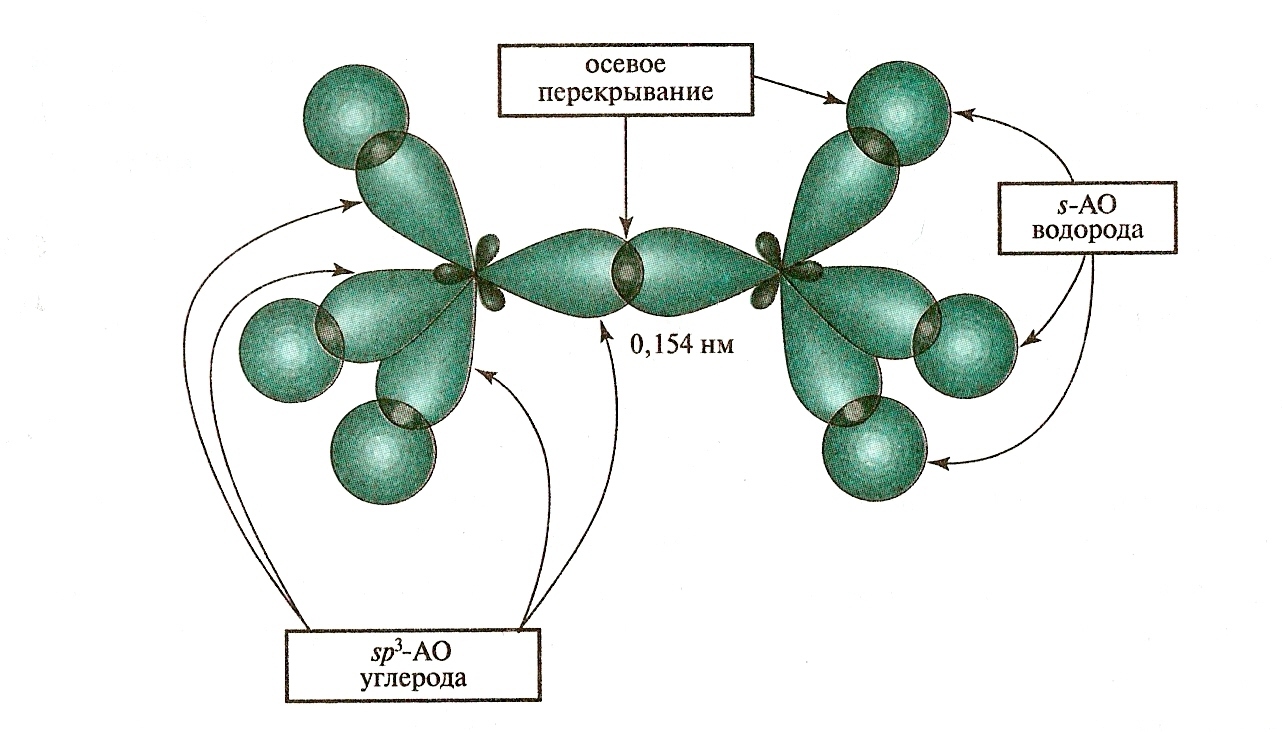
Одинарная - связь находится в SP3 – гибридизованном состоянии, которое характеризуется l – длиной , например длина С-С равна 0,154 нм и энергией равной 83 ккал/моль . Также сигма связь характеризуется полярностью и поляризуемостью. Например
СН = СН
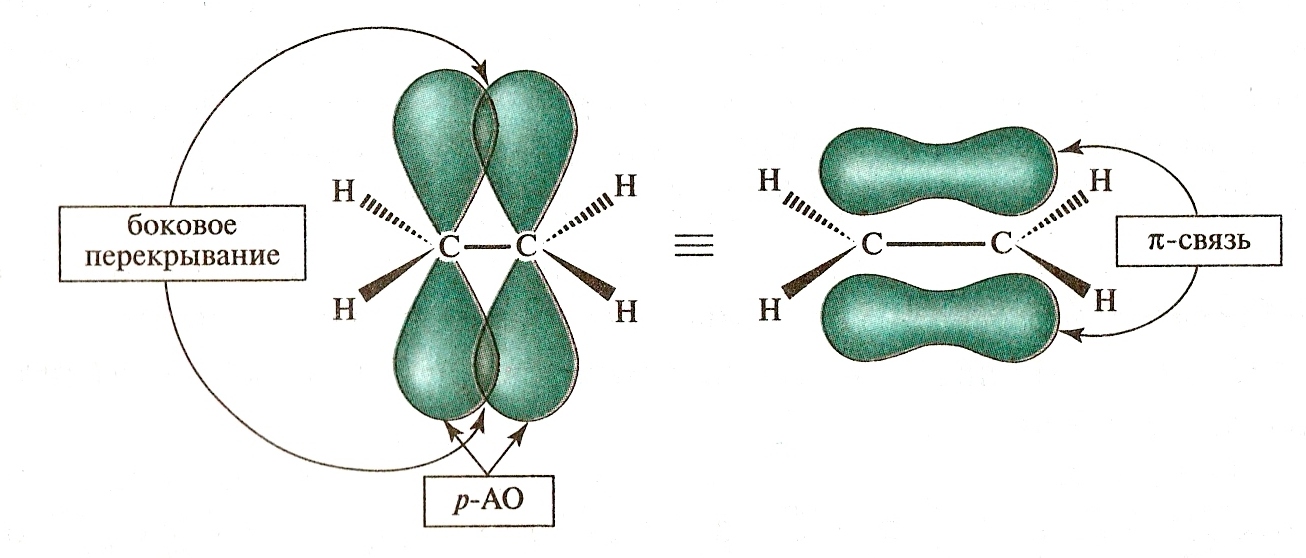
π
Двойная связь характерна ненасыщенным соединениям, в которых, кроме центровой - связи, есть еще связь, которая называется пи - связью.
Двойные связи бывают локализованными, то есть электронная плотность охватывает только 2 ядра связываемых атомов.
Например , в олеиновой кислоте ковалентная связь локализованная.
СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН
Чаще всего мы с вами будем иметь дело с сопряженными системами. Если же двойные связи чередуются с одинарными связями , такие системы называются сопряженными.
Например:
СН2 = СН – СН = СН2
Различают , и , сопряженные системы. Рассмотрим каждую из них.
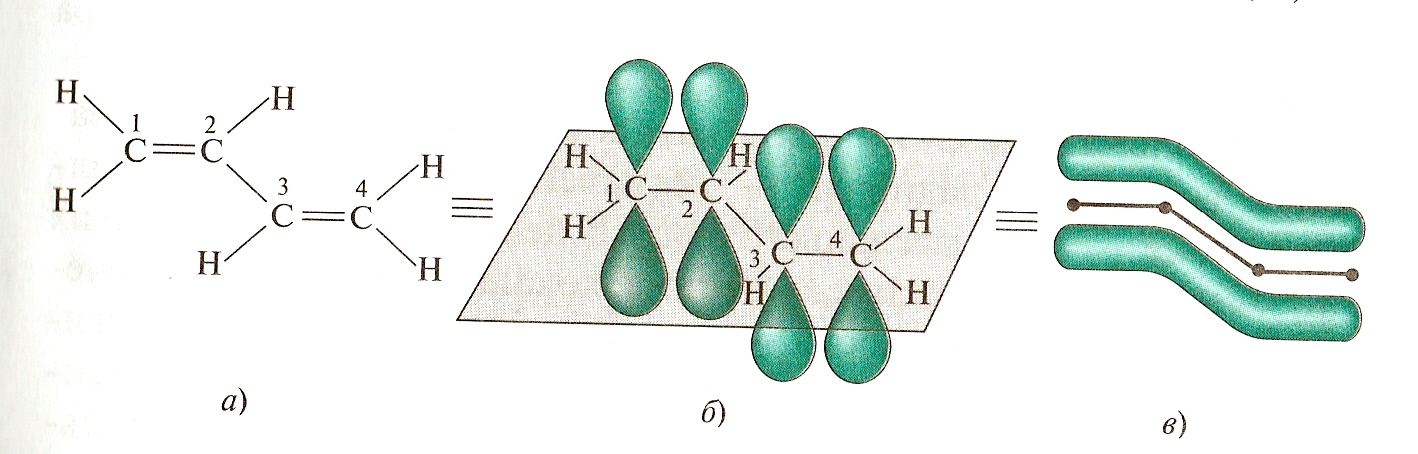
, - сопряженные системы. Простейший пример бутадиен – 1,3. Все атомы в бутадиене находятся в SP2 – гибридизированном состоянии и лежат в одной плоскости . Рz – орбитали параллельны друг другу. Это создает условия их взаимного перекрывания. Перекрывание Рz орбитали происходит между С-1 и С-2 и С-3 и С-4, а также между С-2 и С-3, то есть возникает делокализованная ковалентная связь. Это находит отражение в изменении длин связей в молекуле бутадиена-1.3. Длина связи между С-1 и С-2 увеличена, а между С-2 и С-3 укорочена, по сравнению с одинарной связью.
l- C -С, 154 нм l- С=С = 0,134 нм, l- С=С =0.120 нм
 ,
- сопряженные
системы
,
- сопряженные
системы
Примером р, π сопряженной системы может служить пептидная связь .
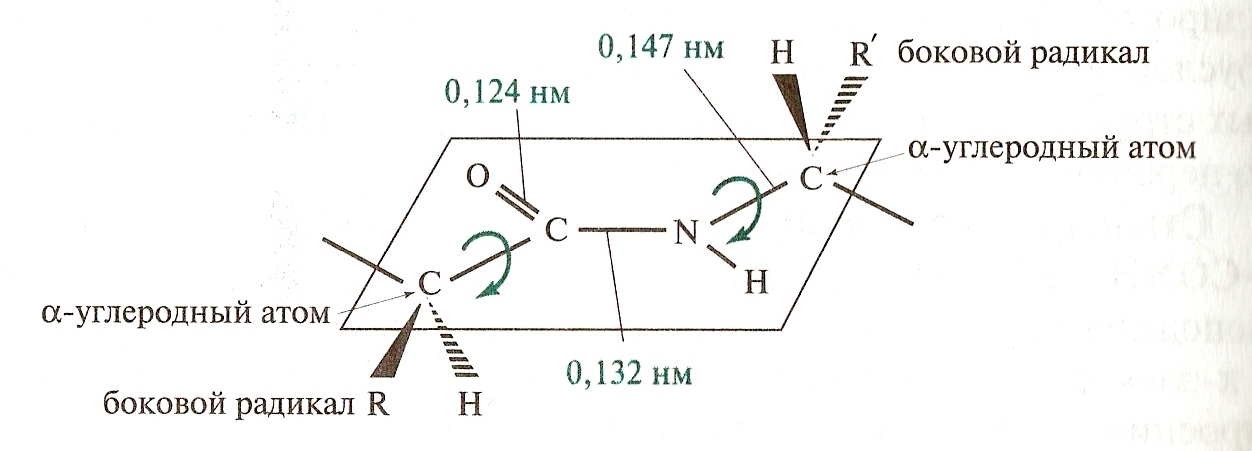
Двойная связь С=0 удлинняется до 0,124 нм против обычной длины 0,121, а связь С – N становится короче и становится равной 0,132 нм по сравнению с 0,147 нм в обычном случае. То есть процесс делокализации электронов приводит к выравниванию длин связей и снижению внутренней энергии молекулы. Однако ρ, – сопряжение возникает в ациклических соединениях, когда чередуется = связи с С- С связями и с гетероатомом:
Н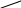
 апример: О О
апример: О О
 СН2
= СН– С СН2 = СН – С
СН2
= СН– С СН2 = СН – С
Н ОН
пропеналь акриловая кислота
Рядом с двойной связью может находиться атом Х, имеющий свободную р- орбиталь. Чаще всего это гетероатомы О,N, S и их р-орбитали, взаимодействуют р-орбитали с - связями, образуя р, - сопряжение.
Например:
СН2 = СН – О – СН = СН2
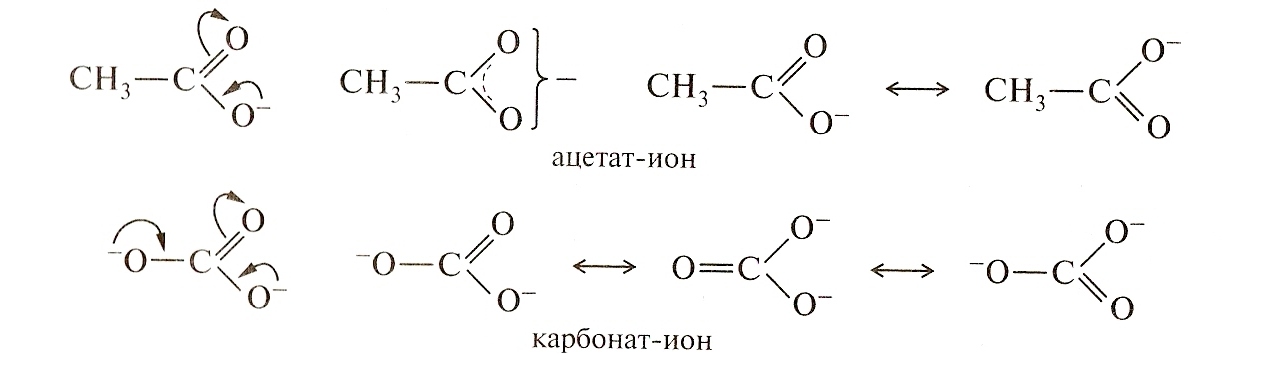
Сопряжение может осуществляться не только в нейтральных молекулах, но и в радикалах и ионах:
Итак, исходя из выше изложенного, в открытых системах сопряжение возникает при следующих условиях:
А) Все атомы, участвующие в сопряженной системе, находятся в SP2 – гибридизованном состоянии.
Б) Р z – орбитали всех атомов перпендикулярны плоскости - связи, то есть параллельны друг другу.
При образовании сопряженной многоцентровой системы происходит выравнивание длин связей. Здесь нет «чистых» одинарных и двойных связей.
Делокализация - электронов в сопряженной системе сопровождается выделением энергии. Система переходит на более низкий энергетический уровень, становится более устойчивой, более стабильной. Так, образование сопряженной системы в случае бутадиена – 1,3 приводит к выбросу энергии в количестве 15 кДж/моль. Именно за счет сопряжения повышается устойчивость радикалов ионов аллильного типа и их распространенность в природе.
Чем длиннее цепь сопряжения, тем больше выброс энергии ее образования.
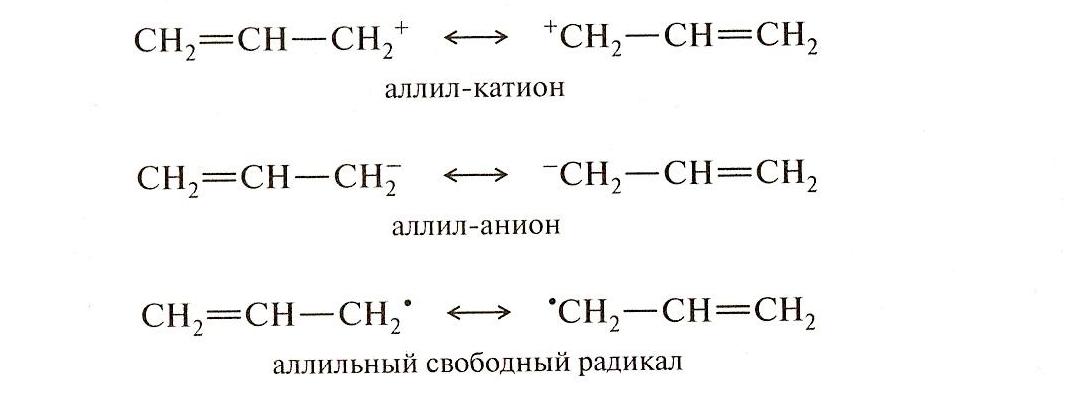
Это явление довольно широко распространено в биологически важных соединениях.
Например:
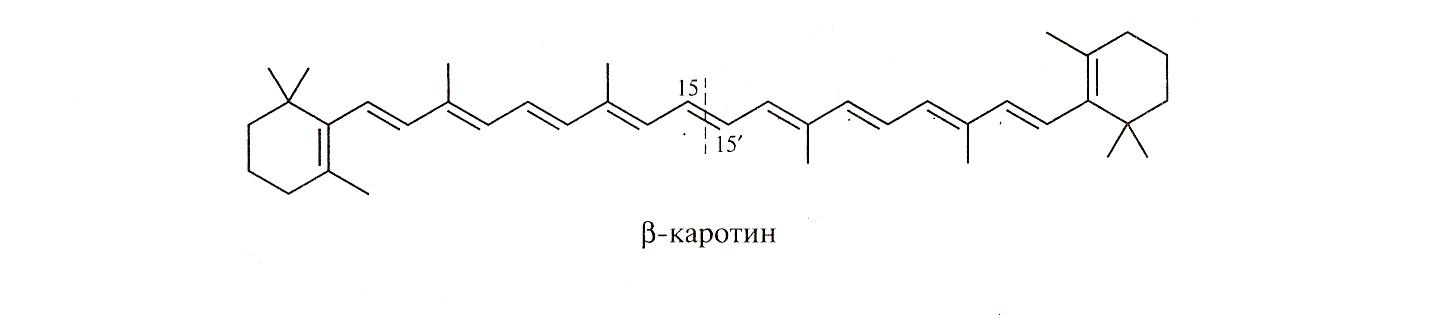
При окислении бета каротинов образуются витамин А и ретиналь.
С вопросами термодинамической устойчивости молекул, ионов, радикалов мы будем постоянно встречаться в курсе биоорганической химии, к которым относятся ряд ионов и молекул широко распространенных в природе..
Сопряженные системы с замкнутой цепью.
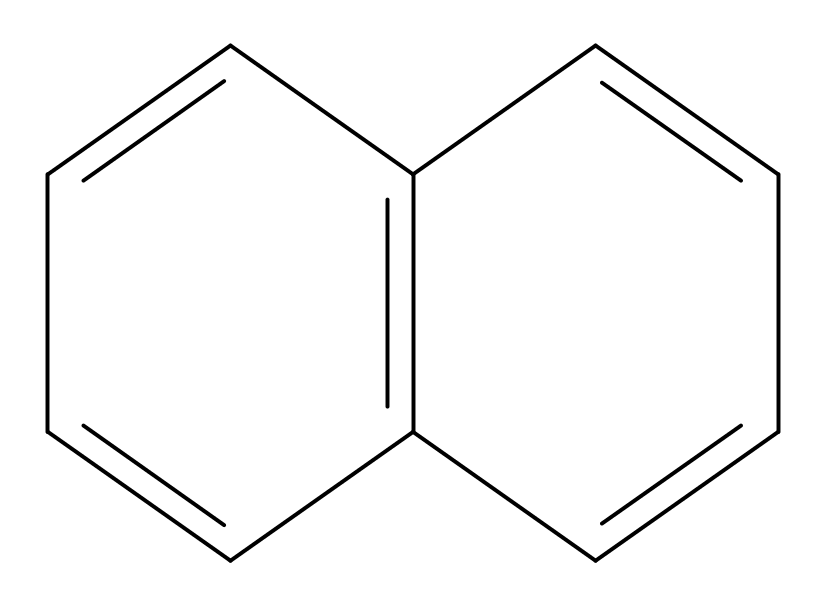
Ароматичность. В циклических молекулах при определенных условиях может возникать сопряженная система. Примером , - сопряженной системы является бензол, где - электронное облако охватывает часть атомов углерода, такая система называется – ароматической.
Выигрыш энергии сопряжения в бензоле составляет 150,6 кДж/моль. Поэтому бензол устойчив термически до температуры 900оС.
Наличие замкнутого электронного кольца доказано с помощью ЯМР. Если молекулу бензола поместить во внешнее магнитное поле, возникает индуктивный кольцевой ток.
Таким образом, критерием ароматичности, сформулированным Хюккелем является:
А) молекула имеет циклическое строение;
Б) все атомы находятся в SP2 – гибридизованном состоянии;
В) существует делокализиванная - электронная система, содержащая 4n + 2 электронов, где n – число циклов.
Например:

Особое место в биоорганической химии занимает вопрос ароматичности гетероциклических соединений.
В циклических молекулах, содержащих гетероатомы (азот, сера, кислород) единое - электронное облако, образуется с участием р – орбиталей атомов углерода и гетероатома.
Пятичленные гетероциклические соединения.
А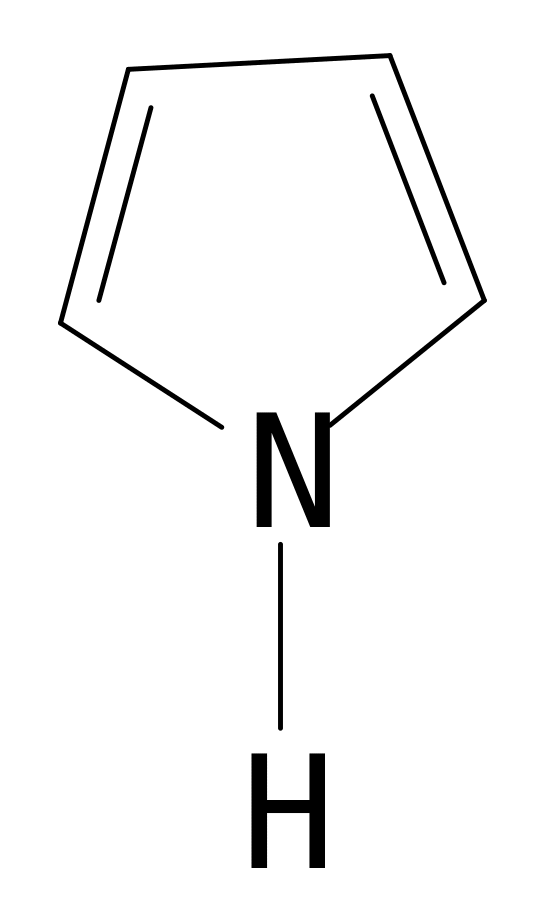 роматическая
система образуется прри взаимодействии
4-х р-орбиталей С и одной орбитали
гетероатома, на котором находится 2
электрона. Шесть
- электронов образуют ароматический
скелет. Такая сопряженная система
является электронноизбыточной. В пирроле
атом N находится в
роматическая
система образуется прри взаимодействии
4-х р-орбиталей С и одной орбитали
гетероатома, на котором находится 2
электрона. Шесть
- электронов образуют ароматический
скелет. Такая сопряженная система
является электронноизбыточной. В пирроле
атом N находится в
SP2 гибридизированном состоянии 1S2 2S2 2р3
Пиррол входит в состав многих биологически
важных веществ. Четыре пиррольных кольца
образует порфин – ароматическую систему с 26 - электронами и высокой энергией сопряжения (840 кДж/моль).
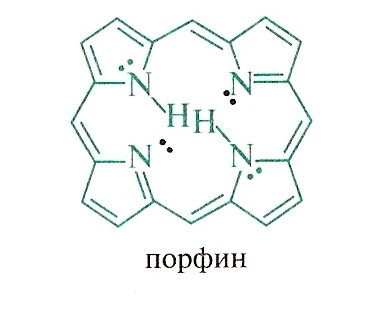
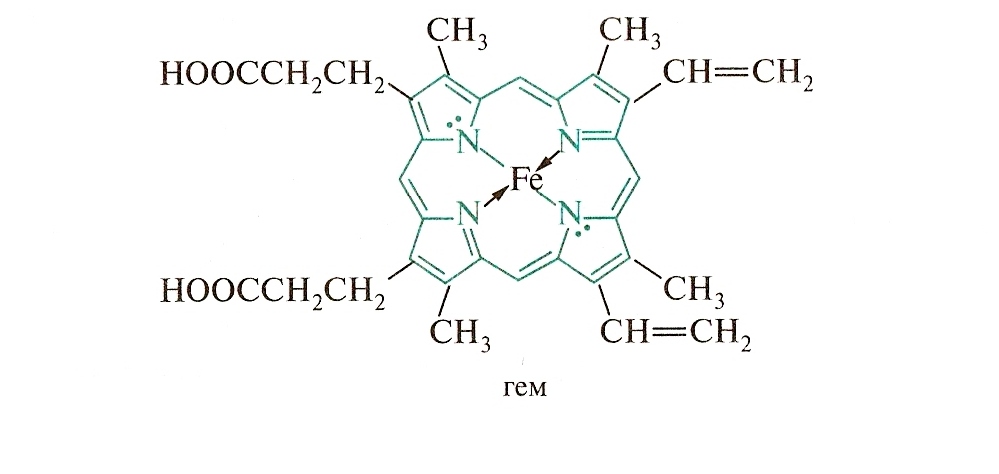
Порфиновая структура входит в состав гемоглобина и хлорофилла.
Шестичленные гетероциклические соединения.
Ароматическая система в молекулах этих соединений образуется при взаимодействии пяти р-орбиталей атомов углерода и одной р-орбитали атома азота. Два электрона на двух SP2 – орбитали участвует в образовании - связей с атомами углерода кольца. Р-орбиталь с одним электроном входит в ароматический скелет. SP2 – орбиталь с неподеленной парой электронов лежит в плоскости - скелета.
Электронная плотность в пиридине смещена к N, то есть система обеднена - электронами, она электронодефицитна.
Гетероциклические соединения могут содержать один и более гетероатомов
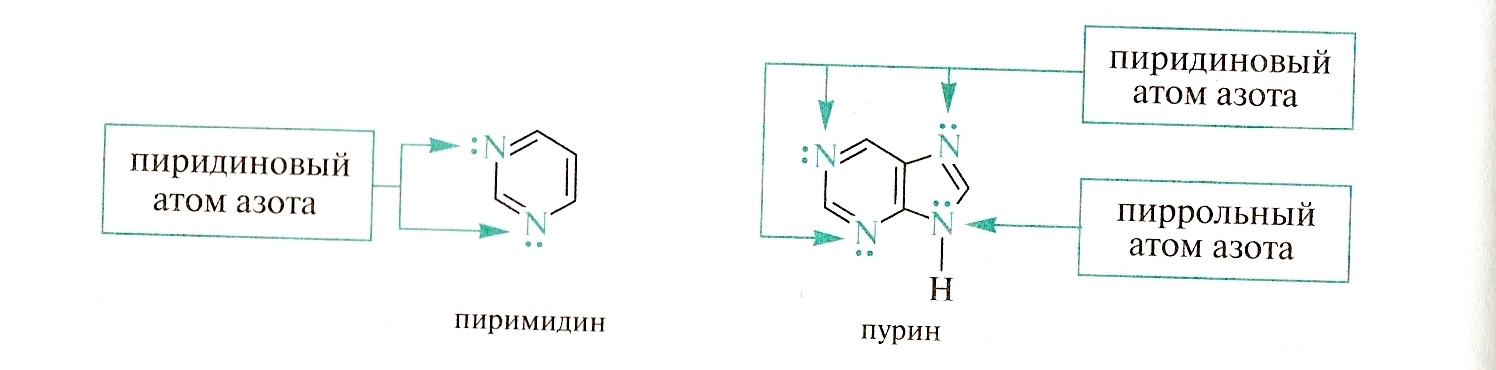
Ядра пиррола, имидазола, пиридина, пиримидина, пурина входят в состав многих биологически активных молекул.
