- •Тема 1. Предмет, задачі та коротка історія біохімії
- •2. Задачі біологічної хімії
- •3. Коротка історія біохімії
- •Тема 2. Структура клітини та хімічний склад організмів
- •Тема 3. Властивості, структура та біологічна роль білків
- •Тема 4. Природа, властивості та класифікація ферментів
- •Тема 5. Загальні уявлення про обмін речовин і енергетичний баланс в організмі. Обмін амінокислот та білків
- •Тема 6. Нуклеїнові кислоти та біосинтез білка
- •Тема 7. Властивості, структура та розповсюдження вуглеводів
- •Тема 8. Обмін вуглеводів в організмі
- •Тема 9. Ліпіди
- •Тема 10. Вітаміни
Тема 3. Властивості, структура та біологічна роль білків
План
Характеристика білків.
Функції білків в організмі.
Властивості білків.
Класифікація білків.
Біологічна цінність білків.
Добова потреба та джерела повноцінних білків.
1. Характеристика білків
Характеристика білків. Білки - високомолекулярні органічні сполуки, побудовані з великої кількості залишків амінокислот. Вони є найбільш важливими в біологічному відношенні і найбільш складними по своїй хімічній структурі сполуками. Білки становлять структурну і функціональну основи усіх живих організмів.
Важлива роль білків життєдіяльності організмів відзначалася ще в першій половині XIX ст. Так, Н. Мульдер у 1838 році назвав їх протеїнами (від грец. proteous - перший, найважливіший). Назва "Б" виникла в зв'язку з тим , що вони за рядом своіх властивостей нагадували яєчний білок. Зараз у біологічній літературі використовуються обидва терміни - білки і протеїни.
2.Функція білків в організмі
Білки в організмі виконують найрізноманітніші функції:
1). Структурна функція - білки в середньому становлять 18-20% загальної сирої маси організму людини та тварин і до 45 -50 % їх сухої маси. Вони беруть участь в утворені структурної основи клітин та їх органел - мембранних структур, мітохондрій, рибосом, цитоплазми. Людині білки необхідні для утворення стінок судин, формування покроєних, м’язових і сполучних тканин організму, вони становлять основу органічної частини кісткової тканини, хрящів, зв'язок і сухожилля.
2). Каталітична функція. Усі ферменти - біологічні каталізатори, що зумовлюють перебіг хімічних реакцій в організмі - білки. Вони є необхідними для життєдіяльності кожного живого організму. За участю ферментів у клітинах одночасно проходить багато різних хімічних реакцій, які забезпечують синтез і розпад різноманітних сполук з досить великою швидкістю і при звичайній температурі й тиску.
3) Гормональна (регуляторна) функція. Значна кількість гормонів також є білками або продуктами їх обміну. Гормони беруть активну участь в регуляції обміну, впливають на проникність клітинних мембран, регулюють активність ферментів, діють на процеси трансляції і транскрипції та інше.
4) Транспортна функція. Для нормальної життєдіяльності кожного організму необхідне постійне забезпечення його органів і тканин поживними речовинами та вилучення продуктів обміну. Ці речовини переносяться з током крові сполуками білкової природи. Так перенесення кисню від легенів до тканин, а в зворотному напрямку вуглекислого газу здійснюється за допомогою складного білка - гемоглобіну Транспорт різних груп ліпідів та жиророзчинних вітамінів до різних органів і тканин здійснюється за допомогою ліпопротеїдів.
5). Захисна функція. Здійснюється в основному за участю білків у-глобулінів, з якими пов'язані імунні реакції організму. Антитіла, які утворюються при несприятливій дії на нього різних факторів (хвороботворних бактерій, вірусів, токсинів) мають білкову природу Зв'язуючись з мікроорганізмами чи токсинами, вони інактивують токсичні продукти. Відомо ряд інших процесів, в яких білки також виконують захисну функцію, наприклад у процесах зсідання крові, оберігаючи організм від надмірної втрати її при різних травмах, тощо.
6). Механічна функція. Білки беруть участь в забезпеченні різних форм механічного руху - скороченні і розслабленні м'язів, роботі внутрішніх органів - серця, легенів, шлунку, тощо. Ці процеси здійснюються за участю таких білків, як міозін, тропоміозін та ряду інших.
7). Енергетична функція. Білки, як і вуглеводи, і ліпіди, є джерелом енергії для організму. При розщепленні 1 г білка виділяється 4 ккал або 16,7 кДж енергії. За рахунок білків організм людини одержує 10-15 % енергії.
3. Властивості білків
Білки - високомолекулярні сполуки. Молекулярна маса білка дуже велика - від кількох тисяч до десятків мільйонів дальтон. Білок - це макромолекула з кількох протомерів, білки - біополімери амінокислот.
Білки - амфотерні поліелектроліти. Білки у водному середовищі подібні до амінокислот, мають властивості амфолітів - в кислому середовище вони реагують як основи, а в лужному - як кислоти. Це зумовлено наявністю вільних груп - СООН та NН2.
Ізоелектрична точка - значення рН середовища, при якому молекула білка містить однакову кількість позитивно і негативно заряджених груп. В ізоелектричній точці білок має найменшу розчинність і легко випадає в осад, а також втрачає здатність рухатися в електричному полі до позитивно чи негативно зарядженого полюса.
Білки - мають властивості утворювати комплекси з металами вуглеводами, ліпідами, тощо.
Білки - утворюють не істинні, а колоїдні розчини, промінь світла, який проходить через такий розчин, стає видимим.
Білкам властиве висолювання - це осадження білків концентрованими розчинами нейтральних солей. Висолювання має зворотний характер - при видаленні з розчину іонів солі білок знову переходить в розчин. Осадження білків органічними розчинниками при низьких температурах має назву зворотного осадження. При доливанні води і відновленні гідратних оболонок білок розчиняється і знову повертається в нативний стан, зберігаючи електрофоретичну рухливість біологічну активність, розчинність та інші властивості, характерні для білків у цьому стані.
Білкам властива певна структура - первинна, вторинна, третинна і четвертинна.
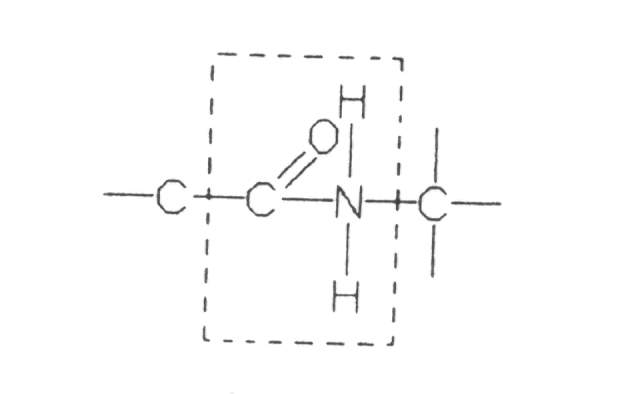
Первинна структура білка - це певна послідовність залишків амінокислот в поліпептидних ланцюгах молекули білка. Вона специфічна для кожного білка і визначається генетичною інформацією, визначає трьохмірну структуру поліпептидних ланцюгів і називається конформацією білка. Білки які мають нормальну конформацію, перебувають у нативному (природному) стані. Амінокислоти поєднані між собою пептидним зв'язком :
|
Вторинна структура білка - просторова конфігурація поліпептидного ланцюга - α-спіралі та β-структури. Стабілізація α-спіралей та (β-структур відбувається за рахунок водневих зв'язків між киснем карбонільної і воднем імунної груп сусідніх завитків поліпептидного ланцюга.
Третинна структура білка - характеризується певною конформацією спіралізованих ділянок поліпептидних ланцюгів у просторі до структури, близької до сфери. Під час формування третинної структури поліпептидні ланцюги укладаються так, щоб максимальна кількість гідрофільних груп залишків амінокислот була розміщена назовні, тобто повернута до водного середовища, а гідрофобні - всередині структури (глобули). На конформацію глобули впливають: рН середовища, іонна сила розчину, температура, взаємодія білкових молекул з іншими речовинами, тощо Важливу роль грають гідрофобні, водневі, дисульфідні та іонні зв'язки.
Четвертинна структура білка - характерна тільки для білків, які складаються з 2-х, 4-х і більшої, в основному парної, кількості індивідуальних поліпептидних ланцюгів з власною третинною структурою Такі поліпептидні ланцюги - протомери, а білки з них – олігомери. Четвертинна структура білка стабілізується і підтримується в нативному стані в основному за участю не ковалентних зв'язків (водневих, іонних або гідрофобних), які утворюються між різними функціональними групами, що знаходяться на поверхні протомерів. При дії на такі білки різних фізичних та хімічних факторів - вони розкидаються (дисоціюють), після зняття дії -з'єднуються, таким чином, процес оборотний.
8) Білкам властива денатурація - білок повністю втрачає свої властивості. Денатурація відбувається під впливом різних факторів:
Фізичних - білки - термолабільні сполуки, і нагрівання розчинів білків вище 50-60° викликає денатурацію: високий тиск: ультразвук: іонізуюче випромінювання; сильне струшування; перемішування в наслідок /творення піни - збивання; промениста енергія;
Хімічних - сильні кислоти, луги, солі важких металів, алкалоїдні реактиви органічні розчинники.
При недовготривалій дії денатуруючого агента білок можна повернути в попередній, нативний, стан - ренатурація.
Оборотну коагуляцію білка зумовлюють солі лужних металів.
4. Класифікація білків
Білки поділяють на глобулярні, які мають кулеподібну або витянуту еліпсовидну форму, і фібрилярні, які мають ниткоподібну форму молекул. До глобулярних належить більшість білків рослинних і тваринних тканин, а також білки лімфи, плазми, сировитки крові, травних соків. До фібрилярних належить білок сполучної тканини, волосся, покривних тканин, м'язів, фіброїн шовку, фібрин крові та ін.
Зараз по фізико-хімічним властивостям білки поділяють на дві групи - прості (протеїни), до складу яких входять лише залишки амінокислот, та складні (протеїди), до складу яких крім залишків амінокислот входять ще й інші компоненти - простетичні групи.
Прості білки поділяють на такі класи: альбуміни, глобуліни, протаміни гістони, проланіни, глутеліни і протеїноїди.
Альбуміни - входять до складу цитоплазми клітин та різних рідин організму - сироватки крові, лімфи, ліквору і становлять більше 50 % плазми крові Альбуміни входять до складу продуктів харчування рослинного та тваринного походження - молока, яєць, зерна злакових і бобових культур
Молекулярна маса альбумінів 35-70 тис. Молекули їх мають еліпсовидну форму, яка більш компактна і симетрична, ніж у глобулінів Альбуміни належать до гідрофільних білків, вони добре розчиняються у воді і розчинах солей. Для їх осадження необхідне 100 %-ве насичення розчинів нейтральними солями, наприклад (NN4)2804.
Альбуміни виконують важливу роль у транспорті різних речовин зокрема тих, які поганорозчинні у воді (ліпіди, тощо). Альбуміни регулюють також вміст у плазмі іонів Са2+, стероїдних гормонів, триптофану, деяких ліків, утворюючи комплекси з цими речовинами.
Глобуліни - входять до складу зерна злаків, насіння соняшника, льону та бобових рослин, а також лактоглобулін (молоко), фібриноген (кров) тощо.
Глобуліни у концентрованих розчинах нейтральних солей не розчиняються. При підвищенні концентрації солей вище 10 % розчинність глобулінів зменшується, а у 50 %-му розчині вони випадають в осад.
Молекулярна маса глобулінів 0,9-1,5 млн. Вони більш грубодисперсні і меньшгідрофільні, ніж альбуміни. Співвідношення між альбумінами і глобулінами (А/Г коефіцієнт) =1,7-2,3.
α-глобуліни - церулоплазмін - містить до 0,34 % Сu.
β-глобуліни - трансферин - транспорт Fе, регулює його концентрацію крові.
• γ-глобуліни - антитіла, які забезпечують імунітет людини. Протаміни - відзначаються високим вмістом діаміномонокарбоно-
вих кислот, тому розчини їх мають лужні властивості. Добре розчиняються у воді і не осаджуються при кип'ятінні.
Значна кількість протамінів входить до складу паренхіматозних органів та залоз внутрішньої секреції, які містять велику кількість ядерної речовини/ У ядрах протаміни утворюють нуклеопротеїдні комплекси.
Гістони - містяться в парехіматозних тканинах, багатих ядрами – печінці, селезінці, нирках, зобній залозі. Значна кількість гістонів міститься в рослинах, Гістони містять до 26 % аргініну (діаміномонокарбонова), 8-10 % лізіну, що зумовлює лужний характер їх розчинів.
Основна маса гістонів входить до складу хромосом ядер клітин, утворюючи комплексну сполуку з ДНК - нуклеогістон, які відіграють важливу роль у стабілізації структури ДНК, а також у процесах синтезу білка оскільки вони входять до складу дезоксирибонуклеотидів ядра.
Проламіни - входять до складу насіння злакових. Мають у своєму складі значну кількість проліну, а також глутамінову кислоту. В них зовсім нема лізіну. Розчиняються у спирту.
Глутеліни - білки рослинного походження, багато їх в зелених частинах рослин та насінні. Мають у складі велику кількість глутамінової кіслоти і лізіну. Погано розчиняються у воді і добре в розбавлених розчинах лугів Молекулярна маса їх коливається в досить широких параметрах.
Протеїноїди - входять до складу тваринних тканин і виконують в основному механічну та опірну функції. Вони не розчиняються у воді, розчинах солей, кислот і лугів. Для них є характерним високий вміст сірковмісних амінокислот. Протеїноїди входять до складу білка волосся рогів, хрящів, покровних тканин, відзначаються високою міцністю і еластичністю. Вони повільно розщеплюються ферментами травного каналу тому погано засвоюються і сприяють процесам гниття у товстому кишечнику.
Колаген - волокнистий фібрилярний білок (до 25 % усіх Б організму). Виконує важливу структурну функцію, є основним компонентом хрящів, сухожилля, зв'язок, шкіри, кісток. При тривалому кип'ятінні у воді колаген гідролізує, утворюючи желатину, яка при охолодженні переходить в гель (про-, глі-, оксипро-, оксиліз-) Утворюється із проколагену і цей процес проходить за участюVit C.
Еластин - входить до складу еластичних тканин і виконує структурну функцію Утворює внутрішні оболонки судин (артерій, вен) (глі-, про-, вал-, лей-). При кип'ятінні у воді желатин, але після тривалої кулінарної обробки може частково розщеплювати гідролітичними ферментами і частково засвоюватися Входить до складу еластичних тканин і виконує структурну функцію.
Складні білки - протеїди складаються з простого білка і сполуки небілкової природи - простатичної групи (від грец prosteto - приєдную, додаю). Залежно від хімічної природи простетичної групи складні білки поділяють на нуклеопротеїди, хромопротеїди, глікопротеїди, металопротеїди, фосфопротеїди і ліпопротеїди.
Нуклеопротеїди - складні білки, простатичною групою яких є нуклеїнові кислоти: РНК - рибонуклеопротеїди, ДНК – дезоксирибонуклеопротеїди, РНП - в цитоплазмі, ДНП - в ядрі. Білкова частина - гістони або протаміни. Нуклеопротеїди виконують важливу роль пов'язану з процесами росту, розвитку, розмноження, передачі спадкових ознак, біосинтезу білка, тощо. Нуклеїнова кислота і білок в нуклеопротеїдах взаємно стабілізуються. Білкова частина з небілковою зв'язані іонним типом зв'язку, який утворюється між катіонами білка і аніонами - нуклеїнових кислот, міжі іонізованими угрупуваннями аргінину поліпептидного ланцюга білка. Білок складає від 30 до 50 %, молекулярна маса - від млн. Розчини їх мають високу в'язкість.
Хромопротеїди - простетична група - забарвлена (каротин, порфірін тощо). Флавоноїди - жовтий, каротин - оранжевий, порфірін + Мg2+ - зелений (хлорофіл); +Сu2+ - синій (кров рака та Інших);+Fе2+ - красний - гемоглобін, міоглобін, гемінові ферменти. Гемоглобін - ~ 94 % сухої маси красних кров'яних тілець - еритроцитів, забезпечує дихальну функцію крові - постачання тканин організму киснем, необхідним для протікання метаболічних процесів, і виділення вуглекислого газу.
Молекулярна маса Нb - 68 тис. Структура Нb була встановлена М. Перутцом на основі ренгеноструктурного аналізу, за що він отримав Нобелівську премію. Молекула Нb складається з двох блоків (по 34 тис ), а ті з α- і β- субодиниць, які поєднані між собою водневими зв'язками, гідрофобними і електростатичними силами. До складу Нb входить чотири геми, які знаходяться на поверхні молекули і вільно зв'язуються з O2, СО2СО, NO, СNS тощо.
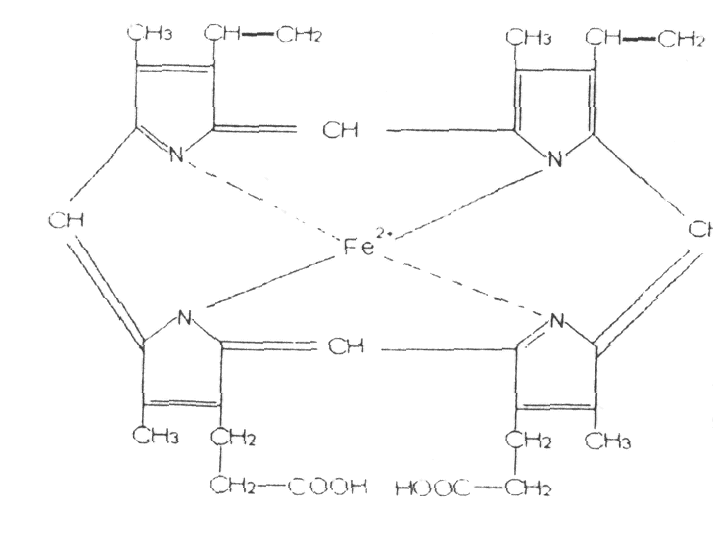
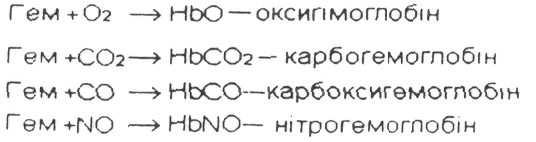
У м'язах міститься міоглобін → глобін + 1 гем. Він приєднує кисень і забезпечує м'язи киснем. У вигляді оксиміоглобіну створює резерв кисню в м'язах ( до 10 %) у стані спокою, а видає при інтенсивній фізичній роботі Чим інтенсивніше працюють м'язи - тим більше там міоглобіну, тим більше вони забарвленні в червоний колір/ Якщо міоглобін запасає 20-45 % кисню, то довго може знаходитись під водою.
Глікопротеїди - простетична група містить залишки вуглеводів та їх похідних.
Істинні глікопротеїди - 0,4-5 % вуглеводів у вигляді аміносахарів та їх похідних - білки сироватки крові, білки молока, яєць, ферменти, гормони. Забезпечують транспорт різних речовин та іонів, забезпечують проникність мембран і міжклітинні взаємодії, специфічні рецепції на поверхні клітин та інше. Мукопротеїди → 5 % аміносахарів та залишків гексуронових кислот і сульфатів. Містяться в різних рідинах і тканинах організму, входять до складу сполучної тканини, різних органів і слизових секретів.
Муцини - слина, слизь шлунку, кишок.
Мукоїди - до сполучної тканини, синовіальної рідини суглобів, хрящів, роговини ока.
Металопротеїди - простетична група Fе, Сu, Сo, Zn, які безпосередньо сполученні з молекулою білка. Це ферменти, які каталізують різні біохімічні процеси; церуплазмин - містить атоми Си (8); ферритин - залізовмісний білок, основна кількість якого знаходиться в печинці, селезінці, кістковому мозку - є головна резервна форма заліза в організмі.
Фосфопротеїди - простетична група - залишки ортофосфорної кислоти - зв'язані складноефірним зв'язком (серин + H3PO4) - функції - входять до складу тканин, які забезпечують ріст і розвиток організму приймають участь в обмінних процесах, білки яйця - овоальбуміни (-70 %) вітелін, вітеленін, фосфовітин - жовток (30 %). Казеїн - білок молока і молочних продуктів - входять усі незамінні амінокислоти, які необхідні для нормального росту і розвитку організму.
Ліпопротеїди - до складу простетичної групи входять ліпіди та їх похідні (тригліцериди, фосфатиди, холестерин, тощо). Вони є основою біологічних мембран і різних органів клітин. Містяться також в різних рідинах організму - крові, лімфі, синовіальній рідині, в нервовій тканині та тканинах внутрішніх органів - нирок, легень, слизовій оболонці шлунка і т.д. Ліпопротеїди - розчин, стабілізація та транспорт ліпідів до різних органів і тканин організму. Ліпопротеїди розчиняються у воді.
5. Біологічна цінність білка. Добова потреба та джерела надходження повноцінних білків
Виходячи з функції білків в організмі людини слід зробити висновок що білки дуже потрібні для нормального розвитку організму та підтримання його життєдіяльності. Білки складаються з 20 амінокислот, але не в усіх білках присутні у достатній для людини кількості. Є 8 незамінних амінокислот (для дітей - 10), які в організмі людини не синтезуються, а мусять поступати з їжею. Продукти рослинного походження мають у своєму складі дуже мало незамінних амінокислот, а продукти тваринного походження - достатню кількість. Білки яйця та молока по амінокислотному "скору" найближче підходять до "ідеального білка" (ФАО/ВООЗ). Тому в харчуванні людини повинні бути присутні як продукти рослинного, так і тваринного походження, які доповнюють один іншого.
Норма білка для здорової людини приблизно 1г/1кг маси тіла за добу. Для дітей, у яких йде інтенсивний зріст організму 1,5-3 г/кг, для людей похилого віку - <0,8 г/кг. Точніше ці норми, в залежності від статі, віку, виду робітничої діяльності та інших факторів ми розглянемо у другій частині нашої дисципліни - "Фізіологія харчування" у другій половині семестру.
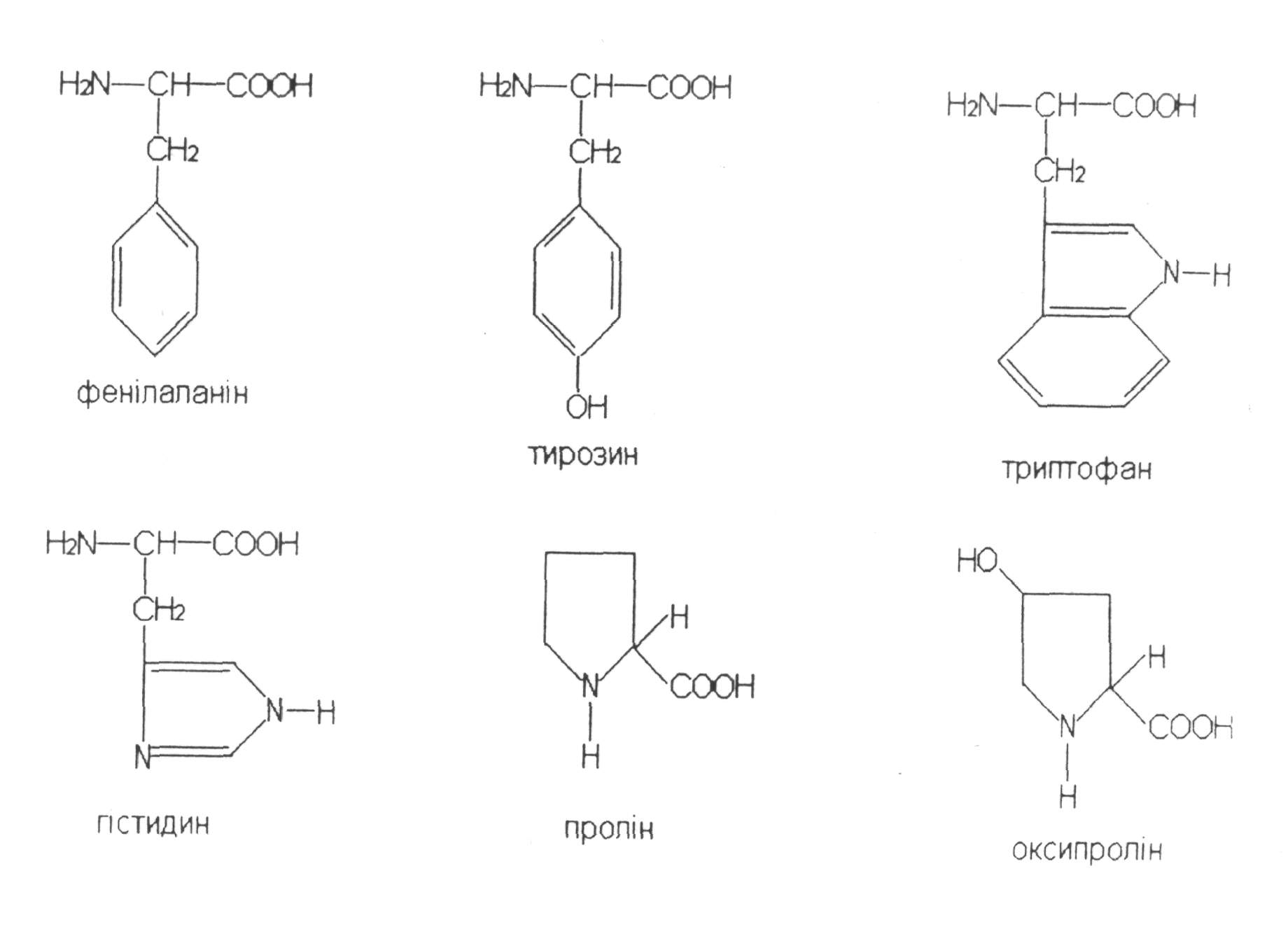
Класифікація амінокислот
3 неполярними |
Незаряджені |
Негативно-заряджені |
Позитивно-заряджені |
радикалами |
полярні радикали |
полярні радикали |
полярні радикали |
Аланін |
Гліцин |
Аспарагінова кислота |
Лізин |
Валін |
Серин |
Глютамінова кислота |
Аргінін |
Лейцин |
Треонін |
|
Гістидин |
Ізолейцин |
Цистеїн |
|
|
Метіонін |
Аспарагін |
|
|
Фенілаланін |
Глутамін |
|
|
Триптофан |
Тирозин |
|
|
Пролін |
|
|
|
Н2N – CН – COOH H2N – CН – COOH Н2N – CН – COOH
| | |
H CH3 CH2–OH
цліцин аланін серин
Н2N – CН – COOH Н2N – CН – COOH Н2N – CН – COOH
| | |
CH2–SH CH2–S–CH3 CH–CH
|
CH3
цистеїн метіонін треонін
Н2N – CН – COOH Н2N – CН – COOH Н2N – CН – COOH
| | |
CH–СH3 CH2 CH–CH3
| | |
CH3 CH–CH3 CH2–CH3
|
CH3
валін лейцин ізолейцин
Н2N – CН – COOH Н2N – CН – COOH Н2N – CН – COOH
| | |
CH2 (CH2)4 (CH2)3
| | |
CООН NH2 NH
|
C=NH
|
NH2
аспарагінова глютамінова аргінін
Н2N – CН – COOH Н2N – CН – COOH
| |
CH2–S–-----------–S– CH2
цистеїн