
- •2. Обзор литературы
- •2.1. Блок-сополимеры этиленоксида и пропиленоксида
- •Фосфатидилхолин
- •1ДК (набор кислот по отношению к основанию 1)
- •3. Постановка задачи
- •4.2. Методы
- •5. Результаты и их обсуждение
- •5.1.1. Изучение солюбилизующей способности мицелл плюроника р85 и Вгу 35 с помощью флуоресцентной спектроскопии
- •Перилен Нафтохинон
- •0 10 20 30 40 (СБридж35-ккм)-1,%-1
- •5.2. Влияние плюроника на транспорт низкомолекулярных соединений через модельные липидные мембраны
- •5.2.2. Влияние плюроника на мембранный транспорт соединений, не обладающих собственной флуоресценцией
- •Гидроксигиппуровая кислота (нна)
- •200 НМ грамицидина а 5 мкМ валиномицина
- •6. Выводы
(а)
д-
90
I
|60
X
н
о
30
• •
▼
О
1 2 3 .4 (СБридж
35-ККМ)
, %-1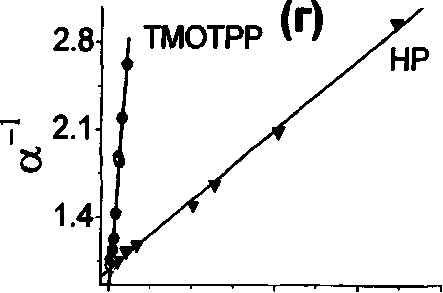
0 10 20 30 40 (СБридж35-ккм)-1,%-1
![]()
! "" 0 |
2 4 6 |
|
СБридж 35-ККМ, % |
О |
|
_Ю 0.88 |
(б) РОХ |
|
▼▼ ▼ ▼ т ▼ |
0.84 |
w |
|
# |
0.80 |
|
|
* |
0.76 |
▼ |
|
0 5 10 15 |
СБридж 35-ККМ,
%
(в)
Р
■ 1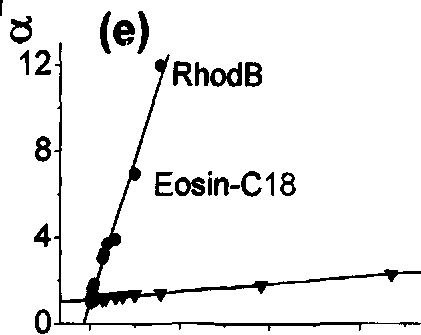
О
75 150 225 -
(СР85-ККМ)"1,
%-1
0.25
0.20
0.15
0.10
I
ГОкхЮ
2 3 СР85-ККМ,
%
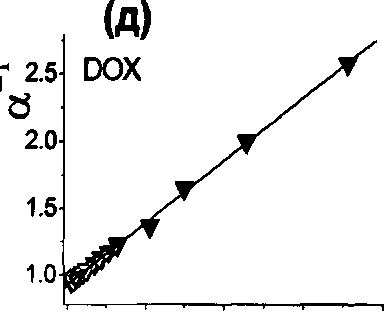
Рис. 10. Зависимость интенсивности флуоресценции (а), отношения флуоресцентных пиков (б) и анизотропии флуоресценции (в) отдельных соединений (указаны на графиках) от концентрации ПАВ. На графиках (г)-(е) показана линеаризация этих зависимостей в двойных обратных координатах в соответствии с уравнением (42).
Значения коэффициентов распределения соединений, определенные
различными методами, хорошо согласуются друг с другом. Так, логарифм
коэффициента распределения доксорубицина между водой и мицеллами плюроника
Р85, определенный по отношению пиков интенсивности флуоресценции был равен
1.49±0.22, по анизотропии флуоресценции 1.62±0.24, а по литературным данным
(кинетика диализа) - 1.17±0.18 [72]. Схожесть результатов, полученных различными
7
7
методами, была также подтверждена для перилена, 5,10,15,20-тетракис (4- нитрофенил) порфирина, 4\5'-дийодфлуоресцеина и эозин карбамотиоевой О- кислоты (Таблица 4). Таким образом, это указывает на корректность использованных методов, базирующихся на чувствительности флуоресцентных характеристик солюбилизуемых соединений к свойствам их микроокружения. Коэффициенты распределения исследуемых соединений представлены в таблице 4:
|
Таблица 4 Коэффициенты распределения соединений. Индексы соответствуют методу определения коэффициента распределения. № |
СОЕДИНЕНИЕ |
lgP±AlgP (Метод) |
|
|
(сокращенное название) |
Р85-вода |
Brij-вода |
|
Ароматические углеводороды и |
их производные |
|
1 |
1,6-Дифенилгексатриен-1,3,5 (DPH) |
|
3.45±0.17(a) |
2 |
Нафталин (Napht) |
2.51±0.22(а) |
3.06±0.26(б) |
3 |
Антрацен (Antr) |
2.46±0.28(а) |
|
4 |
Бенз[а]антрацен (BenzAntr) |
3.43±0.31(а) |
|
5 |
Пирен (Руг) |
3.40±0.24(д) |
|
6 |
Перилен (Per) |
3.31±0.29(а) 3.58±0.24(г) |
|
7 |
Фенол (Phe-OH) |
1.97±0.17(г) |
|
8 |
1,4-Гидрохинон( 1,4-Phe-O) |
1.64±0.18(a) |
|
9 |
1,4-Нафтохинон( 1,4-Napht-O) |
1.43±0.11(a) |
|
10 |
1 -Нафтол( 1 -Napht-OH) |
3.24±0.28(а) |
3.05±0.26(а) |
11 |
2-Нафтол(2-ЫарЫ-ОН) |
3.24±0.26(а) |
|
12 |
1,3-Дигидроксинафталин( 1,3-Napht-OH) |
2.19±0.23(а) |
|
13 |
2,3-Дигидроксинафталин(2,3-КарМ-ОН) |
0.50±0.05(а) |
|
14 |
1,5-Дигидроксинафталин( 1,5-КарМ-ОН) |
2.34±0.25(а) |
2.78±0.22(а) |
15 |
2,7-Дигидроксинафталин (2,7-№рЫ:-ОН) |
2.34±0.22(а) |
2.64±0.18(а) |
16 |
4-Хлор-1-нафтол (С1-парЫ;-ОН) |
3.39±0.22(а) |
|
Ксантеновые красители и их производные |
|||
17 |
Флуоресцеин (Б) |
1.68±0.14(а) |
2.15±0.22(а) |
18 |
4',5'-Дийодфлуоресцеин (1Б) |
2.23±0.23(а) |
2.71±0.21(а) 2.47±0.17(в) |
19 |
5(6)-Карбоксифлуоресцеин (СБ) |
|
2.01±0.30(а) |
20 |
Эозин карбамотиоевая О-кислота (Еозт) |
3.55±0.24(в) |
3.34±0.30(а) 3.74±0.26(в) |
21 |
М-Эозин-К-пропилтиомочевина (Еовт-СЗ) |
4.31±0.35(в) |
4.29±0.34(в) |
22 |
]Ч-Эозин-М'-октилтиомочевина (Еовт-Св) |
4.39±0.46(в) |
4.34±0.45(в) |
23 |
И-Эозин-К'-децилтиомочевина (Еовт-С 10) |
4.61±0.39(в) |
4.87±0.43(в) |
24 |
М-Эозин-К-додецилтиомочевина (Еозт-С 12) |
4.70±0.31(в) |
4.60±0.40(в) |
25 |
К-Эозин-Ы'-октадецилтиомочевина (Еовт-С 18) |
4.37±0.36(в) |
4.87±0.33(в) |
26 |
Родамин В карбамотиоевая О-кислота (ЮкхЮ) |
2.80±0.22(в) |
3.69±0.34(а) |
Антрациклиновые антибиотики |
|||
27 |
Доксорубицин (БОХ) |
1.49±0.13(б) 1.62±0.16(в) 1.17±0.12(г) |
2.33±0.16(б) 2.29±0.13(в) |
28 |
Даунорубицин (БЫМ) |
2.10±0.12(б) |
|
Порфирины |
|||
29 |
.мезо-Тетрафенилпорфирин (ТРР) |
5.78±0.57(а) |
4.21±0.43(а) |
30 |
5,10,15,20-Тетракис (4-аминофенил) порфирин |
4.05±0.41(а) |
4.71±0.41(а) |
(TPP-NH2) |
|||
31 |
5,10,15,20-Тетракис (З-сульфо-4-метоксифенил) порфирин (ТРР-м-803Н,0-0СН3) |
2.07±0.21(а) |
2.96±0.24(а) |
32 |
5,10,15,20-Тетракис (4-метоксифенил) порфирин (ТРР-ОСНз) |
2.20±0.13(а) |
2.16±0.12(а) |
33 |
5,10,15,20-Тетракис (4-нитрофенил) порфирин (ТРР-Ж)2) |
1.78±0.17(а) 1.76±0.26(в) |
1.97±0.19(а) |
34 |
Гематопорфирин IX, тетраметиловый эфир (НР) |
5.74±0.56(в) |
3.36±0.30(а) |
35 |
Протопорфирин IX, диэтиловый эфир (РР) |
2.65±0.20(а) |
2.50±0.17(а) |
36 |
Копропорфирин III, тетраметиловый эфир (СР) |
2.42±0.16(а) |
2.22±0.23(а) |
Соединения, не вошедшие ни в одну из групп |
|||
31 |
Акридин (Асг) |
1.70±0.16(а) |
3.09±0.26(а) |
38 |
М-Ацетил-Ь-тирозин, этиловый эфир (АсТуг) |
1.79±0.17(а) |
|
39 |
Рибофлавин (Ribo) |
1.69±0.15(а) |
3.07±0.26(в) |
Видно, коэффициенты распределения исследованных веществ различаются по величине почти на 7 порядков, т.е. очевидно, что химическая структура солюбилиуемого соединения определяет его взаимодействие с мицеллами ПАВ. Тогда, воспользовавшись набором полученных коэффициентов распределения можно попытаться выявить структурные факторы и молекулярные силы, способствующие солюбилизации низкомолекулярных соединений в мицеллах. При этом сопоставление закономерностей, полученных для различных ПАВ, может также дать информацию о значении структурных особенностей самого мицеллообразующего ПАВ для его солюбилизующей способности. Для этих целей мы использовали подход, основанный на описанном в обзоре литературы методе линейности свободных энергий.
5.1.2. Определение вкладов различных межмолекулярных сил в солюбилизацию низкомолекулярных соединений в мицеллах плюроника Р85 и бл)' 35 с помощью
метода ЛСЭ
Метод линейности свободных энергий (ЛСЭ) является мощным инструментом для определения вкладов взаимодействий различного типа в сложные процессы. Однако корректное применение этого подхода, главным образом, определяется выбором дескрипторов, соответствующих элементарным силам, существенным для данного процесса. В обзоре литературы приводятся критерии подбора дескрипторов для построения корреляционных уравнений. В нашей работе мы использовали описанную выше методологию подбора дескрипторов для описания процессов солюбилизации соединений в мицеллах плюроника Р85 и Вгу-35.
Для описания процессов связанных с сольватацией соединений обычно используются параметры, учитывающие гидрофобные взаимодействия, водородные связи, дипольные взаимодействия и когезионную энергию растворителя. Поэтому для описания солюбилизации в мицеллах исследованных нами ПАВ мы рассмотрели применимость 11 дескрипторов описывающих эти типы взаимодействий. В таблице. 5 показаны значения коэффициентов линейной однопараметрической корреляции рассчитанных нами дескрипторов с экспериментальными величинами \gPp85Zeoda и \%Рвгу 35/вода• Оказалось, что параметр 1%Рош/в обнаруживает наилучшую корреляцию с обоими коэффициентами распределения, хотя соответствующие коэффициенты корреляции существенно отличаются от 1 (0.73 - для плюроника Р85 и 0.53 - для Вгу 35). Близкие по величине коэффициенты корреляции наблюдались также с площадью гидрофобной поверхности веществ (Я =0.71 и 0.52, соответственно). Несколько меньшие, но также значимые коэффициенты однопараметрической корреляции обнаруживают коэффициент распределения между газовой фазой и гексадеканом Ь и макговановкий объем V. Все остальные исследованные нами дескрипторы давали чрезвычайно низкие значения коэффициентов однопараметрической корреляции с экспериментальными значениями коэффициентов распределения.
Таблица. 5.
Коэффициенты корреляции (Л) однопараметрических линейных уравнений, связывающих экспериментальные коэффициенты распределения исследованных
веществ и их рассчитанные молекулярные дескрипторы.
|
^окг/в |
Ь |
ТР8А/40 |
8гфб |
V |
Б |
Е |
А |
В |
пА |
пВ |
1§Рр85/в |
0.73 |
0.50 |
0.06 |
0.71 |
0.51 |
0.37 |
0.55 |
0.01 |
0.13 |
0.13 |
0.02 |
1§Рвгц/в |
0.53 |
0.43 |
0.01 |
0.52 |
0.37 |
0.23 |
0.41 |
0.25 |
0.19 |
0.37 |
0.13 |
Известно, что гидрофобные взаимодействия являются основной движущей силой солюбилизации в мицеллах. На рис. 11 показана однопараметрическая корреляция между 8гфб и коэффициентами распределения исследованных соединений в системе мицеллы плюроника Р85/вода. Аналогичная закономерность наблюдалась при использовании другого параметра, учитывающего гидрофобность - 1 ёРокт/в (данные не показаны). Видно, что закономерный рост коэффициентов распределения мицеллы/вода с ростом величины наблюдался только в рядах структурно сходных соединений, например, ароматических углеводородов и алкильных производных эозина (рис. 11, черные точки). В то же время соединения групп нафтолов и фенолов, ксантеновых красителей и порфиринов этой закономерности не подчиняются (рис. 11, белые точки).
Коэффициенты распределения 1-й 2-нафтола в системе мицеллы плюроника Р85/вода в 5 раз выше коэффициента распределения нафталина (см. таблица 4), хотя эти соединения характеризуются довольно близкими значениями параметра Бф. 4-
хлор-1-нафтол солюбилизуется в мицеллах гораздо эффективнее акридина, хотя
2 '
характеризуется меньше площадью гидрофобной поверхности (8Гфб=3.09 нм и 3.52 нм2; соответственно). Эозин карбамотиоевая кислота характеризуется в 5 раз
о
4 8 12 2
Эгфб, НМ
Рис. 11. Взаимосвязь между площадью гидрофобной поверхности солюбилизуемых соединений и их коэффициентом распределения между мицеллами плюроника Р85 и водой. Цифры на графике соответствуют номерам соединений в таблице 4. Черные точки соответствуют углеводородам и алифатическим производным эозина. Белые точки соответствуют соединениям других групп.
более высоким коэффициентом распределения, чем родамин В карбамотиоевая кислота, хотя площади гидрофобной поверхности этих соединений близки (6.33 и 6.95, соответственно). 1,3-, 1,5-и 2,7-дигидроксинафталины солюбилизуются в мицеллах почти в 4 раза лучше, чем флуоресцеин, хотя площадь гидрофобной поверхности у них почти в 1.5 раза меньше.
Интересно, что аналогичные закономерности для солюбилизации в мицеллах Вгу 35 не наблюдались: пары нафталин и 2-нафтол, родамин и эозин карбамотиоевые кислоты характеризовались одинаковыми коэффициентами распределения, а разница между коэффициентами распределения дигидроксинафталинов и флуоресцеина была значительно меньше, чем случае солюбилизации в мицеллах плюроника (см. таблицу 4).
Таким образом, гидрофобность соединения, учитываемая площадью его гидрофобной поверхности, не является единственным фактором, обусловливающим солюбилизацию в мицеллах плюроника. Мы предположили, что, помимо гидрофобности, существенный вклад в солюбилизацию могут вносить взаимодействия между гетероатомами солюбилизуемых веществ и цепью полимера. Поэтому для построения корреляционных уравнений, помимо Бф надо учитывать дескрипторы, отвечающие взаимодействиям между полярными группами. При этомдолжно выполняться условие независимости, т.е. эти дескрипторы не должны нести информацию о гидрофобности вещества и должны быть взаимно независимы.
Для того чтобы исследовать взаимную зависимость дескрипторов мы рассчитали коэффициенты парной корреляции между ними (таблица 6). Оказалось, что объем V, поляризуемость избыточная мольная рефракция Е и площадь гидрофобной поверхности Бф сильно закоррелированы друг с другом. Поэтому мы сочли невозможным использовать более одного из этих параметров в корреляционных уравнениях. Коэффициент распределения между газовой фазой и гексадеканом Ь обнаруживает значительную корреляцию со всеми остальными дескрипторами, за исключением А. Вследствие этого мы не использовали его в дальнейшем при построении многопараметрических корреляций.
Таблица
6.
Коэффициенты
парной корреляции между исследованными
в работе дескрипторами |
Ь |
ТР8А/40 |
$гфб |
V |
8 |
Е |
А |
В |
пА |
пВ |
||||||||||||||
^ёРокт/в |
0.49 |
0.09 |
0.63 |
0.48 |
0.33 |
0.49 |
0.07 |
0.11 |
0.08 |
0.06 |
||||||||||||||
ь |
|
0.87 |
0.94 |
0.98 |
0.97 |
0.97 |
0.46 |
0.88 |
0.76 |
0.86 |
||||||||||||||
ТР8А/40 |
|
0.74 |
0.85 |
0.92 |
0.81 |
0.60 |
0.94 |
0.82 |
0.98 |
|||||||||||||||
$гфб |
|
0.96 |
0.87 |
0.87 |
0.31 |
0.76 |
0.63 |
0.74 |
||||||||||||||||
V |
|
0.96 |
0.93 |
0.37 |
0.86 |
0.71 |
0.86 |
|||||||||||||||||
|
|
0.96 |
0.46 |
0.88 |
0.76 |
0.91 |
||||||||||||||||||
Е |
|
0.42 |
0.80 |
0.73 |
0.79 |
|||||||||||||||||||
А |
|
0.64 |
0.76 |
0.51 |
||||||||||||||||||||
В |
|
0.51 |
0.93 |
|||||||||||||||||||||
пА |
|
0.76 |
||||||||||||||||||||||
Несмотря на то, что коэффициент взаимной корреляция между Бф и 1 ёРокт/в составляет лишь 0.63, мы сочли нецелесообразным использовать оба эти дескриптора в одном уравнении, поскольку предполагается, что эти параметры в основном учитывают один и тот же тип взаимодействий - гидрофобные силы. То же относится и к парам параметров А и пА, а также - к В и пВ, которые учитывают водородные связи. Поэтому при построении корреляционных уравнений использовался только один из этих дескрипторов.
Параметры А незначительно коррелирует с Эф (11=0.31), в то время как параметры В и пВ обнаруживают более значительную корреляцию с 5гф6 (11=0.76 и 0.74). Можно предположить, что эта взаимная зависимость $гф6 и протоноакцепторной способности объясняется тем, что в исследованном ряду соединений средняя доля гетероатомов, проявляющих способность к образованию водородных связей, почти одинакова. И при этом их количество увеличивается параллельно с ростом размера молекулы, а значит, зависит от объема молекулы (коэффициент корреляции между ¥и В равен 0.86) и При этом лишь небольшая часть этих функциональных групп проявляет значительную протонодонорную способность, которая в исследованном наборе соединений не зависит от размеров молекулы. Поэтому параметр А практически не зависит от
Многопараметрические корреляции между \£РМщеллы/вода и линейной комбинацией различных дескрипторов, отвечающих гидрофобности исследуемых соединений, их полярности и объему мы искали в виде:
^мицеллы I вода ~С0 + X , (37)
г
где Со - это свободный член, г,- - коэффициенты линейного уравнения, показывающие вклады данного типа взаимодействий в сложный процесс, а - молекулярные дескрипторы веществ. Надежность корреляции определяется соотношением между количеством исследованных соединений и количеством дескрипторов, использованных при построении корреляции. Обычно считается, что это соотношение должно превышать, по крайней мере, 5-6. В настоящей работе мы исследовали 2 и 3-параметрические корреляции, используя для их построения данные по 32 соединениям, т.е соотношение количества веществ и дескрипторов составляло 8:1.
Оказалось, что двухпараметрическая корреляция с использованием \%Рокт/в и ТРБА/40 описывает солюбилизацию в мицеллах плюроника с коэффициентом корреляции около 0.8 при достаточно высоком (24) значении критерия Фишера (уравнение (38)). При этом оказалось, что как гидрофобность соединения, так и площадь его полярной поверхности вносят положительные вклады в наблюдаемый в эксперименте коэффициент распределения.
85
1ёРр85/вода=( 1.53±0.27)+(0.27±0.04)-lgPOKr/B +(0.18±0.07)TPSA/40 (38)
N=32, R=0.795, F=24 В то же время не очень высокое значение коэффициента корреляции указывают на то, что использованный набор дескрипторов не позволяет описать весь ансамбль межмолекулярных взаимодействий, принимающих участие в солюбилизации соединений в мицеллах плюроников. Относительно высокое значение свободного члена в этом уравнении свидетельствует о большом вкладе факторов, вообще не учитываемых использованным набором дескрипторов.
Включение объема в данное уравнение существенно увеличило коэффициент корреляции до 0.87 (уравнение (39)). При этом оказалось, что объем соединения способствует его солюбилизации в мицеллах, его гидрофобнодть (lgP0Km/e) вносит вдвое меньший вклад, а вклад площади гидрофильной поверхности даже изменил знак, т.е. стал отрицательным. Однако величина свободного члена при этом почти не изменилась.
№s5/«>aa=(1.41±0.22)+(0.12±0.05)-lgPWe+(0.68±0.18)- Г-(0.38+0. Щ-TPSAW (39)
N=32, R=0.872, F=29
Все три дескриптора, использованные в этом уравнении являются
комплексными, т.е. зависят от многих типов межмолекулярных взаимодействий.
Действительно, lg/>We зависит не только от способности соединения к образованию
гидрофобных взаимодействий с мицеллами, но также зависит от количества
гидрофильных групп в соединении, которые вносят отрицательный вклад в
значение этого параметра [194]. Параметр TPSA/40 определяется суммарной
площадью, занимаемой протонодонорными и протоноакцепторными группами на
поверхности молекулы, а также связан со способностью вещества к диполь-
дипольным взаимодействиям. Наконец, суммарный объем солюбилизуемого 1
вещества в использованном ряду соединений связан с гидрофобностыо соединения,
поскольку именно варьирование размеров неполярных фрагментов молекулы
определяет в основном изменение ее объема. Все эти соображения указывают на то,
что данное корреляционное уравнение не может быть использовано для
исследования природы сил, существенных для солюбилизации соединений в
мицеллах плюроников.
Аналогичной критике может быть подвергнута и корреляция с участием 1 gP0Km/e
в которой параметр TPSA/40 заменяется на комбинацию протонодонорной (А) и
86
протоноакцепторной (В) способностей соединения (уравнение (40)), а также корреляция, в которой протонодонорная и протоноакцепторная способность используютя совместно с объемом (уравнение (41)):
№55/даа«К0.97±0.28)+(0.59±0.29)^+(037±0Л2)-5+(0.35±0.04)-1вР<,км/в (40)
N=32,11=0.85, Р=23 №р85/водаН\ .53±0.26)+(0.51±0.28Ы-(1.30±0.22) 5+( 1.08+0.13)- V (41)
N=32,11=0.845, Р=22 Несмотря на вполне удовлетворительные коэффициенты корреляции, данные зависимости не могут использоваться для физико-химической интерпретации сил, принимающих участие в процессе солюбилизции, вследствие комплексности использованных в этих уравнениях дескрипторов. Помимо этого, обращает на себя внимание и высокое значение свободного члена, в этих уравнениях, свидетельствующее о наличии факторов, неучтенных при построении модели.
Использование площади гидрофобной поверхности Бф в качестве меры способности вещества к образованию гидрофобных взаимодействий дала наилучшие результаты. Оказалось, что при этом коэффициент корреляции увеличивается, а значение свободного члена уменьшается почти в 10 раз по сравнению с четырьмя приведенными выше корреляционными уравнениями (уравнения (38)-(41)). При этом значение критерия Фишера в этом уравнении возрастает почти вдвое, что указывает на большую надежность данной модели.
1^ш/воао=(0.15±0.05)+(0.38±0.11)^-(1.24±0.19)Л+(0.82±0.08)^б (42)
N=32,11=0.903, Б=39 Можно полагать, что, в отличие от других дескрипторов, описывающих способность вещества к образованию гидрофобных взаимодействий, параметр 5гфб не зависит от наличия в молекуле полярных групп и ее дипольного момента. Поэтому этот дескриптор хорошо сочетается в одном корреляционном уравнении с параметрами, учитывающими протоноакцепторную и протонодонорную способность соединений. В пользу его использования говорит также и его ясный физический смысл: согласно известной статистико-термодинамической теории ^тейу и 8сЬега§а, способность вещества к образованию гидрофобных взаимодействий определяется площадью контакта его гидрофобных радикалов с водой [188], а следовательно, площадь гидрофобной поверхности соединени
я
является именно тем фактором, который наиболее полно учитывает его способность к участию в гидрофобных взаимодействиях.
Использование этого же набора дескрипторов для описания солюбилизации в мицеллах лаурилового эфира полиэтиленоксида (Вгу 35) привело к уравнению (43) с коэффициентом корреляции практически таким же, как и в уравнении (42) для плюроника Р85. При этом значение критерия Фишера получившейся корреляции было даже выше, чем в уравнении (42):
1^М^/воа«==(0.43±0.15Н0.0061±0.3)^-(0.27±0.2)-5+(0.48±0.07)-5,г^ (43)
N=45,11=0.896, Б=55 Зависимости
экспериментальных значений 1
%РмиЦеллы/вода
от соответствующих значений,
рассчитываемых по уравнениям (42) и (43)
для плюроника Р85 и Вгу 35, соответственно,
представлены на рис. 12 (а) и (б):
Еозт-С18
расчет
Вгу 35/вода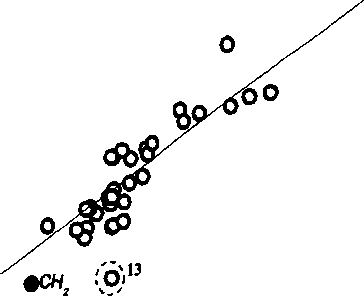
я
5
||4
Л
О-
О.
о)
2
расчет
Р85/вода
•о;
Еовт-С18
О
1
:
О зз зб *
1320^;
Я.ззнекоторые
порфирины
некоторые
порфирины
8
|дР|
1дР
3
б
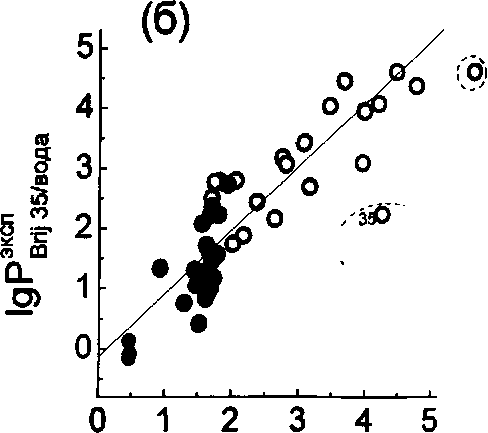
Рис. 12. Корреляция между экспериментально определенными коэффициентами распределения соединений в мицеллы плюроника Р85 (а) и Вгу 35 (б) и величинами, рассчитанными по уравнениям (42) и (43). Номера соединений на графиках соответствуют номерам соединений в табл. 4.
Видно, что из этой зависимости сильно выпадают точки, соответствующие некоторым порфиринам (5,10,15,20-тетракис (4-метоксифенил) порфирин (№32), 5,10,15,20-тетракис (4-нитрофенил) порфирин (№33), диэтиловый эфир протопорфирина IX (№35) и тетраметиловый эфир копропорфирина III (№36)), а также М-эозин-Ы'-октадецилтиомочевине (№25). По всей видимости, эти отклонения вызваны способностью этих соединений к агрегации в водных растворах [200, 201]. Отклонение точки, соответствующей 2,3-дигидроксинафталину (№13), по всей видимости, вызвано тем, что в молекуле этого соединения возможно образование
8
8внутримолекулярной водородной связи между вицинальными гидроксильными группами. В этом случае расчет параметров А и В недостоверен, что и приводит к отклонению коэффициента распределения, рассчитанного по уравнению (42) от экспериментального значения.
Интересно, что корреляционные уравнения (42) и (43) описывают солюбилизацию не только соединений исследованных в нашей работе, но и тех веществ, данные о солюбилизации которых были опублкованы ранее. Так коэффициент распределения метиленовой группы, приведенный в работе [72], удовлетворительно предсказывается уравнением (42) (рис. 12(а)). Черные точки на i рис. 12(6) соответствуют соединениям, исследованным ранее в работе F. Quina с соавторами [202]. В эту группу входят 14 производных бензола, несколько низших жирных кислот, а также кислород, аргон, метан, четыреххлористый углерод и низшие алканы. Несмотря на то, что эти соединения имеют гораздо более простую структуру по сравнению с веществами из нашего набора веществ, их коэффициенты распределения вполне удовлетворительно предсказываются уравнением (43).
Удовлетворительное качество полученных корреляционных уравнений позволяет использовать их для физико-химической интерпретации природы сил, принимающих участие в солюбилизации в мицеллах обоих ПАВ. Большие положительные значения коэффициентов при дескрипторе 8гфб показывают, что среда мицелл плюроника гидрофобнахарактеризуется большей гидрофобностью, чем вода, окружающая мицеллу. Положительный коэффициент при дескрипторе А в уравнении (42) показывает, что гидрофобное ядро мицелл плюроника характеризуется большей Н-основность, чем окружающая мицеллы вода. При этом близкое к 0 значение этого коэффициента в уравнении (43), описывающем солюбилизацию в мицеллах Brij 35 показывает, что этот ПАВ практически не проявляет протоноакцепторных свойств а гидрофильная опушка его мицелл сильно гидратирована [203,204].
О
или![]()
группы
Таким образом, сопоставление уравнений (42) и (43) для плюроника Р85 и Вгу 35 указывает на то, что солюбилизации в мицеллах плюроника способствует образование водородных связей солюбилизуемого соединения с блоком ППО, ' составляющим ядро мицеллы плюроника. Можно предполагать, что пониженная по сравнению с ПЭО гидратация блока ППО, составляющего ядро мицеллы плюроника, а также пониженная, по сравнению с водной средой, диэлектрическая проницаемость, способствуют образованию водородных связей с солюбилизуемыми в мицеллах соединениями.
Роль водородных связей для структурообразования в системах, содержащих полиалкиленоксиды, отмечалась ранее. Так, в работах В.А. Кабанова, В.Ю. Барановского и И.М. Паписова было обнаружено, что полиэтиленоксиды способны образовывать интерполимерные комплексы с поликислотами за счет образования водородных связей с протонированными карбоксильными группами [34, 205]. Аналогичную природу имеют комплексы, образуемые полиэтиленоксидами и гидроксипропил-метилцеллюлозой [206]. Водородные связи полиалкиленоксидов с водой регистрируются с помощью ИК спектроскопии [62] и их существенная роль выявляется при квантово-механическом моделировании взаимодействий полиэтиленоксидов с водой [43].
Таким образом, мы впервые продемонстрировали роль водородных связей во взаимодействие мицелл плюроников с низкомолекулярными соединениями в водной среде. В следующей части работы мы исследуем, насколько существенны протоноакцепторные свойства плюроников для их способности ускорять транспорт низкомолекулярных соединений через липидные мембраны.
