
- •2. Обзор литературы
- •2.1. Блок-сополимеры этиленоксида и пропиленоксида
- •Фосфатидилхолин
- •1ДК (набор кислот по отношению к основанию 1)
- •3. Постановка задачи
- •4.2. Методы
- •5. Результаты и их обсуждение
- •5.1.1. Изучение солюбилизующей способности мицелл плюроника р85 и Вгу 35 с помощью флуоресцентной спектроскопии
- •Перилен Нафтохинон
- •0 10 20 30 40 (СБридж35-ккм)-1,%-1
- •5.2. Влияние плюроника на транспорт низкомолекулярных соединений через модельные липидные мембраны
- •5.2.2. Влияние плюроника на мембранный транспорт соединений, не обладающих собственной флуоресценцией
- •Гидроксигиппуровая кислота (нна)
- •200 НМ грамицидина а 5 мкМ валиномицина
- •6. Выводы
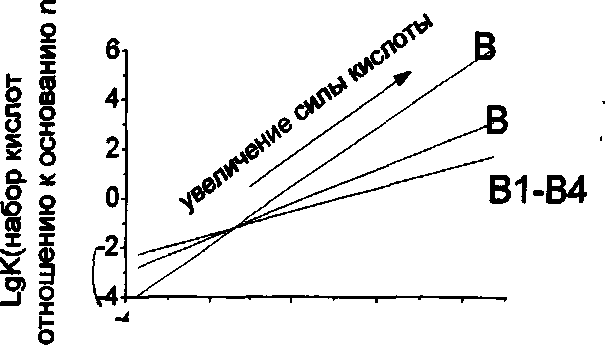
зависит от логарифма константы
комплексообразования тех же кислот с
другим основанием из этого набора.
/
основания
о
Рис.
6. Схематическое изображение графиков
зависимости констант комплексообразования
Н-кислот из базисного набора с одним
из оснований (например, В1) от константы
их комплексообразования с другими
основаниями из эталонного набора
(В2-В4).
1-В2
*
Д
увеличение
1-ВЗ
СИЛЬ|
1-2
0 2 4
1ДК (набор кислот по отношению к основанию 1)
Таким образом, более сильные Н-кислоты образуют более прочные комплексы, связанные водородной связью, однако прочность таких комплексов также зависит и от протоноакцепторной способности основания, что выражается в именении наклона получающихся зависимостей. При этом, как показано схематически на рис. 6, все прямые, полученные для разных пар оснований и всего набора кислот, пересекались в одной точке с координатами (-1.1; -1.1). Это означает, что существуют не зависящие друг от друга параметры, характеризующие протонодонорную способность кислоты и протоноакцепторную способность основания, которые не зависят от природы партнера по водородной связи.
(27)
1 %К. (Н-кислота - основание-эталон В)=ЬВ*\%К" +ИВ,
где ЬвиОв- характеристики основания-эталона, а ^К" - независимая от природы партнера способность Н-кислоты образовать водородную связь. Поскольку константы Ьв и Ив одинаковые для каждого основания, а параметры ^К" - одинаковы для каждой кислоты, использование 589 уравнений позволило однозначно определить все параметры и определить величины ^К" для всех Н
-
кислот. Оказалось, что эти величины варьируют от +3,29 для сильной трифторуксусной кислты до -0.5 для дихлорметана, замещенных фосфортриамидов и производных ацетилена.
Аналогичным образом была получена шкала протоноакцепторной способности Н-оснований. Для этого были определены значения lgK для серии Н- оснований и 34 кислот-эталонов [167]. Так же как и в случае с Н-кислотами, все уравнения проходили через точку —1-1;— 1-Х. Затем независимая от природы донора протоноакцепторную способность Н-оснований lg К % искали из уравнений вида
lgК (Н-основание - кислота-эталон B)=LA*lgК" +DA, (28)
где ЬА и Da~ характеристики кислоты-эталона.
Для получения параметров, удобных для построения корреляций, полученные значения lg К" и lg нормировали таким образом, чтобы для всей шкалы Н- кислот и Н-оснований параметры менялись бы от 0 до 1:
аиг = (log КнА+\.\)14.636 (29)
№ =(log^ +1.1)/4.636, (30)
Полученные параметры а" и ¡3" можно использовать в качестве не зависящих от природы партнера способностей кислот и оснований образовывать водородные связи.
Данные дескрипторы использовались в дальнейшем Abraham с сотрудниками для расширения и уточнения шкалы поляризуемости. Были изучены времена удерживания нескольких сотен соединений в обращено-фазной жидкостной хроматографии. В качестве подвижной фазы использовалась вода, а в качестве неподижной фазы было исселедовано 75 материалов различной природы, не содержащие протонодонорных групп, т.е. не способных к взаимодействию с Н- основаниями (¿=0). Далее исследовалась многопараметрическая корреляция полученных индексов удерживания V0 с набором дескрипторов, включающих коэффициент распределения между газовой фазой и гексадеканом L, избыточную мольную рефракцию Е, поляризуемость л* и Н-кислотность а" [168]:
log V°=IL + еЕ + sn* + аа" + с (31)
Таким образом, был получен набор коэффициентов /, е, s, а и с, которые являлись характеристиками стационарной фазы. Затем авторы фиксировали эти
значения коэффициентов и, используя тот же набор данных, пересчитали обратным образом значения поляризуемости для каждого соединения. Это позволило расширить шкалу поляризуемости на твердые соединения, включая различные биологически активные соединения, для которых прямое определение сольватохромного параметра ж' невозможно. Получнный дескриптор получил название полярности растворенного вещества S. Следует отметить, что для большинства веществ значение параметра S очень близко по величине к л" [169].
В последующих работах Abraham и соавторы изучили обширные данные, касающиеся взаимного расположения функциональных групп в молекуле и влияния ее структуры на проявление свойств отдельных заместителей. Это дало возможность перейти к суммарной Н-кислотности (А) и Н-основности (В), которая являлась суммой структурных констант отдельных групп с учетом природы соединения [170]. При этом параметры An В рассчитываются путем суммирования констант, относящихся к входящим в молекулу функциональным группам.
Вследствие своей надежности и простоты расчета, дескрипторы А и В получили широкое распространение в самых различных приложениях. Например, параметры А и В используются в корреляционных уравнениях, предсказывающих коэффициенты распределения между газовой и конденсированной фазами и индексы удерживания соединений в газожидкостной хроматографии [171,172], критическую концентрацию мицеллообразования (ККМ) анионных и неионогенных ПАВ [173], проницаемость гемато-энцифалического барьера [174] и человеческой кожи [175]. В настоящее время данные дескрипторы можно рассчитать с помощью программного пакета ADME Boxes компании "Sirius Analytical Instruments".
Альтернативный подход к определению шкалы протонодонорных и протоноакцепторных свойств органических соединений был предложен Раевским с соавторами. В отличие от шкалы Abraham, в данном случае в качестве меры способности вещества к образованию водородной связи используется не логарифм константы равновесия образования водородной связи (т.е. величина пропорциональная свободной энергии), а энтальпия образования водородной связи
■
между Н-кислотой и Н-основанием [176].
Для описания водородных связей применяют также топологические 3D- дескрипторы [177]. Остановимся лишь на использованном в настоящей работе дескрипторе топологической площади полярной поверхности TPS А. [178]. Этот дескриптор рассчитывается как сумма вандерваальсовых площадей поверхности атомов кислорода и азота, а также атомов водорода при данных гетероатомах. В отличие от дескрипторов Abraham и Раевского, TPSA отражает суммарную способность соединений участвовать в образовании водородных связей. Данный дескриптор был удачно применен для построения корреляционных уравнений, описывающих проницаемость эпителия тонкого кишечника человека [179] и токсичность алкалоидов с ликоктониновым скелетом [158].
Гидрофобность. За последние 40 лет ни один параметр, используемый в методе ЛСЭ и QSAR не вызывал столько интереса как гидрофобность [180]. Гидрофобные взаимодействия очень важны во многих областях химии. Перечислим лишь малую часть этих направлений: адсорбция, перенос соединений через липидную мембрану, организация липидов в биомембране, коагуляция, мицеллообразование и солюбилизация веществ в мицеллах поверхностно-активных соединений и многие другие [181-185].
Несмотря на повсеместное использование термина "гидрофобное взаимодействие", хорошо известно, что между неполярными соединениями, помимо вандерваальсовых сил, не существует каких-либо сильных взаимодействий [186]. Frank и Evans были первыми исследователями, применившими термодинамическую трактовку к растворению неполярных соединений в воде при комнатной температуре [187]. В соответствие с "айсберговой" моделью, предположенной авторами, при растворении неполярных соединений происходит структурирование воды, окружающей молекулы соединения, что сопровождается значительной потерей энтропии. Статистико-термодинамический расчет, проведенный по этой модели Némethy и Scheraga, позволил развить новую модель "мерцающих" кластеров, в соответствие с которой структурирование воды около неполярной поверхности происходит вследствие образования водородных связей [188].
Стоит также отметить, что не углеводороды "не любят" воду, а вода "не любит" углеводороды. Следовательно, само название "гидрофобные" взаимодействия не корректно.
Для описания гидрофобных взаимодействий наиболее часто используют экспериментальный дескриптор, коэффициент распределения Р соединения между водой и октанолом, получивший широкую известность благодаря обширному объему данных, накопленных в работах Hansch. Коэффицент распределения вещества между октанолом и водой определяют как соотношения мольных долей вещества в окганоле Хокт и воде Хвода, которое соответствует равновесию в двухфазной системе:
P=X0KJXe0da. (32)
Выбор октанола в качестве органического растворителя не случаен [189, 190]. Октанол это достаточно дешевый и доступный растворитель, нетоксичный и обладающий низкой реакционной способностью. Наличие гидроксильной группы в молекуле этого соединения определяет его способность выступать в качестве донора и акцептора протонов при образовании водородных связей с растворенными соединениями, содержащими полярные группы. Это увеличивает растворимость в нем большинства соединений по сравнению с их растворимостью в алканах. Октанол не поглощает УФ свет и имеет достаточно низкое давление паров. К тому же следует отметить, что равновесное насыщение воды октанолом составляет лишь 10'3 М, в то время как октанол содержит 2.3 М воды. Поэтому пренос соединений из воды в октанол не сопровождается их полной дегидратацией. Гидрофобные соединения же при попадании в воду ощутимо не сольватируются небольшим количеством (10 3 М) октанола, например, при lgP=6. Наконец, одна из важнейших причин, широкого распространения октанола в качестве эталонного растворителя при оценке гидрофобности соединений является его близость его сольватирующих свойств к биологическим мембранам [189].
В работе Debolt и Kollman методами молекулярной динамики была исследована система октанол-вода [191]. Авторы получили интересные данные: оказалось, что чистый октанол при 40°С содержит смесь кластеров четырех-, пяти- и шестичленных колец, содержащих ядро из гидроксилов и внешнюю опушку из алкильных радикалов. При насыщении водой эти ассоциаты превращаются в обращено-мицеллярные структуры, которые представляют собой цилиндры с "гидрофильными каналами" внутри. Эти каналы образованы молекулами воды и гидроксилами октанола, а снаружи цилиндров - располагаются алкильные радикалы. Таким образом, насыщенный водой октанол представляет собой структурированную систему, по ряду своих параметров имитирующих некоторые особенности биологических мембран.
Существует множество методов определения коэффициентов распределения, которые делятся на экспериментальные и расчетные. Рассмотрим некоторые их них. Наиболее общий и простой метод состоит в прямом определении концентрации растворенного соединения в водной и октанольной фазах после установления рановесия в системе. Такой способ позволяет определять с высокой точностью коэффициенты распределения, логарифм которых варьирует в интервале от -3 до +6 [192, 193]. Концентрацию вещества в этом случае определяют любым доступным методом, например, с помощью УФ-спектроскопии или хроматографии (газовой или ВЭЖХ).
Коэффициент распределения в системе октанол-вода, как термодинамический равновесный параметр, обладает свойством аддитивности, то есть суммарная гидрофобность молекулы складывается из инкрементов гидрофобности ее частей. В настоящее время накоплены обширные данные по гидрофобности в системе окганол-вода, что дает возможность легко рассчитывать гидрофобность практически любого соединения без выполнения дополнительных экспериментов [194].
Гидрофобность по Ганшу нашла широкое применение в различных биологических применениях, однако данный дескриптор включает в себя многие типы межмолекулярных взаимодействий: дисперсионные, когезионные и водородные связи. \%Р довольно часто используют в качестве эталона, с которым сравнивают тот или иной новый метод расчета дескрипторов. В качестве примера можно привести корреляцию и дескрипторов КатЫ-Тай [141]:
\%Р = 0.32 + 5.35*7100-1.04л-* + 0.35£ -3.84^ +0.10« (33)
п = 245; г = 0.9959; <50 = 0.131, где 8 - параметр, корректирующий поляризапию и численно равен 0 для алифатических соединений, не содержащих хлор, 0.5 для хлорсодержащих
алифатических соединений, 1.0 - для ароматических соединений. Замена сольватохромных дескрипторов Kamlet-Taft на дескрипторы Abraham сопровождается лишь незначительным изменением коэффициентов в корреляционном уравнеии, но не меняет их знаков и соотношения между ними [195]:
lg? = 0.09+ 0.56Я-1.05Я+0.03Л-3.46Я +3.81 Vx (34)
п = 613; г = 0.9975; 5D = 0.116 Таким образом, параметр lgРокт/в является сложным дескриптором, отвечающим не только вандерваальсовым взаимодействиям, но также проявляющим значительную зависимость от объема растворенного вещества и его способности к образованию водородных связей (Н-основности). Поэтому, несмотря на простоту измерения и расчета этого дескриптора, lgРокт/в мало пригоден для построения корреляций с учатсием других параметров, учитывающих объем
вещества и его протоноакцепторную способность.
* * *
'I
60
