
- •Передмовa
- •Тематичний план лекцій
- •Лабораторно-практичні заняття
- •Позааудиторна самостійна робота
- •Література
- •Практичне заняття №1
- •Перша допомога при нещасних випадках в хімічній лабораторії
- •Теоретичні питання
- •Органічні сполуки
- •(Номен)
- •Префікс
- •Функціональна група, крім старшої; радикали
- •Родоначальна структура
- •( Головний вуглецевий ланцюг або цикл)
- •Старша функціональна група; кратний зв’язок
- •Практичне заняття №2
- •10. Складіть рівняння реакцій, зам допомогою яких можна здійснити такі перетворення:
- •Найважливіші поняття та терміни
- •Практичне заняття №3
- •Найважливіші поняття, терміни та правила
- •Практичне заняття №4
- •Найважливіші поняття та терміни
- •Практичне заняття №5
- •11. Здійсніть перектворення та назвіть утворені сполуки. Вкажіть умови, за яких проходять ці реакції:
- •Практичне заняття №7
- •Теоретичні питання
- •Завдання для аудиторної та позааудиторної роботи
- •Практичне заняття №8
- •Вправи та ситуаційні задачі
- •Практичне заняття №10
- •Завдання для аудиторної та позааудиторної роботи
- •Дослід №4. Реакція альдегідів з фуксинсірчистою кислотою.
- •Найважливіші поняття та терміни
- •Практичне заняття №11
- •Практичне заняття №12
- •Теоретичні питання
- •Завдання для аудиторної та позааудиторної роботи
- •Практичне заняття №14
- •Дослід №3. Якісна реакція на цитрат-йон.
- •Контрольні запитання до практикуму
- •Найважливіші терміни та поняття
- •Практичне заняття №15
- •Теоретичні питання
- •Завдання для аудиторної та позааудиторної роботи
- •Практичні завдання
- •Практичне заняття №18
- •Теоретичні питання
- •Вправи для аудиторної та позааудиторної роботи
- •Найважливіші терміни та поняття
- •Практичне заняття №19
- •Дослід №3. Мурексидна проба на кофеїн.
Дослід №3. Якісна реакція на цитрат-йон.
Реактиви: лимонна кислота, конц.H2SO4, баритова вода, I2+KI, 2н р-н NaOH.
Виконання. Помістіть в пробірку з газовідвідною трубкою лимонну кислоту і 2 мл конц. сульфатної кислоти. Кінець трубки опустіть в пробірку з 3-5 краплями баритової води. Коли баритова вода помутніє, підпаліть другий продукт розкладу біля отвору трубки. Продовжуючи нагрівання пробірки, опустіть газовідвідну трубку в приготовлений заздалегідь розчин I2 + KI, знебарвлений кількома краплями лугу. Що ви спостерігаєте? Запишіть схему розкладу лимонної кислоти і схеми реакцій, за допомогою яких визначають продукти розкладу.
Контрольні запитання до практикуму
Яка із солей винної кислоти має кращу розчинність: кисла чи середня? Про наявність яких функціональних груп свідчить утворення двох типів солей?
Про наявність яких функціональних груп у молекулі винної кислоти свідчить реакція з купрум(ІІ) гідроксидом?
Як добувають реактив Фелінга? Для ідентифікації яких класів органічних сполук його використовують?
Як називають солі лимонної кислоти? Наведіть схему розкладу лимонної кислоти при нагріванні в присутності концентрованої сульфатної кислоти.
Яку загальну назву має реакція відкриття ацетону в продуктах розкладу лимонної кислоти? Пригадайте, які сполуки можна відкрити за допомогою цієї реакції.
Найважливіші терміни та поняття
▪Основність гідроксикислоти – число карбоксильних груп.
▪Атомність гідроксикислоти – число гідроксильних груп, включаючи гідроксили, що входять до складу карбоксильних груп.
▪Лактиди – циклічні складні ефіри, що утворюються внаслідок міжмолекулярної дегідратації α-гідроксикислот.
▪Лактони – циклічні складні ефіри, що утворюються внаслідок внутрішньомолекулярної дегідратації γ-, δ-гідроксикислот.
▪Лактати – солі та естери молочної кислоти.
▪Тартрати – солі винної кислоти.
▪Сегнетова сіль – калієво-натрієва сіль винної кислоти:
KOOC–CH–CH–OONa ∙ 4 H2O
| |
OH OH
▪Реактив Фелінга – комплекс яскраво-синього кольору, що утворюється внаслідок взаємодії сегнетової солі з купрум(ІІ) гідроксидом в лужному середовищі.
▪Цитрати – солі лимонної кислоти.
Практичне заняття №15
Тема. Фенолокислоти.
Мета. Сформувати знання про властивості фенолокислот як кислот і ароматичних сполук. За допомогою якісних реакцій оволодіти методикою розрізнення моно-, дикарбонових та гетерофункціональних кислот.
Актуальність. Серед фенолокислот найбільше практичне значення мають саліцилова, галова та о-гідроксикорична кислоти, які містяться у вільному стані або у вигляді складних ефірів у рослинах. Саліцилова кислота міститься в корі верби у вигдяді глікозиду саліцину. Використовується у медицині у вигляді спиртових розчинів і мазей як антисептичний засіб. Є сировиною для одержання таких важливих лікарських засобів як ацетилсаліцилова кислота, натрію саліцилат, метилсаліцилат, салол, оксафенамід. Пара-аміносаліцилова кислота (ПАСК) є протитуберкульозним препаратом. Галова кислота входить до складу дубильних речовин, що містяться в дубовій корі, листі чаю. Водні розчини глікозиду галової кислоти таніну здатні осаджувати білки і застосовуються медицині як кровоспинний засіб при лікуванні опіків. Дерматол (вісмута галат основний) є в’яжучим і антисептичним засобом. Широко розповсюджений у природі кумарин – циклічний складний ефір цис-ізомеру о-гідроксикоричної кислоти. Деякі похідні кумарину мають значну антикоагулюючу дію, тобто зменшують здатність крові зсідатися (препарати «Неодикумарин», «Фепрамарон», «Синкумар»).
Форма роботи. Лабораторно-практичне заняття.
Теоретичні питання
Способи одержання фенолокислот.
Хімічні властивості фенолокислот.
Одержання, характеристика та застосування в медицині похідних саліцилової кислоти: ацетилсаліцилової кислоти (аспірину), натрію саліцилату, фенілсаліцилату (салолу), метилсаліцилату, саліциламіду, оксафенаміду, ПАСК.
►Блок інформації
Синтези на основі саліцилової кислоти
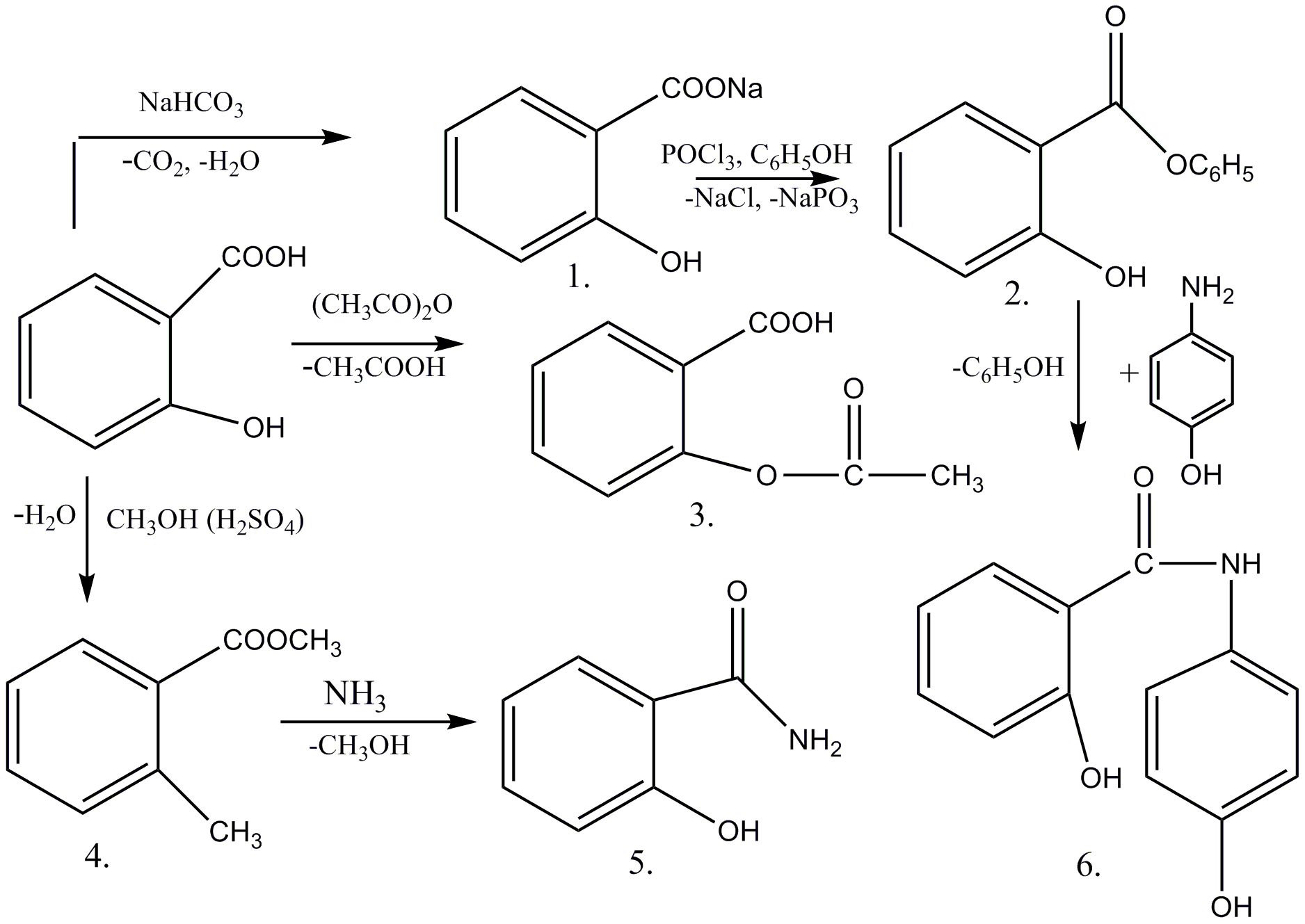
1- саліцилат натрію; 2- фенілсаліцилат (салол); 3 – ацетилсаліцилова кислота (аспірин); 4 – метилсаліцилат; 5 – саліциламід; 6 – оксафенамід.
Завдання для аудиторної та позааудиторної роботи
Напишіть формули таких сполук: а) п-оксибензойна кислота; б) β-фенілпропіонова кислота; в) антранілова кислота; г) фталевий ангідрид; д) саліцилат натрію; е) етилсаліцилат.
Поясніть, чому фенол не взаємодіє з карбонатами (або гідрогенкарбонатами) лужних металів, а саліцилова кислота взаємодіє. Наведіть відповідні рівняння реакцій.
Лабораторний практикум
Вихідний рівень знань
Якісна реакція на фенольний гідроксил – взаємодія з ферум(ІІІ) хлоридом.
Гідроліз складних ефірів.
Дослід №1. Доведення наявності фенольного гідроксилу в саліциловій кислоті.
Реактиви: саліцилова кислота, 0,1н р-н FeCl3.
Виконання. Помістіть в пробірку 1-2 кристалики саліцилової кислоти. Додайте для розчинення 3-4 краплі води і потім 1 краплю 0,1н р-ну FeCl3. Що ви спостерігаєте? Як можна пояснити результат досліду?
Дослід №2. Гідроліз ацетилсаліцилової кислоти.
Реактиви: ацетилсаліцилова кислота, 0,1 н р-н FeCl3.
Виконання. Кілька кристаликів ацетилсаліцилової кислоти розчиніть у 2 мл води. Розчин поділіть на дві частини і одну з них кип’ятіть 2-3 хвилини, потім охолодіть і додайте в кожну пробірку кілька краплин ферум(ІІІ) хлориду. Як можна пояснити зміну кольору розчину в кожній пробірці? Запишіть схему реакції гідролізу аспірину.
Дослід №3. Доказ наявності фенольного гідроксилу в фенілсаліцилаті (салолі).
Реактиви: фенілсаліцилат, етиловий спирт, 0.1н FeCl3
Виконання. Помістіть у пробірку крупинку фенілсаліцилату і добавте для розчинення 2 краплі етилового спирту. До одержаного розчину салолу додайте 1 краплю 0,1н р-ну FeCl3. Що ви спостерігаєте ? Додайте в пробірку 2-3 краплі води. Рідина помутніє і одночасно зникне фіолетове забарвлення. Поясніть явища, що спостерігаєте.
Контрольні запитання до практикуму
Про наявність якої функціональної групи свідчить реакція саліцилової кислоти з ферум(ІІІ) хлоридом? Чи можна з її допомогою відрізнити фенол від саліцилової кислоти?
Чим пояснюється різниця у взаємодії ацетилсаліцилової кислоти з ферум(ІІІ) хлоридом до і після кип’ятіння з водою?
До якого класу органічних сполук відноситься салол? Наведіть схему його взаємодії з водою.
Розвязування експериментальних задач
Запропонуйте план визначення сполук в таких парах:
В-1. Щавлева і лимонна кислоти.
В-2. Щавлева і молочна кислоти.
В-3. Молочна і винна кислоти.
В-4. Бензойна і саліцилова кислоти.
В-5. Саліцилова і бензойна кислоти.
Виконайте експериментально один із варіантів завдання (за вказівкою викладача).
Практичне заняття №16
Тема. Вуглеводи.
Мета. Сформувати знання про будову моно-, оліго- та полісахаридів та їх властивості. Оволодіти методами виявлення функціональних груп вуглеводів за допомогою якісних реакцій.
Актуальність. Вуглеводи – речовини природного та синтетичного походження, які за хімічною структурою є полігідроксильними сполуками, що містять альдегідну або кетонну групу. Вуглеводи складають основну масу органічних речовин нашої планети. Окремі представники моносахаридів знайшли застосування в медицині і фармації. Наприклад, ксилоза є вихідною речовиною в синтезі ксиліту, відновленням глюкози одержують сорбіт. Глюкоза (глюкоза безводна – Державна Фармакопея України, перше видання) є вихідною речовиною в синтезі вітаміну С (кислота аскорбінова – Державна Фармакопея України, перше видання) і глюконату кальцію (кальцію глюконат – Державна Фармакопея України, перше видання), який в медицині використовується у вигляді розчинів для внутрішньовенного введення при гіпоглікемії, інфекційних захворюваннях, є компонентом різних кровозамінників і протишокових рідин. Серед дисахаридів важливими у фармації є лактоза (молочний цукор), яка виявляє низьку гігроскопічність і застосовується для виготовлення порошків і таблеток, а також сахароза, яка застосовується для виготовлення порошків, сиропів, мікстур. Полісахарид крохмаль є основним джерелом вуглеводів у харчовому раціоні людини. У фармації крохмаль використовується у виробництві таблеток, для виготовлення присипок і паст. Здатність утворювати забарвлений комплекс з йодом використовується у фармацевтичному аналізі для відриття йоду та крохмалю. Похідне целюлози колоксилін, який є сумішшю моно- та динітратів, використовується в медицині для виготовлення колодію, яким фіксують пов’язки. Деякі похідні целюлози є пролонгаторами дії ліків.
Форма роботи. Лабораторно-практичне заняття.
