
- •Вопрос 1
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 4.
- •3.Работа гравитационной силы.
- •6. Потенциальные силы
- •8.Связь между потенциальной энергией и силой
- •Вопрос 7.
- •4.Типы движения
- •5.Виды движения
- •6.Законы Кеплера
- •7.Космические скорости
- •Вопрос 8.
- •5.Связь между линейной и угловой скоростью:
- •В опрос 9.
- •Кинетическая энергия вращающегося тела
- •В опрос 10.
- •1.Момент силы
- •2.Работа силы по вращению тела
- •3.Основное уравнение динамики вращательного движения
- •Вопрос 11.
- •1.Закон сохранения механической энергии для твердых тел
- •Вопрос 12.
- •Вопрос 13.
- •1.Неинерциальная система отсчёта
- •3.Определение скорости точки при сложном движении.
- •4.Определение ускорения точки при сложном движении
- •5. Кориолисова сила
- •6. Центробежная сила
- •Вопрос 14.
- •1.Релятивистская механика
- •2.Принцип относительности и законы Ньютона
- •3.Преобразования Галилея
- •Вопрос 15.
- •1.Преобразование Лоренца
- •2.Преобразование скоростей
- •Вопрос 16.
- •Вопрос 17.
- •2.Основные формулы релятивисткой механики:
- •3.Формулы преобразования импульса и энергии:
- •4.Геометрическое представление связи динамических величин:
- •Вопрос 18.
- •Вопрос 19.
- •1 .Пример применения законов сохранения в релятивистской механике: распад нестабильной частицы.
- •2.Определённость величин энергий и импульсов частиц.
- •Вопрос 20.
- •1.Интенсивность теплового движения.
- •2.Температура.
- •3.Хаотичность теплового движения.
- •4.Энтропия.
- •5.Статистический вес и энтропия.
- •Вопрос 21.
- •1.Равновесное состояние.
- •2.Диаграммы состояний.
- •3.Разреженные газы.
- •4.Идеальный газ.
- •5.Природа давления газа.
- •6.Уравнение состояния идеального газа.
- •Вопрос 22
- •1.Механическая форма передачи энергии телу. Работа
- •2.Тепловая форма передачи энергии телу. Теплота
- •3.Первое начало термодинамики
- •Вопрос 23
- •1.Степени свободы молекул
- •2.Закон распределения энергии теплового движения по степеням свободы
- •3.Внутренняя энергия идеального газа
- •Вопрос 24
- •1.Теплоемкость
- •4.Теплоемкость при постоянном объеме
- •5.Теплоемкость при постоянном давлении
- •Вопрос 25.
- •Вопрос 26.
- •Вопрос 27.
- •Вопрос 28.
- •1.Адиабатический процесс в идеальном газе
- •4.Измерение внутренней энергии
- •Вопрос 29.
- •Вопрос 30.
- •2.Барометрическая формула
- •3.Распределение Больцмана
- •4 .Опыт Перрена
- •Вопрос31.
- •Вопрос 32.
- •Вопрос 33.
- •1.Закон о распределении молекул идеального газа по скоростям:
- •Вопрос 34.
- •Вопрос 35.
- •1 Холодильник Рабочее тело .Модель тепловых машин.
- •Нагреватель
- •2.Вечные двигатели I-го и II-го рода.
- •3.Тепловые двигатели, холодильные машины, тепловые насосы.
- •4.Тепловой насос
- •Вопрос 36.
- •3. Неравновесный процесс.
Вопрос 34.
1.Адиабатически изолированная термодинамическая система - система, в которой изменения её состояния могут происходить только благодаря механическим перемещениям частей системы и её оболочки (окружающих тел) и не могут происходить путём теплообмена с окружающими телами. Любое изменение состояния адиабатически изолированной системы называют адиабатическим процессом, а оболочку, окружающую такую систему - адиабатической оболочкой.
Так как при адиабатических процессах δQ = 0, то первое начало термодинамики для них можно записать в форме:
δA = - dU, (1)
Совместное применение этого выражения и уравнения Клапейрона-Менделеева позволяет получить уравнение, описывающее адиабатический процесс в идеальном газе. Для этого представим выражение (1) в виде
PdV = -MCvdT/μ, (2)
Нахождение полных дифференциалов от правой и левой частей уравнения Клапейрона-Менделеева дает:
PdV + VdP = MRdT/μ. (3)
Вычитание из этой формулы выражения (2) приводит его к виду
VdP = MRdT/μ + MCvdT/μ. (4)
С учетом соотношения Майера имеем:
VdP = MCpdT/μ. (5)
Умножим выражение (2) на отношение теплоемкостей γ = Cp/Cv и сложим его с формулой (5). Тогда получим
γPdV + VdP = 0. (6)
Величина γ называется показателем адиабаты. Формулы для теплоемкостей позволяют определить показатель адиабаты через количество степеней свободы i:
γ = (i+2)/i. (7)
Поделив уравнение (6) на произведение PV преобразуем его к виду
γd(lnV) + d(lnP) = 0. (8)
Откуда
PVɣ = const. (9)
Выражение (9) называется уравнением Пуассона в честь французского механика, математика и физика Симеона Дени Пуассона (1781 - 1840). Это уравнение адиабатического процесса для идеального газа, или адиабаты - кривой, описываемой этим уравнением в переменных P и V.
2.Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Существуют несколько эквивалентных формулировок второго начала термодинамики:
3.Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
4.Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
5.В современной термодинамике второе начало термодинамики изолированных систем формулируется единым и самым общим образом как закон возрастания особой функции состояния системы, которую Клаузиус назвал энтропией (S).
Физический смысл энтропии состоит в том, что в случае, когда материальная система находится в полном термодинамическом равновесии, элементарные частицы, из которых состоит эта система, находятся в неуправляемом состоянии и совершают различные случайные хаотические движения.
общее число этих состояний, и есть энтропия.
Энтропия - физическая величина, количественно характеризующая особенности молекулярного строения системы, от которых зависят энергетические преобразования в ней.
3.Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать на основе первого и второго начал термодинамики.
 =>
=>
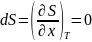 =>
=>

