
- •Основные классы неорганических соединений. Оксиды, основания, кислоты, соли.
- •Донорно-акцепторная связь. Механизм образования донорно-акцепторной связи.
- •Основные способы получения оксидов, оснований, кислот солей. Получение оснований:
- •Получение оксидов
- •Получение кислот
- •Получение солей
- •Металлическая связь.
- •3. Определите массу веществ, выделившихся на золотых электродах в процессе электролиза сульфата меди при силе тока 2 а в течение 40 минут. Составьте уравнения электродных процессов.
- •Валентность. Графические формулы, правила их составления.
- •Скорость гомогенной и гетерогенной химической реакции.
- •3. Определите направление перемещения электронов во внешней цепи следующих гальванических элементов:
- •Виды гидратов оксидов. Кислоты, основания, амфотерные гидроксиды.
- •Влияние концентрации на скорость химической реакции.
- •3. Составьте уравнения возможных реакций:
- •Соли средние, кислые, основные. Особенности строения и свойства.
- •2. Влияние температуры на скорость химической реакции.
- •3. Увеличится или уменьшится масса цинковой пластины при взаимодействии: а) с раствором сульфата меди; б) с раствором нитрата свинца. Ответ обоснуйте, приведя уравнения соответствующих реакций.
- •О сновные положения атомно-молекулярной теории.
- •Катализ. Влияние катализаторов на скорость химической реакции. Механизм гомогенного и гетерогенного катализа.
- •3. Из каких солей, перечисленных ниже, металл может быть вытеснен никелем: нитрат свинца, сульфат алюминия, сульфат меди, нитрат серебра, карбонат цинка, хлорид магния?
- •Основные понятия в химии. Атом, молекула, элемент, атомная масса, молекулярная масса, моль, число Авогадро, молярная масса.
- •Химическое равновесие. Константа равновесия в гомогенных химических реакциях.
- •1. Законы кратных и объемных отношений.
- •2. Влияние концентрации, давления, температуры на состояние
- •3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
- •Закон эквивалентов. Эквивалент, эквивалентная масса. Способы вычисления эквивалентов простых и сложных веществ по формулам.
- •Понятие раствора. Типы растворов.
- •3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
- •Закон Авогадро. Следствия к закону Авогадро.
- •Физическая и химическая теории растворов.
- •Основные сведения о строении атомов. Состав атомных ядер. Основные характеристики протона, нейтрона, электрона. Изотопы.
- •Способы выражения концентрации растворов.
- •3. Вычислите степень окисления подчеркнутых элементов:
- •История развития представлений о сложном строении атома. Катодные лучи, термоэлектронная эмиссия, фотоэффект, рентгеновское излучение, радиоактивность. Модель атома Дж.Томсона.
- •Осмотическое давление. Закон Вант-Гоффа.
- •3. Составьте математические выражения скорости прямой реакции для следующих реакций:
- •Опыт Резерфорда. Гипотеза Резерфорда. Достоинства и недостатки гипотезы Резерфорда о строении атома.
- •Давление насыщенного пара над раствором. Закон Рауля.
- •3. Как изменится скорость прямой и обратной реакции
- •Теория строения атома водорода н.Бора.
- •Температура кипения растворов. Эбулиоскопическая постоянная.
- •3. Как изменится скорость прямой и обратной реакции
- •Основные положения квантовой теории строения атома.
- •2. Температура замерзания растворов. Криоскопическая постоянная.
- •Как изменится скорость реакции при повышении температуры от 20 до 80 oC, если температурный коэффициент реакции равен 2?
- •Квантовые числа. Электронные спектроскопические формулы атомов.
- •Основные положения теории электролитической диссоциации с.Аррениуса.
- •При 100 oC реакция заканчивается за 40 минут. Принимая температурный коэффициент реакции равным 3, определите время протекания этой же реакции при 200оС
- •История открытия Периодического закона д.И.Менделеева.
- •Особенности диссоциации кислот, оснований, солей (средних, кислых, основных).
- •1. Экспериментальное обоснование Периодического закона
- •2. Сильные и слабые электролиты. Степень электролитической диссоциации.
- •3. Как изменится состояние равновесия в системах:
- •1. Закон Мозли. Роль закона Мозли. Современная формулировка Периодического закона.
- •2. Особенности протекания химических реакций в растворах электролитов. Признаки протекания реакций в растворах электролитов.
- •3. Как можно увеличить процентное содержание аммиака в равновесной системе
- •1. Причины периодичности свойств элементов.
- •2. Ионное произведение воды. Водородный показатель (рН).
- •3. Составьте формулы оксидов и гидроксидов следующих элементов:
- •1. Связь свойств элементов, с зарядом ядра, электронным строением атомов и положением в Периодической системе.
- •Гидролиз солей.
- •3. Составьте формулы оксидов, соответствующие следующим гидроксидам: Mn(oh)4, NaOh, h3po4, hpo3. Составьте графические формулы всех соединений.
- •1. Радиус атома. Энергия ионизации. Энергия сродства к электрону. Электроотрицательность. Изменение свойств элементов в зависимости от положения в Периодической системе.
- •2. Понятие окислительно-восстановительной реакции. Типы окислительно-восстановительных реакций.
- •3. Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
- •1. Виды и особенности химической связи.
- •2. Степень окисления . Окислитель. Восстановитель. Процесс окисления. Процесс восстановления.
- •3. Составьте формулы
- •1. Ковалентная связь. Метод валентных связей.
- •2. Метод электронного баланса.
- •3.Сколько сульфида железа должно получиться, если для проведения реакции взяли 8 г серы и 28 граммов железа?
- •1. Метод молекулярных орбиталей.
- •2. Составление уравнений окислительно-восстановительных реакций методом полуреакций.
- •3. Определите простейшую формулу поташа, если массовый состав этого вещества: калия - 56,6%, углерода - 8,7%, кислорода - 34,8%.
- •1. Валентность в ковалентных соединениях. Насыщаемость.
- •2. Физические свойства металлов.
- •При сжигании 1,55 г фосфора получено 3,53 г фосфорного ангидрида. Определите количественный состав фосфорного ангидрида.
- •1. Полярность химической связи. Полярность молекул. Дипольный момент.
- •2. Вытеснительный ряд н.Н.Бекетова. Взаимодействие металлов с растворами солей.
- •3.Вычислите эквиваленты и эквивалентные массы Ag2o, CaHpo4, (CuOh)2co3, h3bo3.
- •1. Направленность химической связи. Гибридизация атомных орбиталей. Строение простейших молекул.
- •2Действие кислот на металлы.
- •3. Вычислите эквивалент и эквивалентную массу ортофосфорной кислоты в реакциях обмена с едким натром, в результате которых образуются нормальная и кислые соли.
- •1. Ионная связь. Механизм образования ионной связи. Свойства ионной связи. Достоинства и недостатки теории ионной связи.
- •2. Действие щелочей на металлы.
- •3. Из 1,4 г кальция получили 2,52 г его сульфида. Определите эквивалентную массу металла.
- •1. Возникновение двойного электрического слоя на границе металл-раствор. Электродный потенциал.
- •2. Сдвиг химического равновесия. Принцип Ле-Шателье.
- •Мышьяк образует два оксида, содержащих 65,2% и 75,7% мышьяка соответственно. Определите эквивалент и эквивалентную массу мышьяка в обоих оксидах.
- •1. Нормальный водородный электрод. Стандартный электродный потенциал. Ряд напряжений металлов.
- •2. Сильные и слабые электролиты. Степень электролитической диссоциации.
- •Литр кислорода весит 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния,эквивалент которого равен 12
- •1. Гальванические элементы. Э.Д.С. Гальванического элемента.
- •2. Ионное произведение воды. Водородный показатель (рН).
- •3. Какой объем при нормальных условиях занимают 1020 молекул газа.
- •1. Концентрационный гальванический элемент.
- •2. Гидролиз солей.
- •Определите количество вещества, содержащегося в:
- •1. Электролиз расплавов электролитов.
- •2. Метод молекулярных орбиталей.
- •3. Вычислите молекулярную массу газа, если 300 мл его при нормальных условиях весят 0,857 г.
- •1. Электролиз водных растворов электролитов с инертным анодом.
- •2. Составьте полную электронную формулу элемента, расположенного в 6-ом периоде, 7-й группе, главной подгруппе.
- •3. Объясните, почему сера и хлор проявляют максимальную степень окисления, равную номеру группы, а кислород и фтор таковой не проявляют.
- •1. Электролиз водных растворов электролитов с активным анодом.
- •3Объясните угловое строение молекул
- •1. Коррозия металлов. Виды коррозии.
- •2. Направленность химической связи. Гибридизация атомных орбиталей. Строение простейших молекул.
- •3. Вычислите массовую долю, моляльную концентрацию и мольную долю хлорида бария в растворе, содержащем 50 г BaCl22h2o в 1000 г воды.
- •1. Контактная коррозия металлов.
- •2. Квантовые числа. Электронные спектроскопические формулы атомов.
- •Вычислите молярность и нормальность 20 %-ного раствора хлорида кальция с плотностью 1,178 г/см3.
- •1. Коррозия под действием блуждающих токов.
- •2. Причины периодичности свойств элементов.
- •3. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде
- •1. Методы защиты металлов от коррозии.
- •2. Гидролиз солей.
- •3. Cоставьте полные ионные и молекулярные уравнения, соответствующие приведенным кратким уравнениям реакций:
- •1. Металлические покрытия.
- •2. Основные положения теории электролитической диссоциации с.Аррениуса.
- •3Составьте уравнения гидролиза Be(no3)2, Rb2s, BaCl2 в молекулярном и ионном виде. Укажите рН среды.
- •Протекторная и катодная защита металлов от коррозии.
- •2. Укажите, какие молекулы из перечисленных имеют угловую форму:
- •40)Покрытия органические и неорганические
Влияние концентрации на скорость химической реакции.
Основной постулат химической кинетики, называемый также законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени: v = k[A]n[B]m, для реакции aA + bB = ... |
Числа n, m в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней n, m называется общим порядком реакции.
3. Составьте уравнения возможных реакций:
1) Zn + H2SO4(разб) ZnSO4 + H2↑
2)Сu + HCl реакция не пойдет так как медь стоит в ряду напряжения металлов после н
3)2Na + 2HCl H2 +2NaCl
4)2Al + 6H2SO4(конц) Al2(so4)3 +3so2 + 6h2o
5)Ag + H2SO4(разб) реакции нет
6)4Mg + 10 HNO3(очень разб) 4Mg(NO3)2 + NH4NO3 + 3H2O
------------------------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
Соли средние, кислые, основные. Особенности строения и свойства.
Средние (нормальные)
соли — все атомы водорода в
молекулах кислоты замещены
на атомы металла.
Пример: ![]() ,
, ![]() .
.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: ,
Основные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками.(CuOH)2 CO3
Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода или другие оксиды ) :
![]()
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
![]()
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменениемстепеней окисления атомов реагентов:
![]()
Некоторые соли разлагаются при нагревании:
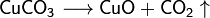
2. Влияние температуры на скорость химической реакции.
Влияние температуры на количество столкновений молекул определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
|
где - температурный коэффициент, принимающий значения от 2 до 4.
3. Увеличится или уменьшится масса цинковой пластины при взаимодействии: а) с раствором сульфата меди; б) с раствором нитрата свинца. Ответ обоснуйте, приведя уравнения соответствующих реакций.
Решение: Электродным потенциалом называют ЭДС гальванического элемента, который составлен из исследуемого электрода, погруженного в раствор его соли с концентрацией ионов металла 1моль/л, и стандартного водородного электрода. Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов, получают ряд стандартных электродных потенциалов металлов. Ряд стандартных электродных потенциалов характеризует химические свойства металлов. Чем меньше алгебраическое значение потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов, поэтому каждый металл в ряду стандартных электродных потенциалов способен вытеснять все следующие за ним металлы из растворов их солей. Сравним потенциалы металлов, заданных по условию задачи:
Металл |
Zn |
Pb |
Cu |
Стандартный потенциал, В |
-0,76 |
-0,13 |
+0,34 |
На
основании потенциалов можно сделать
вывод, что цинк вытеснит из солей медь
и свинец, масса цинковой пластинки
уменьшится.
Уравнения реакций,
соответствующим растворению цинковой
пластинки в растворах сульфата меди и
нитрата свинца:
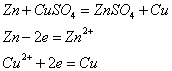
![]()
![]()
-----------------------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 7
