
- •Кинематика материальной точки. Система отсчета. Путь, перемещение, скорость и ускорение. Средние значения.
- •Кинематика криволинейного движения. Тангенциальное и нормальное ускорение.
- •Кинематика вращательного движения. Угловая скорость и угловое ускорение. Связь между угловыми и линейными скоростями и ускорениями
- •Связь линейных и угловых величин:
- •Динамика материальной точки. Первый закон Ньютона. Масса. Сила. Инерциальные системы отсчета.
- •9.Кинетическая и потенциальная энергии. Консервативные и диссипативные силы.
- •10.Полная механическая энергия и закон ее сохранения.
- •11. Абсолютно упругий и неупругий удары.
- •12. Абсолютно твердое тело. Момент инерции. Теорема Штейнера.
- •13. Кинетическая энергия вращения. Плоское движение твердых тел.
- •14. Момент силы. Уравнение динамики вращательного движения твердого тела.
- •15. Момент импульса и закон его сохранения
- •16. Деформации твердого тела. Упругие силы. Закон Гука. Энергия упругой деформации
- •17. Статистический и термодинамический методы исследования. Макроскопические параметры. Уравнение состояния идеального газа.
- •18. Уравнение мкт. Средняя энергия молекулы. Физический смысл температуры.
- •19. Распределение Максвелла. Средние скорости молекул.
- •Средняя длина свободного пробега молекул. Явления переноса в газах.
- •Внутренняя энергия газа. Число степеней свободы молекулы. Первое начало термодинамики.
- •Теплоемкость газов. Применение I начала термодинамики к изопроцессам в идеальном газе.
- •Обратимые и необратимые процессы. Цикл Карно. Кпд тепловой машины.
- •Второе начало термодинамики. Энтропия. Статистический смысл энтропии.
- •26. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
- •Жидкое состояние вещества. Поверхностное натяжение. Капиллярные явления.
- •Твердое состояние вещества. Фазы и фазовые переходы.
Второе начало термодинамики. Энтропия. Статистический смысл энтропии.
Второе начало термодинамики может быть сформулировано несколькими способами. В наиболее очевидной формулировке второе начало гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Более строго, невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики может быть также сформулировано следующим образом: невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества тепла и превращения этого тепла полностью в работу.
Энтропи́я — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния.
Степень упорядоченности системы характеризуется ее энтропией. Поэтому между энтропией состояния и его вероятностью должна существовать определенная зависимость, которую Л. Больцман выразил такой формулой s=kLnpтд, где к — постоянная Больцмана: (k=(R/NA)= 1,37 10-23 Дж К-1 )pтд — термодинамическая вероятность (число возможных микросостояний, которыми может быть реализовано данное макросостояние системы). Таким образом, естественный ход энергетических превращений в изолированной системе переводит ее из состояния с меньшей энтропией в состояние с большей энтропией. Такое изменение энтропии отображает диссипацию энергии. Это положение более строго сформулировано во втором начале термодинамики.
26. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости
между его параметрами показывают, что
молекулы в реальном газе взаимодействуют
между собой и занимают определенный
объём. Состояние реального газа часто
на практике описывается обобщённым
уравнением Менделеева — Клапейрона:
![]() где
p — давление; V — объем T —
температура; Zr =
Zr (p,T) — коэффициент
сжимаемости газа; m — масса; М — молярная
масса; R — газовая постоянная.
где
p — давление; V — объем T —
температура; Zr =
Zr (p,T) — коэффициент
сжимаемости газа; m — масса; М — молярная
масса; R — газовая постоянная.
Уравнение Ван-дер-Ваальса - термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа
Ван-дер-Ваальса оно имеет вид:
![]() где
— давление,
где
— давление,
![]() — молярный
объём,
—
абсолютная температура,
— универсальная
газовая постоянная.
— молярный
объём,
—
абсолютная температура,
— универсальная
газовая постоянная.
Видно,
что это уравнение фактически
является уравнением
состояния идеального газа с
двумя поправками. Поправка ![]() учитывает
силы притяжения между молекулами
(давление на стенку уменьшается, так
как есть силы, втягивающие молекулы
приграничного слоя внутрь), поправка
учитывает
силы притяжения между молекулами
(давление на стенку уменьшается, так
как есть силы, втягивающие молекулы
приграничного слоя внутрь), поправка ![]() —
объем молекул газа.
—
объем молекул газа.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:![]() где
где![]() — объём,
— объём,
Ван-дер-ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль.
Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов (газ, жидкость и твёрдые тела).
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами.
Изотермы
Ван–дер–ВаальсаУравнение
Ван–дер–Ваальса (6.4.3) после несложных
преобразований можно представить в
виде уравнения третьей степени
относительно объёма:
![]() .
(6.4.4)Это уравнение имеет три корня, т.е.
при данных значениях температуры и
давления могут быть три значения
молярного объёма или три значения
плотности газа. Корни могут либо все
три вещественные, либо два из них мнимые
и один – вещественный. Физический смысл
имеют лишь вещественные положительные
корни, поэтому мнимые корни не будем
рассматривать. Чтобы выяснить значение
корней уравнения Ван-дер-Ваальса,
рассмотрим изотермы уравнения (6.4.3)
(рисунок 6.4.1) и сравним их с экспериментальными
изотермами (рисунок 6.4.2).
.
(6.4.4)Это уравнение имеет три корня, т.е.
при данных значениях температуры и
давления могут быть три значения
молярного объёма или три значения
плотности газа. Корни могут либо все
три вещественные, либо два из них мнимые
и один – вещественный. Физический смысл
имеют лишь вещественные положительные
корни, поэтому мнимые корни не будем
рассматривать. Чтобы выяснить значение
корней уравнения Ван-дер-Ваальса,
рассмотрим изотермы уравнения (6.4.3)
(рисунок 6.4.1) и сравним их с экспериментальными
изотермами (рисунок 6.4.2).
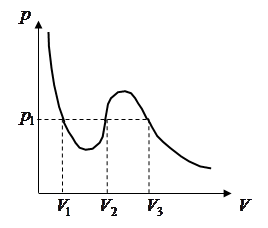 Рисунок 6.4.1 – Изотермы Ван-дер-Ваальса
(решение уравнения 6.4.4)
Рисунок 6.4.1 – Изотермы Ван-дер-Ваальса
(решение уравнения 6.4.4)
