
- •План лекции
- •Краткая историческая справка
- •3. Стратегии коррекции генетических дефектов
- •Стратегия вставки здорового гена в клетки, дефектные по этому гену при рецессивных наследственных болезнях
- •Стратегия подавления нежелательной функции гена внутри клетки
- •Стратегия усиления иммунного ответа
- •Генно-терапевтические подходы к лечению наследственных болезней
- •Генная терапия приобретённых болезней
- •Ex vivo терапия рака
- •Итоги и перспективы
Ex vivo терапия рака
Противоопухолевые «вакцины».
Иммунная система охраняет от любых изменений в нашем внутреннем содержимом. Особенно эффективно она это делает при вторжении в организм вирусов или бактерий. Но она поразительно беспомощна, когда речь касается раковых клеток, хотя эти клетки несут антигены, не свойственные нормальному организму. Уже более 40 лет тому назад было показано, что многие опухоли иммуногенны. Но до появления генно-инженерных методов трансформации эукариотических клеток все попытки в этом направлении оказались тщетными. По каким-то причинам цитотоксические Т-лимфоциты не возбуждаются при виде раковых клеток и их специфических антигенов и не начинают секретировать цитокины, которые они секретируют при встрече с чужими антигенами. Одной из стратегий борьбы с опухолям могла бы стать стратегия, направленная на стимулирование иммунной системы к узнаванию опухолевых клеток. Многие группы учёных пытаются развивать терапию, использующую создание индивидуальных противоопухолевых вакцин. Это можно было бы воплотить в жизнь по схеме, показанной на Рис 16. Клетки, полученные из опухоли больного, выращивают как культуру клеток, и внедряют в них гены, кодирующие белки-иммуностимуляторы, — например, цитокины. Затем эти клетки облучают, чтобы сделать их неактивными, и вводят обратно пациенту в надежде вызвать системный иммунный ответ, который, с одной стороны, призван уничтожить уже существующие опухолевые клетки, а с другой, предохранить пациента от возникновения новых опухолей данного типа. Это основывается на гипотезе, что повышение концентрации цитокинов в непосредственной близости к опухолевым клеткам будет стимулировать ближайшие к ним Т-клетки к иммунному ответу. Действительно, такие стимуляторные эффекты наблюдались у опытных животных и наблюдаются у пациентов, позволивших подвергнуть себя такой терапии. При этом надеются также, что модифицированные клетки вызовут иммунный ответ и против немодифицированных опухолевых клеток.
Рисунок 16. Иммунизация противораковой вакциной, сконструированной из опухолевых клеток, секретирующих гранулоцит-макрофаг колониестимулирующий фактор.
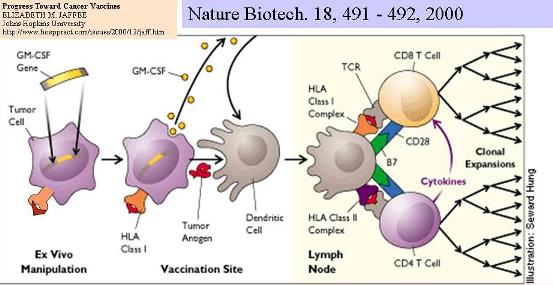
Как всегда, начали на мышах. Клетки опухолей у опытных животных трансформировали генами таких иммуномодуляторов, как цитокины: IL1b, IL-2, IL-4, IL-6, TNFa, GM-CSF, g-интерферон. Действительно, наблюдали, что опухоли у животных, которым вводили модифицированные таким образом клетки этой же опухоли, деградировали. Более того, во многих случаях животные, получившие дозу таких трансдуцированных клеток, становились невосприимчивыми к опухолям при введении опухолевых нетрансдуцированных клеток. То есть, трансдуцированные клетки реально действовали как противоопухолевые вакцины. Это давало основания начать испытания подобных подходов на людях. Пытались включать те же гены иммуностимуляторов с помощью ретровирусных векторов в клетки меланомы, различных карцином, нейробластомы, рака молочной железы.
Ещё один подход к созданию противораковых индивидуальных вакцин показан на Рис. 17—18. Они дают весьма упрощённую схему взаимодействий, которые происходят при узнавании чужих антигенов клетками иммунной системы.
Рисунок 17. Процесс узнавания опухолевых антигенов клетками иммунной системы.
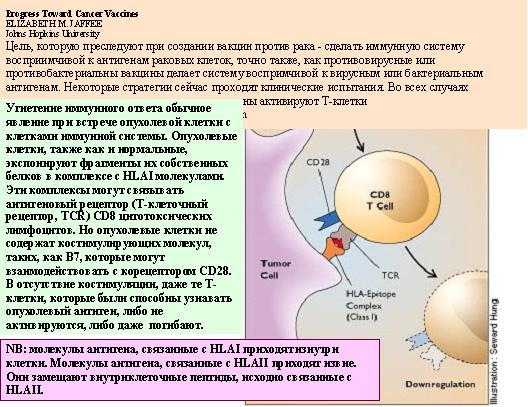
Рисунок 18. Вакцинация, гибель опухолевых клеток.
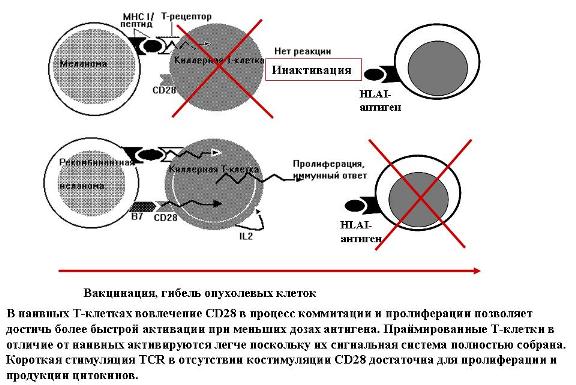
Клетки опухолей, в частности меланомы, представляют специфические опухолевые антигены в виде пептидов, экспонированных на поверхность клеток в виде комплексов с белками главного комплекса гистосовместимости первого типа MHC1. Опухолевые антигены узнаются, как обычно, Т-киллерными клетками или цитотоксическими Т-лимфоцитами. Однако для развития полного иммунного ответа нужно дополнительное взаимодействие ещё одной молекулы на поверхности антигенпредставляющей клетки, костимуляторной молекулы класса В7, и молекулы рецептора, выставленной на поверхность Т-клетки — CD28. Без этого дополнительного взаимодействия Т-клетки не дают той реакции, которая необходима для полноценного иммунного ответа. Иными словами, специфические Т-клетки не начинают продуцировать фактор роста Т-клеток, интерлейкин-2, и не пролиферируют, давая множество специфических к данному антигену Т-клеток, которые затем, в свою очередь, узнают и уничтожают клетки, содержащие на поверхности нежелательный чужой антиген. Кстати, причиной того, что опухолевые клетки не узнаются клетками иммунной системы, может быть то, что опухолевые клетки обычно не содержат на поверхности В7. Поэтому попытались сделать следующее. Взяли клетки меланомы от опытной мыши и ввели в них В7 антиген. Ввели эти клетки здоровой подопытной мыши. Подопытные мыши развивали опухоль, но затем эта опухоль деградировала, и ни одна из мышей, получивших дозу клеток модифицированной меланомы, не погибла. Наоборот, мыши, получившие немодифициованные клетки, погибали. Более того, если мышам, вакцинированным модифицированными меланомными клетками, ввести немодифицированные клетки меланомы, то 89% мышей оказывались защищёнными от развития опухоли. Это означает, что вакцина могла бы предохранять от метастазирования.
Существуют также и другие подходы к созданию противораковых вакцин.
Стратегия самоубийства раковых клеток
Эта стратегия основывается на попытках ввести в опухолевые клетки некоторый продукт, сам по себе нетоксичный, но который в определённых условиях может начать проявлять токсическое действие.
В качестве примера рассмотрим использование тимидинкиназы вируса простого герпеса (HSVtk). Принцип использования этого фермента представлен на Рис. 19.
Рисунок 19. Принцип использования фермента тимидинкиназы вируса простого герпеса (HSVtk).
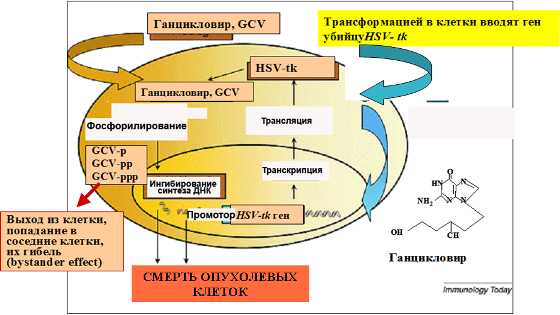
Тимидинкиназа вируса простого герпеса, в отличие от клеточной тимидинкиназы, способна фосфорилировать антигерпесные соединения ацикловир и ганцикловир. Это замечательное свойство приводит к тому, что клетки, трансформированные геном тимидинкиназы HSVtk, погибают в присутствии этих агентов, поскольку клеточные киназы превращают фосфорилированные ацикловир и ганцикловир в трифосфаты, а трифосфаты затем включаются во вновь синтезированную ДНК в процессе синтеза ДНК при клеточном делении. Включившись, они обрывают дальнейший синтез ДНК, терминируют его. В результате клетки, содержащие герпесную тимидинкиназу, погибают в присутствии этих агентов. Обратите внимание: делящиеся клетки погибают, а не покоящиеся. Покоящиеся не синтезируют ДНК и не включают ганцикловир или ацикловир. Этим можно воспользоваться для целей генной терапии раковых опухолей, клетки которых быстро делятся. С другой стороны, рекомбинантные ретровирусы также охотнее всего интегрируются в делящихся клетках.
Рассматриваемый ниже пример представляет собой in vivo генную терапию. Он связан с попытками излечить опухоли мозга. Схема экспериментов, о которых пойдёт речь, представлена на Рис. 20.
Рисунок 20. Пример реализации in vivo стратегии самоубийства раковых клеток.

Клетки мышиных фибробластов, продуцирующие рекомбинантные ретровирусы, содержащие ген тимидинкиназы, подсаживали прямо в опухоль в мозге. Поскольку ретровирусы интегрируют в митотически активные клетки, ген тимидинкиназы оказывается преимущественно в опухолевых клетках, тогда как здоровые клетки из тканей, окружающих опухоль, остаются вне вирусной атаки и, следовательно, без гена тимидинкиназы вируса герпеса. На крысах после такой обработки 30—60% опухолевых клеток в мозгу оказывались обладателями гена HSVtk. Теперь, если крысам давать ганцикловир, то можно надеяться, что опухолевые клетки, содержащие ген тимидинкиназы будут погибать. Действительно, у 80% подопытных крыс опухоли после такой обработки разрушались в присутствии ганцикловира. Такое увеличение доли погибающих клеток по сравнению с инфицированными, происходит вследствие так называемого эффекта «рядом стоящего» (bystander). Погибают не только клетки, включившие ген HSVtk, но и соседние с ними клетки, в которых этого гена нет, но которые делятся. По-видимому, фосфорилированный ганцикловир может диффундировать от клеток, в которых он образуется за счёт работы герпесной тимидинкиназы, к соседним клеткам. Если соседние клетки делятся, то они будут его включать в ДНК и погибать. Оказывается, что если хотя бы 10% клеток опухоли содержит ген тимидинкиназы, многие опухоли могут быть уничтожены полностью. И при этом на животных не наблюдалось токсических эффектов.
Эти результаты побудили начать испытания на людях, страдающих опухолями мозга. Им инъецировали мышиные фибробласты, продуцирующие рекомбинантные ретровирусы, точно так же как это делали с подопытными животными. После этого внутривенно вводили ганцикловир. Небольшая статистика, накопленная к моменту написания этого обзора, позволяет сказать только, что какие-то позитивные эффекты наблюдаются.
В опытах на животных очень хорошие результаты с подобным же подходом получали и с лечением метастаз в печени. В этом случае также здоровые гепатоциты, которые не делятся, не инфицируются. Метастазы же делятся, включают ген HSVtk и погибают в присутствии ганцикловира, если в них встроен ген HSVtk. Этот подход кажется очень перспективным.
Ещё один важный вопрос, который требует упоминания: известно, что раковые больные подвергаются интенсивной химиотерапии. Химические средства токсичны, и больные очень страдают от их приёма. Но клетки опухолей начинают к тому же экспрессировать ген множественной устойчивости к лекарствам — MDR1 (multidrug resistance type 1). Продукт этого гена работает, как насос, и выкачивает из опухолевой клетки лекарства, делая её устойчивой сразу ко многим химиотерапевтическим средствам. В ряду направлений генной терапии рака, которые сейчас серьёзно обсуждаются, попытки введения этого гена устойчивости в гематопоэтические клетки, чтобы сделать их малочувствительными к токсическим эффектам лекарств. На животных такие эксперименты были успешными. Эксперименты на больных проводятся.
