
- •1.Атом, его составные чаcти( ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
- •2.Характеристика состояния электрона квантовыми числами, атомные орбитали. Принцип наименьшей энергии. Принцип Паули. Правило Хунда.
- •3.Периодический закон д.И.Менделеева. Стркутура периодической системы: периоды, группы, подгруппы. Особенности электронного строения атомов главных и побочных подгрупп.
- •4.Периодически и непериодически изменяющиеся свойства элементов. Энергия ионизации, сродство к электрону. Электроотрицательность.
- •5.Изменение свойств элементов в периодической системе.
- •6.Периодическая система элементов и её связь со строением атома. S-, p-, d- и f-элементы.
- •7.Ковалентная связь. Основные положения метода валентных связей. Свойства ковалентной связи: направленность и насыщенность. Cигма- и пи-связь.
- •8.Ионная связь как крайний случай поляризации ковалентной связи. Ненасыщенность и ненаправленность ионной связи.
- •9.Гибридизация атомных орбиталей. Типы гибридизации и структура молекул.
- •10.Полярная и неполярная ковалентная связь. Полярность молекул. Электрический момент диполя.
- •11.Метод вс для объяснения связи в комплексных соединениях. Магнитные свойства комплексных ионов.
- •12.Межмолекулярное взаимодействие. Водородная связь. Влияние водородной связи на свойства веществ. Донорно-акцепторное взаимодействие.
- •13.Типы кристаллических решёток и их влияние на свойства веществ.
- •14.Скорость реакции в гомогенной системе. Факторы, влияющие на скорость реакции. Константа скорости реакции. Закон действия масс. Скорость реакции в гетерогенной системе.
- •15.Энергия активации. Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
- •16.Катализ гомогенный, гетерогенный, ферментативный. Понятие о механизме каталитических процессов.
- •17. Обратимые и необратимые процессы. Химическое равновесие. Константа равновесия.
- •18. Смещение химического равновесия. Принцип Ле-Шателье. Влияние температуры, давления и концентрации реагентов на равновесие.
- •19. Растворы как многокомпонентные системы. Гидратная теория растворов д.И. Менделеева. Различные способы выражения концентрации растворов.
- •20. Электролитическая диссоциация. Зависимость диссоциации от характера связей в молекулах электролитов. Соли, кислоты, основания.
- •21. Ионные реакции. Условия необратимости ионных реакций. Равновесие в растворе амфотерного электролита.
- •22. Сила электролитов. Степень диссоциации (α). Константы диссоциации. Закон разведения Освальда.
- •23 Вопрос. Малорастворимые вещества. Произведение растворимости. Условие осаждения малорастворимого электролита. Переосаждение.
- •24 Вопрос. Электролитическая ионизация воды. Водородный показатель pH. Понятие о буферных растворах.
- •25 Вопрос. Гидролиз. Различные случаи гидролиза солей. Степень гидролиза. Константа гидролиза.Влияние температуры и концентрации на степень гидролиза. Необратимый гидролиз.
- •26 Вопрос. Комплексообразование в растворах. Структура комплексного соединения. Комплексных соединений.
- •28.Свойства элементов viiib подгруппы. Степени окисления. Общая характеристика элементов. Соли простые и комплексные.
- •30.Элементы via подгруппы. Общая характеристика. Оксиды и гидроксиды серы, селена, и теллура. Сравнение свойств кислот Se и Te со свойствами кислот s.
- •32.Элементы iiia подгруппы. Общая характеристика. Степени окисления. Оксиды и гидроксиды. Соли простые и комплексные.
- •33. Элементы iia подгруппы. Общая характеристика элементов. Степени окисления, оксиды, гидроксиды.
- •34. Элементы ia группы. Щелочные металлы. Общая характеристика. Оксиды, пероксиды, супероксиды, гидроксиды(щёлочи). Соли.
- •35.Кислород. Общая характеристика. Озон. Свойства, применение. Вода. Пероксид водорода и свойства(кислотные, окислительные и восстановительные.
- •36.Хлор. Хлороводород. Соляная кислота. Кислородные соединения хлора. Сопоставление кислотных и окислительных свойств кислородсодержащих кислот.
- •37. Сера. Общая характеристика. Соединения серы с водородом. Сульфиды и их использование для качественного обнаружения катионов. Тиосульфат натрия.
- •39. Азот. Степени окисления. Химическая инертность азота. Примение азота для хранения пищевых продуктов. Соединения n2 и h2. Соли аммония.
- •40.Азот. Оксиды азота. Азотистая кислота и ее окислительно-восстановительный свойства. Нитриты. Азотная кислота. Действие азотной кислоты на металлы и неметаллы. Нитраты.
- •41. Фосфор. Общая характеристика элемента. Оксиды фосфора (III,V) и соответствующие кислоты. Соли фосфорной кислоты и их растворимость, гидролизуемость.
- •42.Углерод. Общая характеристика. Оксиды. Угольная кислота и её соли.
- •43.Олово. Общая характеристика. Оксид и гидроксид олова (II). Соли Sn (II). Гидролиз. Восстановительные свойства соединений олова (II). Применение олова в консервной промышленности.
- •44. Свинец. Общая характеристика. Отношение к щелочам и кислотам. Оксид и гидроксид свинца (II). Оксид свинца(IV) и его восстановительные свойства.
- •45. Алюминий. Общая характеристика. Отношение к кислотам и щелочам. Оксид и гидроксид алюминия. Соли, их растворимость и гидролизуемость.
- •46. Железо. Общая характеристика. Степени окисления. Оксид и гидроксид железа (III) и (II). Соли железа простые и комплексные.
- •47. Хром. Общая характеристика. Степени окисления. Оксиды и гидроксиды хрома(II, III, VI). Соли хрома анионного и катионного типа. Хроматы и дихроматы.
- •48. Марганец. Степени окисления. Соединения марганца и их химический характер. Свойства в овр. Влияние рН на продукты восстановления иона MnO4-.
- •49.Медь. Общая характеристика. Отношение к кислотам. Степени окисления. Оксиды, гидроксиды. Соли Cu(II) простые и комплексные.
- •50. Цинк. Общая характеристика. Оксид, гидроксид. Соли цинка(простые и комплексные)
47. Хром. Общая характеристика. Степени окисления. Оксиды и гидроксиды хрома(II, III, VI). Соли хрома анионного и катионного типа. Хроматы и дихроматы.
Cr ….3d54s1 d-элемент. С.О. +2; +3; +6.
Пассивируются конц. HNO3 и H2SO4, а с разб. HCl и H2SO4 взаимодействует при нагревании. При нагревании горит в кислороде.
+2 CrO пирофорен. Обладает основными свойствами. Восстановитель.
CrO + 2H+ = Cr2+ + H2O
Cr(OH)2 – основыные свойства. Восстановитель. Неустойчив. Окисляется кислородом до +3.
+3 Cr2O3 амфотерен. Образует хромиты.
Cr2O3 + 2NaOH = 2NaCrO2 + H2O.
С водой не взаимодействует.
Cr3+ + 3OH- = Cr(OH)3
Cr(OH)3 амфотерен:
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
NaOH + Cr(OH)3 + 2H2O = Na[Cr(OH)6]
+6 CrO3 – сильный окислитель.
3S + 4CrO3 + H2O = 3SO2 + 2Cr2O3
Окисляет серу, иод, фосфор, углерод, превращаясь в Cr2O3. Кислотный оксид.
CrO3 + H2O = H2CrO4 – хромовая кислота.
2CrO3 + H2O = H2Cr2O7 – дихромовая.
H2CrO4 – гидроксид хрома(VI)
Cr(III) способен образовывать соли анионного и катионного типа.
Анионный – Na[Cr(OH)6]; катионный – CrCl3.
Хроматы и дихроматы
K2CrO4 – желтый порошок. Устойчивый в щелочной среде.

K2Cr2O7 – оранжевый порошок. Бихромат-ион устойчив в кислой среде
Оба – сильные окислители.
2CrO42- + 2H+ ↔ Cr2O7 + H2O
Окислительные свойства в ряду Cr+2Cr+3Cr+6 возрастают, а восстановительные – уменьшаются.
48. Марганец. Степени окисления. Соединения марганца и их химический характер. Свойства в овр. Влияние рН на продукты восстановления иона MnO4-.
Mn ….4s23d5 d-элемент
С.О. +2 +3 +4 +6 +7
Взаимодействует с разб. HCl и H2SO4
C конц. HNO3 и H2SO4 не реагирует – пассивация.
С разб. HNO3 как металл,с выделением NO и образует кислоты……..
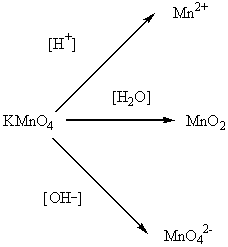
Основность и кислотность соединений марганца зависят от степени окисления: при +2 и +3 – основные свойства, при +4 – амфотерные, при +6 и +7 – кислотные.
Mn+2 – окислительные свойства, Mn+4 – ок-льные и в-льные свойства.
Ок-ль: MnO2 + 4HCl = MnCl2 + Cl2 + H2O
В-ль: MnO2 + 6KOH + KClO3 = 2KMnO4 + KCl + 3H2O
MnO42- - окислитель:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2↓ + 4KOH
MnO4- - сильный окислитель.
49.Медь. Общая характеристика. Отношение к кислотам. Степени окисления. Оксиды, гидроксиды. Соли Cu(II) простые и комплексные.
Cu ….3d104s1 d-элемент. С.О. +1; +2.
Медь не реагирует с кислотами, кроме HNO3 и разбавленной H2SO4
3Cu + НNO3(р) = 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3 = 3Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4 = CuSO4↓+ SO2↑ + 2H2O
Cu2O CuOH – слабые основные свойства
Cu2O → CuO + Cu - идёт при нагревании
CuO Cu(OH)2 – слабые амфотерные свойства.
Сu(OH)2↓ + 2H+ = 2H2O + Cu2+
Cu(OH)2↓ + 2OH- = [Cu(OH)4]2-
Соли Cu2+. Простые соли.
CuSO4 - гидролиз:
2CuSO4 + 2HOH ↔ (CuOH)2SO4 + H2SO4
Комплексные соли катионного или анионного типа
[Cu(NH3)4]SO4 – катионный; Na2[Cu(OH)4]
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
50. Цинк. Общая характеристика. Оксид, гидроксид. Соли цинка(простые и комплексные)
Zn ….3d104s2
1)Окисление кислородом
2Zn + O2 = 2ZnO – оксид цинка
2)Взаимодействие с галогенами
Вытесняет H2 из HCl и H2SO4(до 50%)
3)При взаимодействии с конц. H2SO4 выделяется H2S
Zn + H2SO4(к) = ZnSO4 + H2S↑ + 4H2O
4)C HNO3 реакция идёт в зависимости от концентрации кислоты
Zn + HNO3 = Zn(NO3)2 + NH4NO3(N2; NO; NO2) + H2O
5)С щелочами:
Zn + 4NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Оксид цинка взаимодействует с кислотами, но не с водой:
ZnO + 2HCl = ZnCl2 + H2O
Гидроксид цинка взаимодействует с кислотами и щелочами:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Соли цинка.
Соли сильных кислот растворимы в воде. Подвергаются гидролизу.
Zn2+ + HOH ↔ ZnOH- + H+
Zn образует прочные анионные комплексы с лигандом (СN)
Качественная реакция на ион цинка
2Zn2+ + K4[Fe(CN)6]= Zn2[Fe(CN)6]↓ + 4K+
