
- •22) Вода. Ионное произведение воды. Водородный показатель среды.
- •5)Основные этапы развития представлений о строении атома и ядра. Квантово-химическая модель атома
- •4) Периодический закон и периодическая система элементов д.И.Менделеева, ее структура
- •3) Основные классы неорганических веществ: кислоты, соли, основания, оксиды
- •1) Оксиды– сложные вещества, состоящие из двух видов химических элементов, один из которых обязательно кислород. Оксиды:
- •2) Кислоты – это сложные вещества, состоящие из катионов только водорода, способные замещаться только на металл, и анионов кислотного остатка. Кислота: (по составу)
- •Кислоты:
- •3) Основания – сложные вещества, состоящие из анионов гидроксогрупп (он) и катионов металлов.
- •4)Соль – это сложное вещество, состоящее из атома металла и кислотного остатка.
- •2) Основные законы химии
- •Массы различных газов, занимающих одинаковые объемы; относятся м/усобой как их молекулярные массы
- •1) Основные понятия химии: атома, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль
- •7) Квантовые числа
- •8) Порядок заполнения орбиталей электронами. Принцип минимума энергии. Принцип Паули. Правило Хунда. Правило Клечковского
- •6) Понятие об электронном облаке. Волновая функция.
- •19) Растворы, определение, классификация. Понятие о концентрации растворов, способов ее выражения.
- •18) Овр. Основные виды овр. Типичные окислители и восстановители. Электронный и ионно-электронный баланс.
- •1)Простые вещества: галогены(8 группа), кислород. 2)кислородосодержащие кислоты и их соли. 3)ионы металлов, находящиеся в высшей степени окисленности.
- •20) Теория электролитической диссоциации. Степень и константа электролитической диссоциации. Закон разведения Оствальда.
- •21) Сильные и слпбые электролиты
- •17) Водородная связь. Механизм образования водородной связи.
- •25) Скорость химической реакции. Влияние температуры на скорость химической реакции. Правилол Вант-Гоффа. Уравнение Аррениуса.
- •24) Гидролиз солей. Степень и константа гидролиза.
- •1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону)
- •2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
- •3. Гидролиз соли слабой кислоты и слабого основания
- •23) Активность, коэффициент активности. Ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора.
- •32) Газовые электроды. Расчет потенциалов водородного и кислородного электродов
- •26) Порядок и молекулярность реакций. Энергия активации, ее физический смысл.
- •28) Катализ. Понятие о гомогенном и гетерогенном катализе. Влияние катализа на скорость прямой и обратной реакции.
- •Катализ - изменение скорости реакции под действием особых веществ (катализаторов)
- •Существует катализ гомогенный и гетерогенный Все вещества в одной Катализатор находится в
- •В закон действующих масс не входят концентрации твердых веществ, т.К. Реакции с твердыми веществами протекают на их поверхности, где "концентрация" вещества постоянна.
- •33) Окислительно-восстановительный потенциал
- •31) Гальванический элемент. Эдс гальванического элемента. Концентрационный элемент
- •29) Обратимость химических реакций. Влияние концентрации, давления и температуры на химическое равновесие. Принцип Ле-Шателье. Константа химического равновесия
- •34) Кинетика электродных процессов. Концентрационная и Электрохимическая поляризация
- •1) Подвод реагирующих веществ к электроду;
- •2) Процесс электрохимического превращения на поверхности электрода, который может сопровождаться дополнительными химическими реакциями;
- •1) Отвод продуктов реакции от электрода.
- •35) Электролиз. Законы Фарадея. Электролиз с растворимым и нерастворимым анодом(в расплаве и в растворе). Выход по току.Практическое применение.
- •1. Легко восстанавливаются ионы металлов с положительными значениями электродных потенциалов.
- •2. На инертных электродах при электролизе водных растворов легко окисляются одноатомные бескислородные анионы (кроме f-).
- •3. Кислородсодержащие анионы при электролизе водных растворов практически не окисляются. В этих случаях идет окисление воды:
- •36) Коррозия. Основные виды коррозии: химическая, электрохимическая, коррозия под действием блуждающих токов. Методы защиты от коррозии. Ингибиторы коррозии.
- •9) Емкость энергетических уровней и подуровней. Строение электронных оболочек атомов и связь периодической системы со строением атомов
- •38)Физико-химические свойства металлов. Основные методы получения металлов
- •39) Металлические сплавы, твердые растворы и интерметаллические соединения
- •12) Ковалентная связь
- •13) Пи и о-связи. Длина связи. Энергия связи.
- •3Электроны на π-мо, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
- •16) Металлическая связь
- •10) Энергия ионизации, энергия сродства к электрону, электроотрицательность. Ионизационный потенциал.
- •15) Ионная связь
- •14) Донорно-акцепторный механизм образования ковалентной связи.
- •11) Природа хической связи. Теория валентности. Понятие о степени окисления.
- •37) Термодинамика и кинетика коррозии
- •Тепловые эффекты химических и физико-химических процессов.
- •Определяет возможности происхождения химических процессов.
- •Определяет предел протекания химической реакции (условие равновесия химической реакции).
Окислительно-восстановительный
потенциал Окислительно-восстановительный
потенциал(редокс-потенциал) — потенциал,
устанавливающийся при погружении
платины или золота (инертный электрод)
в окислительно-восстановительную
среду, т. е. в раствор, содержащий как
восстановитель (Вос.), так и окислитель
(Ок.). Если реакцию окисления-восстановления
представить уравнением: аОк.
+ ne ↔ сВос., то
количественная зависимость
Окислительно-восстановительный
потенциала от концентраций (точнее,
активностей) реагирующих веществ
выражается уравнением Нернста:
где
ЕO — стандартный (нормальный)
Окислительно-восстановительный
потенциал, n — число электронов,
участвующих в реакции, F — число Фарадея.
R — газовая постоянная (равная 8,813
джоуля) и Т — абсолютная температура,
[Ок.] и [Вос.] — концентрации соответственно
окислителя и восстановителя.
Окислительно-восстановительные
потенциалы определяют электрохимическими
методами и выражают в милливольтах
(мв) относительно нормального водородного
электрода.
Гальванические
элементы. Вычисление ЭДС и её связь с
термодинамикой электродных реакций.
Методы измерения электродных потенциалов.
ГЭ –называются ус-ва, в которых энергия
хим. р-ций преобразуется в электрическую.
Состоит из двух полуэлементов, одним
из которых является анод, а другой
катод. Анод и катод определяются по
значению Е0.
Анод имеет более отрицательное значение
Е0.
Медно-цинковый ГЭ Даниэля Якоби. Каждый
из полуэлементов представляет собой
металл, опущенный в р-р собственной
соли. Если два полуэлемента соединить
внешним проводником, то электроны
придут в направленной движение от анода
к катоду. А(-): Zn0-2ē=Zn2+$
K(+):
Cu2+
+2ē=Cu0.
Основной кол-венной хар-кой ГЭ является
ЭДС, которая обозначается ε.
ε=EK-EA.
Для измерения электродных потенциалов
очень часто используют водородный
электрод, который состоит из платиновой
пластины, пов-сть которой покрыта
платиновой чернью, и помещенной в р-р
серной кислоты. Через р-р пропускается
газообразный водород под атмосферным
давлением. Н2↔2Н0;
2Н++2ē=Н02.
Условно потенциал водородного электрода
примем за 0. Для измерения ОВ потенциалов
и электродных потенциалов создают ГЭ,
в котором один электрод измеряемый, а
другой – водородный. ЭЛЕКТРОДВИЖУЩАЯ
СИЛА
(эдс), величина, характеризующая источник
энергии неэлектростатической природы
в электрической цепи, необходимый для
поддержания в ней электрического тока.
Эдс численно равна работе по перемещению
единичного положительного заряда вдоль
замкнутой цепи. Полная эдс в цепи
постоянного тока равна разности
потенциалов на концах разомкнутой
цепи. Эдс индукции создается вихревым
электрическим полем, порождаемым
переменным магнитным полем. В СИ
измеряется в вольтах.
30)
Определение и классификация
электрохимических процессов. Понятие
об электродном потенциале. Стандартный
электродный потенциал. Уравнение
Нернста для расчета потенциала
металлического электрода. Раздел
химии, который изучает электрохимические
процессы, называется электрохимией.
Электрохимическим процессом называется
процесс, при котором происходит взаимное
превращение химической и электрической
энергий. Ус-ва, в которых энергия хим.
р-ций превращается в электрическую,
называются гальваническими элементами.
Ус-ва, в которых электрическая энергия
превращается в хим., называются
электролизёрами или гальваническими
ваннами. В ус-вах обоих типов происходят
ОВР, особенностью которых является то,
что они происходят на электродах в
двойном электрическом слое и которые
пространственно разделены. Если
металлическую пластину опустить в р-р
соли, то между пластиной и р-ром начнется
хим. взаимодействие, обусловленное
тем, что полярные молекулы воды будут
отрицательными полюсами ориентированы
к положительно заряженным ионам
кристаллической решетки металла.
Результатом этого взаимодействия может
быть образование дегратированных ионов
металла. Процесс этот обратимый.
Меn++m(H2O)↔Men+∙(H2O)m.
В результате обратного перехода ионов
в металл через некоторое время
устанавливается равновесие. В зависимости
от активности металла эта р-ция может
сопровождаться образованием ДЭС, в
котором пластина может быть заряжена
либо отрицательно, либо положительно,
а р-р соответственно либо положительно,
либо отрицательно. На границе Ме-р-р
возникает скачок потенциала (φ) и
электродный потенциал (Е). 3 случая
образования ДЭС: 1) Металл активный. В
этом случае металл взаимодействует с
молекулами воды. Меn++m(H2O)↔Men+∙(H2O)m+nē.
2) Металл малоактивный.
[nCu]+λCu2+(H2O)m=[nCu]+λCu2++mH2O.
3) Металл инертный. Такие электроды не
окисляются и являются лишь передатчиками
электронов. При помещении таких
электродов в р-р какого-либо электролита
на границе электрод-р-р может формироваться
ДЭС либо по первому, либо по второму
типу ЭЛЕКТРОДНЫЙ
ПОТЕНЦИАЛ
в электрохимии, разность электрических
потенциалов на границе фаз электрод —
электролит. На практике пользуются
значениями т. н. относительного
электродного потенциала, равного
разности электродного потенциала,
данного электрода и электрода сравнения
(напр., нормального водородного Электродные
потенциалы любых окислительно-восстановительных
систем (редокс-потенциалы) можно
рассчитать по уравнению Нернста: где0
- стандартный потенциал (В), R - универсальная
газовая постоянная (Джмоль-1К-1),
n - число электронов, участвующих в
окислительно-восстановительном
процессе, Т - температура (К), F - постоянная
Фарадея (Кл), [Ox] - концентрация окисленной
формы, [Red] - концентрация восстановленной
формы.
Обратимость
химических реакций. Влияние концентрации,
давления и температуры на химическое
равновесие. Принцип Ле-Шателье. Константа
химического равновесия Обратимые
реакции
- химические реакции, протекающие
одновременно в двух противоположных
направлениях Химическое
равновесие – состояние системы при
котором скорости прямой и обратной
реакции равны.
Выводится
из равенства скоростей прямой и обратной
реакций и выражается константой
равновесия К. Для обратимой реакции в
общем виде
В
соответствии с законом действующих
масс кинетический. Скорость хим. реакции
прямо пропорционально произведению
концентраций реагирующих веществ,
взятых в степенях их стехиометрических
коэффициентов. Химическое
равновесие – состояние системы при
котором скорости прямой и обратной
реакции равны.
Выводится из равенства скоростей
прямой и обратной реакций и выражается
константой равновесия К. Для обратимой
реакции в общем виде
Принцип
Ле-Шателье-Брауна. Если на систему,
находящуюся в равновесии, оказывать
внешнее воздействие, то равновесие
сдвигается в направлении, ослабляющем
это воздействие. Реакции с участием
газообразных веществ. При увеличении
давления равновесие смещается в
направлении реакции, идущей с уменьшением
объема газообразных веществ, при
понижении давления в сторону реакции
идущей с увеличением объема.
При
повышении температуры равновесие
смещается в сторону эндотермической
реакции, при понижении в сторону
экзотермической.




33) Окислительно-восстановительный потенциал
![]()
31) Гальванический элемент. Эдс гальванического элемента. Концентрационный элемент
 ,
,29) Обратимость химических реакций. Влияние концентрации, давления и температуры на химическое равновесие. Принцип Ле-Шателье. Константа химического равновесия
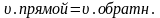

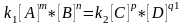 преобразуем
и получаем закон действующих масс
термодинамический. Константа равновесия
хим. реакции = произведению концентраций
продуктов реакции, взятых в степенях
их стехиометрических коэффициентов в
уравнении реакции, деленному на
произведение концентраций исходных
веществ, взятых в степенях стехиометрических
коэффициентов.
преобразуем
и получаем закон действующих масс
термодинамический. Константа равновесия
хим. реакции = произведению концентраций
продуктов реакции, взятых в степенях
их стехиометрических коэффициентов в
уравнении реакции, деленному на
произведение концентраций исходных
веществ, взятых в степенях стехиометрических
коэффициентов.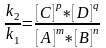 константа
равновесия величина постоянная для
данной реакции при данной температуре.
Связана с изменением потенциала Гиббса
в стандартных условиях.
константа
равновесия величина постоянная для
данной реакции при данной температуре.
Связана с изменением потенциала Гиббса
в стандартных условиях. процесс
идет самопроизвольно в прямом направление,
если потенциал уменьшается следовательно
константа равновесия больше 1. Концентрация
продуктов > концентрации исходных
веществ. Если наоборот, то реакция
практически не шла. При повышении
температуры равновесие сместиться в
сторону эндотермической реакции, при
понижении в сторону экзотермической.
При увеличении давления равновесие
смещается в направлении реакции, идущей
с уменьшением объема газообразных
веществ, при понижении давления в
сторону реакции идущей с увеличением
объема. При увеличении концентрации
исходных веществ равновесие смещается
в сторону прямой реакции.
процесс
идет самопроизвольно в прямом направление,
если потенциал уменьшается следовательно
константа равновесия больше 1. Концентрация
продуктов > концентрации исходных
веществ. Если наоборот, то реакция
практически не шла. При повышении
температуры равновесие сместиться в
сторону эндотермической реакции, при
понижении в сторону экзотермической.
При увеличении давления равновесие
смещается в направлении реакции, идущей
с уменьшением объема газообразных
веществ, при понижении давления в
сторону реакции идущей с увеличением
объема. При увеличении концентрации
исходных веществ равновесие смещается
в сторону прямой реакции.
 уменьшение
объема
уменьшение
объема увеличение
объема
увеличение
объема Повышение Т
Повышение Т понижение
Т. При увеличении концентрации исходных
веществ или уменьшении концентрации
продуктов реакции равновесие смещается
в сторону прямой реакции, при увеличении
концентрации продуктов реакции или
уменьшении концентрации исходных
веществ - в сторону обратной реакции.
понижение
Т. При увеличении концентрации исходных
веществ или уменьшении концентрации
продуктов реакции равновесие смещается
в сторону прямой реакции, при увеличении
концентрации продуктов реакции или
уменьшении концентрации исходных
веществ - в сторону обратной реакции.
