
- •22) Вода. Ионное произведение воды. Водородный показатель среды.
- •5)Основные этапы развития представлений о строении атома и ядра. Квантово-химическая модель атома
- •4) Периодический закон и периодическая система элементов д.И.Менделеева, ее структура
- •3) Основные классы неорганических веществ: кислоты, соли, основания, оксиды
- •1) Оксиды– сложные вещества, состоящие из двух видов химических элементов, один из которых обязательно кислород. Оксиды:
- •2) Кислоты – это сложные вещества, состоящие из катионов только водорода, способные замещаться только на металл, и анионов кислотного остатка. Кислота: (по составу)
- •Кислоты:
- •3) Основания – сложные вещества, состоящие из анионов гидроксогрупп (он) и катионов металлов.
- •4)Соль – это сложное вещество, состоящее из атома металла и кислотного остатка.
- •2) Основные законы химии
- •Массы различных газов, занимающих одинаковые объемы; относятся м/усобой как их молекулярные массы
- •1) Основные понятия химии: атома, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль
- •7) Квантовые числа
- •8) Порядок заполнения орбиталей электронами. Принцип минимума энергии. Принцип Паули. Правило Хунда. Правило Клечковского
- •6) Понятие об электронном облаке. Волновая функция.
- •19) Растворы, определение, классификация. Понятие о концентрации растворов, способов ее выражения.
- •18) Овр. Основные виды овр. Типичные окислители и восстановители. Электронный и ионно-электронный баланс.
- •1)Простые вещества: галогены(8 группа), кислород. 2)кислородосодержащие кислоты и их соли. 3)ионы металлов, находящиеся в высшей степени окисленности.
- •20) Теория электролитической диссоциации. Степень и константа электролитической диссоциации. Закон разведения Оствальда.
- •21) Сильные и слпбые электролиты
- •17) Водородная связь. Механизм образования водородной связи.
- •25) Скорость химической реакции. Влияние температуры на скорость химической реакции. Правилол Вант-Гоффа. Уравнение Аррениуса.
- •24) Гидролиз солей. Степень и константа гидролиза.
- •1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону)
- •2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
- •3. Гидролиз соли слабой кислоты и слабого основания
- •23) Активность, коэффициент активности. Ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора.
- •32) Газовые электроды. Расчет потенциалов водородного и кислородного электродов
- •26) Порядок и молекулярность реакций. Энергия активации, ее физический смысл.
- •28) Катализ. Понятие о гомогенном и гетерогенном катализе. Влияние катализа на скорость прямой и обратной реакции.
- •Катализ - изменение скорости реакции под действием особых веществ (катализаторов)
- •Существует катализ гомогенный и гетерогенный Все вещества в одной Катализатор находится в
- •В закон действующих масс не входят концентрации твердых веществ, т.К. Реакции с твердыми веществами протекают на их поверхности, где "концентрация" вещества постоянна.
- •33) Окислительно-восстановительный потенциал
- •31) Гальванический элемент. Эдс гальванического элемента. Концентрационный элемент
- •29) Обратимость химических реакций. Влияние концентрации, давления и температуры на химическое равновесие. Принцип Ле-Шателье. Константа химического равновесия
- •34) Кинетика электродных процессов. Концентрационная и Электрохимическая поляризация
- •1) Подвод реагирующих веществ к электроду;
- •2) Процесс электрохимического превращения на поверхности электрода, который может сопровождаться дополнительными химическими реакциями;
- •1) Отвод продуктов реакции от электрода.
- •35) Электролиз. Законы Фарадея. Электролиз с растворимым и нерастворимым анодом(в расплаве и в растворе). Выход по току.Практическое применение.
- •1. Легко восстанавливаются ионы металлов с положительными значениями электродных потенциалов.
- •2. На инертных электродах при электролизе водных растворов легко окисляются одноатомные бескислородные анионы (кроме f-).
- •3. Кислородсодержащие анионы при электролизе водных растворов практически не окисляются. В этих случаях идет окисление воды:
- •36) Коррозия. Основные виды коррозии: химическая, электрохимическая, коррозия под действием блуждающих токов. Методы защиты от коррозии. Ингибиторы коррозии.
- •9) Емкость энергетических уровней и подуровней. Строение электронных оболочек атомов и связь периодической системы со строением атомов
- •38)Физико-химические свойства металлов. Основные методы получения металлов
- •39) Металлические сплавы, твердые растворы и интерметаллические соединения
- •12) Ковалентная связь
- •13) Пи и о-связи. Длина связи. Энергия связи.
- •3Электроны на π-мо, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
- •16) Металлическая связь
- •10) Энергия ионизации, энергия сродства к электрону, электроотрицательность. Ионизационный потенциал.
- •15) Ионная связь
- •14) Донорно-акцепторный механизм образования ковалентной связи.
- •11) Природа хической связи. Теория валентности. Понятие о степени окисления.
- •37) Термодинамика и кинетика коррозии
- •Тепловые эффекты химических и физико-химических процессов.
- •Определяет возможности происхождения химических процессов.
- •Определяет предел протекания химической реакции (условие равновесия химической реакции).
Скоростью
химической реакции
называется изменение концентраций
реагирующих или образующихся веществ
в единицу времени.
Гомогенная
реакция – система которая протекает
в системе состоящей из одной фазы.
Скорость такой реакции – изменение
кол-ва реагирующего или образующегося
вещ-ва в единицу времени в единице
объема системы. Гетерогенная
реакция протекает на границе фаз в
системе, состоящей из нескольких фаз.
Скоростью такой реакцией наз. изменение
кол-ва реагирующего или образующегося
вещ-ва в единицу времени на единице
площади раздела фаз. Скорость
реакции зависит от природы реагирующих
веществ, а ток же от концентрации,
температуры, наличия катализатора. Закон
действующих масс –
скорость химической реакции прямо
пропорциональна произведению концентраций
реагирующих веществ, взятых в степенях
их стехиометрических коэффициентов.
mA+nB=pAB
Правило
Ван-Гоффа.
С повышением температуры на 10С скорость
реакций возрастает в 2-4 раза. Правило
Вант-Гоффа По
этому правилу, при увеличении температуры
на 10 градусов, скорость химической
реакции возрастает в 2-4 раза. Температурный
коэффициент:
V
–объем системы не меняется, тогда
При
увеличении температуры, резко возрастает
число активных молекул, которые обладают
избыточной энергией
Согласно
…….. уравнению ……… константа скорости
записывается: Уравнение
Аррениуса:
где
к – константа скорости реакции;
Гидролиз
– реакция соли с водой с образованием
слабого электролита. Сопровождается
изменением рН среды. Пример Na2CO3=Na++CO32-
-диссоциация, CO32-+H2O=HCO3-+OH- - гидролиз.
Гидролиз заключается в химическом
взаимодействии ионов растворенной
соли с молекулами воды, приводящим к
образованию малодиссоциированных
соединений и изменению реакции среды.
Величина, количественно характеризующая
гидролиз, называется степенью гидролиза
h.
Степень
гидролиза – отношение числа гидролизованных
молекул соли к общему числу растворенных
ее молекул. . Степень гидролиза соли
тем выше, чем слабее кислота или
основание, её образующие. Различают
обратимый и необратимый гидролиз солей: (раствор
имеет слабощелочную среду, реакция
протекает обратимо, гидролиз по второй
ступени протекает в ничтожной степени) (раствор
имеет слабокислую среду, реакция
протекает обратимо, гидролиз по второй
ступени протекает в ничтожной степени) (равновесие
смещено в сторону продуктов, гидролиз
протекает практически полностью, так
как оба продукта реакции уходят из зоны
реакции в виде осадка или газа). Соль
сильной кислоты и сильного основания
не подвергается гидролизу, и раствор
нейтрален. Является
количественной характеристикой
гидролиза. Константа
гидролиза — константа равновесия
гидролитической реакции. Так константа
гидролиза соли равна отношению
произведения равновесных концентраций
продуктов реакции гидролиза к равновесной
концентрации соли с учетом стехиометрических
коэффициентов..
Активность
компонентов раствора — эффективная
(кажущаяся) концентрация компонентов
с учётом различных взаимодействий
между ними в растворе, то есть с учётом
отклонения поведения системы от модели
идеального раствора. Активность
отличается от общей концентрации на
некоторую величину. Отношение активности
() к общей концентрации вещества в
растворе называется коэффициентом
активности: у=а/с Ионная
сила раствора — мера интенсивности
электрического поля, создаваемого
ионами в растворе. Полусумма произведений
из концентрации всех ионов в растворе
на квадрат их заряда. Формула впервые
была выведена Льюисом.Например, для
раствора NaCl с концентрацией 0,001 моль/л,
в котором присутствуют два вида
однозарядных ионов Na+ и Cl− с концентрациями
также равными 0,001 моль/л, ионная сила
будет вычисляться следующим образом: I(NaCl)
= 0,5(z?(Na+)•c(Na+) + z?(Cl−)•c(Cl−)) = 0,5(1?•c(NaCl) +
(-1)?•c(NaCl)) = c(NaCl) И
ионная сила соответственно будет равна
концентрации раствора: I
= 0.51?•0,001 моль/л + (-1)?•0,001 моль/л) = 0.5(0,001
моль/л + 0,001 моль/л) = 0,001 моль/л. Ионная
сила раствора имеет большое значение
в теории сильных электролитов Дебая —
Хюккеля. Основное уравнение этой теории
(предельный закон Дебая — Хюккеля)
показывает связь между коэффициентом
активности иона ze и ионной силы раствора:
log(yi)=-Az2I1/


25) Скорость химической реакции. Влияние температуры на скорость химической реакции. Правилол Вант-Гоффа. Уравнение Аррениуса.
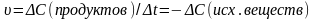


 где
Са и Сb – молярные концентрации, k –
константа скорости.
где
Са и Сb – молярные концентрации, k –
константа скорости.





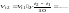
 скорость реакции увеличивается.
скорость реакции увеличивается.
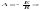



 – предэкспонециальный множитель; е –
основание натурального логарифма; Еа
– постоянная, называемая энергией
активации, определяемая природой
реакции. Уравнение Аррениуса позволяет
проводить более точные расчеты изменения
скорости реакции с увеличением
температуры, чем уравнение Вант-Гоффа.
– предэкспонециальный множитель; е –
основание натурального логарифма; Еа
– постоянная, называемая энергией
активации, определяемая природой
реакции. Уравнение Аррениуса позволяет
проводить более точные расчеты изменения
скорости реакции с увеличением
температуры, чем уравнение Вант-Гоффа.
24) Гидролиз солей. Степень и константа гидролиза.
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
3. Гидролиз соли слабой кислоты и слабого основания
23) Активность, коэффициент активности. Ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора.
