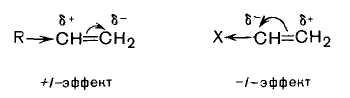1. Напишите уравнения реакций гидрогалогенирования следующих ненасыщенных углеводородов: этилена; пропена; 2-метилпропена; бутена-1; 2-метилбутена-1; бутадиена-1,3; 2-метилбутадиена-1,3; пентена-1; пропеновой кислоты. Опишите механизм реакции. Покажите действие правила Марковникова (с учётом статического и динамического факторов).
Решение.
Присоединением галогенводородов к алкенам и циклоалкенам получают алогеналканы или соответственно галогенциклоалканы.

Где HHal – это хлороводород HCl или бромоводород HBr
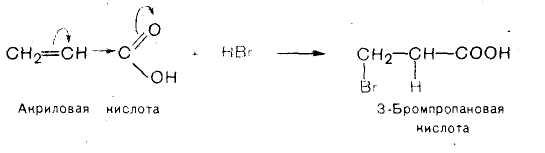
Если карбоксильная группа в ненасыщенных кислотах находится непосредственно у атома углерода при двойной связи, то за счет – М- и – I-эффектов она выступает в роли электроноакцептора и оттягивает на себя электронную плотность кратной связи. Это приводит, с одной стороны, к снижению реакционной способности двойной связи в реакциях электрофильного присоединения, с другой — к протеканию этих реакций против правила Марковникова.
Например, гидробромирование акриловой кислоты происходит против правила Марковникова, т. е. атом водорода присоединяется к менее гидрогенизированному атому углерода.
Правило Марковникова: при присоединении молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенюированному атому углерода двойной связи.
Такое направление реакции объясняется совокупностью двух факторов. В статическом, т. е. нереагирующем, состоянии в несимметричных алкенах под действием заместителей происходит смещение электронной плотности π-связи с возникновением частичных зарядов, определяющих место будущей атаки со стороны протона. В пропене местом атаки будет атом С-1 с частичным отрицательным зарядом, возникшим под действием +I -эффекта метильной группы.
![]()
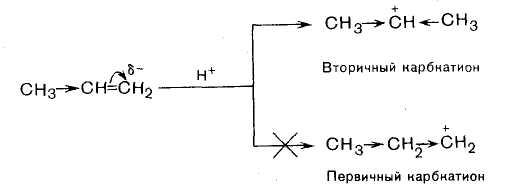
В динамическом состоянии, т. е. в процессе реакции, из двух возможных карбкатионов будет получаться более устойчивый вторичный карбкатион. Он образуется за счет присоединения протона к более гидрогенизированному атому углерода. Во вторичном карбкатионе атом углерода, несущий положительный заряд, связан с двумя алкильными группами, в первичном – с одной. Поэтому во вторичном карбкатионе за счет + I -эффекта двух алкильных групп происходит более эффективное понижение положительного заряда.
Механизм реакции.
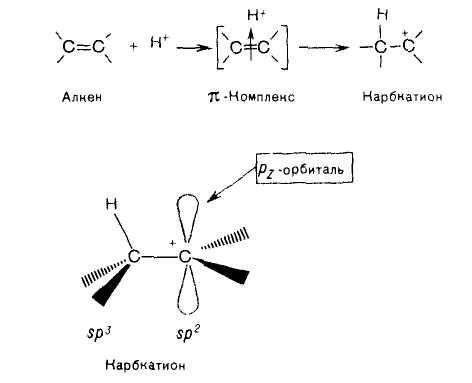
Электронное облако π-связи подвергается атаке электрофильными реагентами, например, такими, как галогенводороды (HCl, HBr). Такие реакции протекают по механизму электрофильного присоединения, обозначаемого символом АЕ (от англ. addition electrophilic). Реакции электрофильного присоединения – это ионные процессы, протекающие в несколько стадий. На первой стадии происходит взаимодействие электрофильной частицы с электронным облаком π-связи. Положительно заряженная электрофильная частица за счет электростатического притяжения образует с молекулой алкена π-комплекс. В качестве электрофильной частицы чаще всего выступает протон Н+, источником которого являются протонсодержащие кислоты НС1, HBr, H2SO4. Затем образуется ковалентная связь между протоном и одним из атомов углерода двойной связи. Этот атом углерода переходит в состояние sр3-гибридизации. Второй атом углерода двойной связи приобретает положительный заряд, и вся частица становится карбкатионом.
Карбкатион — это частица с положительным зарядом на атоме углерода.
Положительно заряженный атом углерода в карбкатионе находится в sр2-гибридном состоянии. Он имеет вакантную рz-орбиталь и три его σ-связи располагаются в одной плоскости.
На второй стадии процесса карбкатион взаимодействует с анионом X- и образует с ним σ-связь за счет пары электронов аниона.
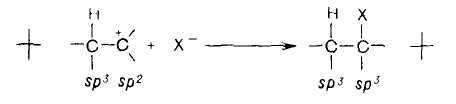
Характерной особенностью электронного облака π-связи является его подвижность. Под влиянием заместителей электронная плотность π-связи может смещаться к одному из атомов углерода. π-Связь тогда становится полярной, а на атомах углерода, соединенных двойной связью, возникают частичные заряды. Увеличение полярности, в конечном счете, может привести к гетеролитическому разрыву π-связи.