
2. Докажите соответствие критериям ароматичности молекул следующих соединений: толуола, фенола, анилина, бензальдегида, бензойной кислоты, пиррола, фурана, тиофена, пиразола, имидазола, пиридина, пурина.
Алгоритм ответа:
-
- какой вид сопряжения осуществляется в молекуле?
-
- донорное или акцепторное влияние оказывают заместители или гетероатомы на ароматический цикл?
-
- для азотсодержащих гетероциклических соединений изобразите электронное строение гетероатомов.
-
- активизируют или дезактивируют заместители или гетероатомы ароматический цикл по отношению к реакциям электрофильного замещения.
-
- выделите в молекуле кислотные или основные центры. В какой роли - п- или -П- основания вступают гетероциклические соединения (пиррол, фуран, тиофен, имидазол, пиридин, пиримидин) во взаимодействие с протонсодержащими кислотами?
Решение.
Толуол
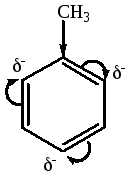
π-Сопряжение в бензольнм кольце, приводяцее к возникновению ароматической системы.
Метильная группа обладает донорным действием на ароматический цикл, обладает +I-эффектом поэтому активизирует ароматический цикл по отношению к реакциям электрофильного замещения. Алкильные группы не могут участвовать в общем сопряжении, но они проявляют + I-эффект, действие которого в наибольшей степени испытывает π-электронная плотность.
Кислотный центр в толуоле – это метильная группа, за счет –I-эффекта бензольного ядра, может проявлять очень слабую (pKa=41) CH-кислотность.
Фенол

p,π-Сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с π-электронами бензольного кольца.
в фенолах гидроксильная группа, помимо отрицательного индуктивного эффекта, обладает положительным мезомерным эффектом.
гидроксильная группа обладает сильным донорным действием на ароматический цикл благодаря сильному +М-эффекту, поэтому активизирует ароматический цикл по отношению к реакциям электрофильного замещения. +М > –I
Частичное смещение электронной плотности атома кислорода в сторону бензольного кольца приводит к повышению полярности связи О — H и, следовательно, увеличению подвижности атома водорода гидроксильной группы.
Большая подвижность атома водорода гидроксильной группы фенолов по сравнению со спиртами предопределяет и их большую кислотность. Участие же неподеленной пары электронов атома кислорода гидроксильной группы фенолов в сопряжении с π-электронами бензольного кольца понижает способность атома кислорода принимать протон и уменьшает основность фенолов. Следовательно, для фенолов характерно проявление кислотных свойств и не характерно проявление основных свойств. Доказательством большей кислотности фенолов по сравнению со спиртами является то, что фенол и его производные реагируют с водными растворами щелочей, образуя соли, называемые феноксидами. Феноксиды сравнительно устойчивы и, в отличие от алкоголятов, могут существовать в водных щелочных растворах. Однако при пропускании через такой раствор тока диоксида углерода феноксиды превращаются в свободные фенолы. Эта реакция доказывает, что фенол является более слабой кислотой, чем угольная кислота.
Анилин
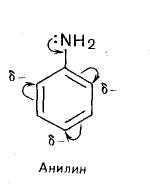
p,π-Сопряжение неподеленной пары электронов атома азота амино группы с π-электронами бензольного кольца.
амино группа обладает сильным донорным действием на ароматический цикл благодаря сильному +М-эффекту, поэтому активизирует ароматический цикл по отношению к реакциям электрофильного замещения.
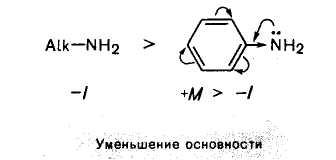
Амины, как и аммиак, проявляют ярко выраженные свойства оснований, что обусловлено наличием в молекуле амина атома азота, имеющего неподеленную пару электронов. Алифатические амины всегда более сильные основания, чем ароматические.
В ароматических аминах аминогруппа находится в р,π-сопряжении с π-электронами бензольного кольца. Неподеленная пара электронов атома азота, участвуя в сопряжении, становится менее склонной к образованию ковалентной связи с протоном. Помимо этого, плохая сольватируемость ароматических соединений в протонных растворителях и большой объем ароматического радикала также не способствуют протонированию атома азота ароматических аминов. Поэтому ароматические амины являются более слабыми основаниями.
Бензальдегид
В ароматических альдегидах и кетонах карбонильная группа находится в сопряжении с бензольным кольцом, проявляя – I-и – М-эффекты. Она оттягивает на себя электронную плотность бензольного кольца, что приводит к понижению величины δ+ на атоме углерода карбонильной группы. Этим объясняется более низкая реакционная способность ароматических оксосоединений по сравнению с алифатическими.
Карбонильная группа является электроноакцептором и дезактивирует ароматический цикл по отношению к реакциям электрофильного замещения.
Благодаря неподеленной электронной паре на атоме кислорода карбонильные соединения обладают слабыми основными свойствами и реагируют с кислотами.

Бензойная кислота

Карбоксильная группа находится в сопряжении с бензольным кольцом, проявляя – I-и – М-эффекты.
Карбоксильная группа является электроноакцептором и дезактивирует ароматический цикл по отношению к реакциям электрофильного замещения.
Карбоксильная группа за счет – I- и – М-эффектов понижает электронную плотность бензольного кольца и тем самым оказывает дезактивирующее действие, которое выражается в затруднении реакций электрофильного замещения в бензольном ядре. Карбоксильная группа как ориентант II рода направляет вновь вступающие группировки преимущественно в мета-положение, например, при нитровании бензойной кислоты.
Бензойная кислота, за счет сопряжения в самой карбонильной группе является OH-кислотой.
Гетероциклические соединения
Степень их ароматичности ниже, чем у классического ароматического соединения — бензола. Это связано с электроотрицательностью гетероатомов в рассматриваемых гетероциклах, в результате чего не может быть полного выравнивания электронной/ плотности по всем атомам цикла, как это характерно для бензола.
Вследствие повышенной электронной плотности в кольце (шесть р-электронов приходятся на пять атомов) пиррол, фуран и тиофен называют «π-избыточными» системами. В таких системах электронная плотность на атомах углерода несколько выше, чем в бензоле, и в основном сосредоточена на α-атомах углерода (положения 2 и 5).
Повышенная электронная плотность на атомах углерода приводит к тому, что эти гетероциклические соединения легко вступают в реакции электрофильного замещения.
Пиррол
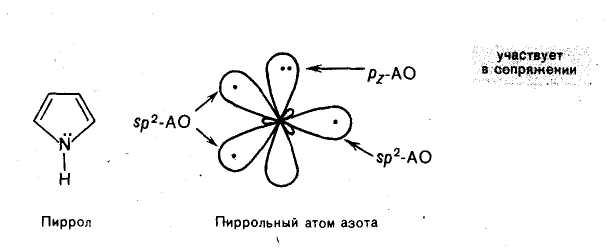
Пиррол — пятичленный гетероцикл с одним атомом азота — также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sр2-гибридизации. Но в отличие от пиридина, атом азота в природе имеет иную электронную конфигурацию. На негибридной p-орбитали атома азота в пирроле находится неподеленная пара электронов. Она принимает участие в сопряжении с р-электронами четырех атомов углерода с образованием единого шестиэлектронного облака. Три sр2-гибридные орбитали образуют три σ-связи. Атом азота с рассмотренным электронным строением называют пиррольным.
Пиррольный атом азота, связанный с атомом водорода, может служить центром кислотности. Пиррол ведет себя как слабая NH-кислота.
Фуран
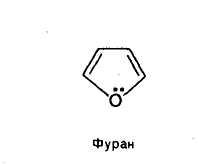
В других пятичленных гетероциклах с одним гетероатомом-фуране —неподеленная пара электронов атомов кислорода, так же, как и пиррольного атома азота, включается в сопряжение с р-электронами атомов углерода с образованием единого электронного облака, по числу электронов отвечающей правилу Хюккеля.
Не проявляют основных свойств пиррол, фуран и тиофен, у которых неподеленные пары электронов гетероатомов включены в общее электронное облако.
Тиофен
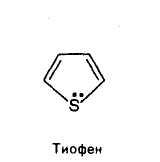
В тиофене —неподеленная пара электронов серы, так же, как и пиррольного атома азота, включается в сопряжение с р-электронами атомов углерода с образованием единого электронного облака, по числу электронов отвечающей правилу Хюккеля.
Пиразол
Примерами ароматических гетероциклов с двумя гетероатомами являются имидазол, пиразол и пиримидин. В имидазоле и пиразоле один из атомов азота относится к пиррольному типу, а другой — к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р-электрона, а пиридиновый — один p-электрон. В пиримидине оба атома азота являются пиридиновыми и предоставляют по одному р-электрону в сопряжение с р-электронами четырех атомов углерода.
Пиразол образуют соли с минеральными кислотами, благодаря пиридиновому атому азота.
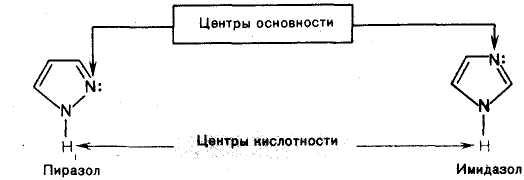
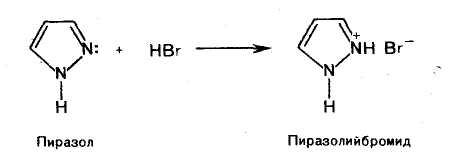
Имидазол и пиразол, содержащие атомы азота пиридинового и пиррольного типов, одновременно проявляют как основные, так и кислотные свойства, т. е. являются амфотерными соединениями.
