
- •III конгресса
- •VIII конференции
- •Isbn гбоу впо РостГму
- •Интегративный подход в подготовке врача общей практики (семейного врача) в послевузовском и дополнительном образовании
- •Какова вероятность наличия метаболического синдрома у больных хобл?
- •Значение базисной терапии бронхиальной астмы на степень достижения контроля у амбулаторных больных
- •Высокочастотная радиохирургия в амбулаторной практике семейного врача
- •Динамика первичного выхода на инвалидность жителей ворошиловского района города ростова-на-дону
- •Контроль качества медицинской помощи в центре здоровья муниципальной поликлиники
- •Применение различных антигипертензивных препаратов у пациентов пожилого и старческого возраста в условиях поликлиники
- •Когнитивные расстройства у пожилых: возможности раннего выявления на уровне первичного звена здравоохранения
- •Синдром гиперкальциемии у больных множественной миеломой
- •Сравнительный анализ клинической эффективности антиаритмической терапии персистирующей формы фибрилляции предсердий на фоне ишемической болезни сердца у пациентов среднего и пожилого возраста.
- •Роль врача-хирурга первичного звена в диагностике абсцесса эпителиального копчикового хода, новые технологии лечения
- •Стабилизация слуховой функции при болезни меньера.
- •Эффективность хирургических вмешательств на перегородке носа у больных с носовыми кровотечениями.
- •Особенности амбулаторного хирургического лечения ортопедических заболеваний и травм кисти у пожилых пациентов
- •Современные подходы к диагностике и лечению malt-лимфом желудка
- •Значимость бессимптомной гиперурикемии для клинической практики врача
- •Болевой суставной синдром у лиц молодого возраста: часто ли мы диагностируем гипермобильность суставов?
- •Критерии гипермобильности суставов
- •Показатели диагностической информативности критериев Бейтона, Ротеса, Булбена и способа диагностики гипермобильности суставов в амбулаторной практике
- •Диагностика инциденталом надпочечников в реальной клинической практике
- •Причины затруднения носового дыхания.
- •Основные причины затруднения носового дыхания у детей от 14 до 18 лет.
- •Основные причины затруднения носового дыхания у взрослых.
- •Возможности клинической цитологии в диагностике заболеваний шейки матки
- •Сравнительный анализ Эффективности методОв Хирургического лечения ректоцеле
- •Современные меры профилактики несостоятельности анастомоза при восстановительных вмешательствах после операции гартмана.
- •Оценка комплексных мер лечебно-профилактической и противоэпидемической служб в профилактике паразитозов
- •1Ростовский государственный медицинский университет, 2филиал фбуз «Центр гигиены и эпидемиологии в Ростовской области», Ростов-на-Дону
- •Алгоритм тактики ведения врачом общей практики больных бронхиальной астмой с нарушениями сна
- •Показатели контроля ба в исследуемых группах
- •У больных в исследуемых группах
- •Пробы у больных ба в исследуемых группах
- •Наш опыт работы дневного стационара муниципальной поликлиники
- •Динамическая обструкция выходного тракта левого желудочка как вариант гипертрофической кардиомиопатии: разбор клинического случая
- •Место врачей общей практики в системе оказании амбулаторной хирургической помощи населению
- •Роль врача первичного звена в выявлении депрессивной симптоматики у соматических больных
- •Реализация «государственной программы российской федерации «развитие здравоохранения» требует комплексного подхода
- •Поиск эффективного и доступного способа массового скринига нарушений питания у лиц молодого возраста
- •Анализ представлений детей младшего школьного возраста о принципах правильного питания по данным анкетирования
- •Анализ организации питания родителей детей младшего школьного возраста
- •Анализ обеспеченности рациона питания беременных кальцием, как способ профилактики развития артериальной гипертензии, обусловленной беременностью
- •Особенности питания и пищевого поведения у пациентов молодого возраста с признаками метаболического синдрома
- •Скрининг и углублённая диагностикасердечно-сосудистых заболеваний среди молодёжи
- •О трудностях своевременного выявления миксомы сердца
- •Региональный опыт тромболизиса: данные первичного сосудистого отделения мбуз гкб №3 г. Ставрополя
- •Гипертоническая болезнь у работающих во вредных условиях труда и значение её в экспертизе профпригодности.
- •Медикаментозная Хронотерапевтическая коррекция дезадаптации у студентов медицинско вуза
- •Значения показателей психо-эмоционального статуса в 1й и 2й группах студентов до и после хронотерапевтической коррекции
- •Возможности профилактики и лечения метаболического синдрома у женщин молодого возраста
- •Иммунологические аспекты прогрессирование хронической сердечной недостаточности ишемического генеза
- •Содержание в крови противовоспалительных цитокинов у больных клинических групп
- •Маркеры апоптоза и фиброза у больных клинических групп
- •Депрессии у пожилых
- •Возможности воп в реализации программы добровольного медицинского страхования в районах крайнего севера и приравненных к ним районах
- •Структура заболеваемости (по обращаемости) коренного и пришлого населения.
- •Особенности повреждений органов груди при множественной и сочетанной травме
- •Сложности диагностики первично множественной опухоли у пожилого пациента (описание клинического случая)
- •Подготовка семеных врачей по проблеме вич-инфекции
- •1Ростовский государственный медицинский университет, 2Южный окружной центр по профилактике и борьбе со спид и из Роспотребнадзора, Ростов-на-Дону
- •Профилактика метаболических нарушений у молодого населения в практике семейного врача
- •Необходимость коррекции депрессивных состояний у пациентов с хронической патологией желулудочно-кишечного тракта
- •Дивертикулярная болезнь, значение офтальмологического обследования в диагностике форм течения заболевания и его прогнозировании
- •К вопросу об организации обеспечения постдипломной подготовки врачей анестезиологов и реаниматологов на современном этапе
- •Проблемы восстановления репродуктивной функции при хроническом пиелонефрите девушек-подростков.
- •Современные проблемы профилактики туберкулезной инфекции среди детского населения г. Таганрога
- •Сопоставление показателей приверженности к лечению больных с артериальными гипертензиями и хронической бронхообструктивной патологией
- •Гомеопатическое лечение воспалительных заболеваний околоносовых пазух у беременных женщин
- •Комплексная терапия больных бронхиальной астмой в сочетании с артериальной гипертензией формотеролом/беклометазоном и амлодипином/валсартаном.
- •Особенности развития и прогрессирования ишемической болезни сердца и хронической сердечной недостаточности у больных с сахарным диабетом 2 типа и гипогликемическими состояниями
- •Показатели углеводного обмена, имт, ад у пациентов сравниваемых групп
- •К вопросу о реабилитации пациентов, перенесших реконструктивно-восстановительные операции на молочной железе, после мастэктомии
- •1.Физиотерапевтическое лечение выполняли у 21 больного без онкологической патологии и оно направлено на предотвращение гематом, нагноения путём уменьшения отёков и воспаления.
- •Современный подход к лечению тяжелой внебольничной пневмонии.
- •Оценка состояния здоровья студентов медицинского университета за 3 года на модели «общая врачебная практика»
- •Распространенность терапевтической патологии среди студентов КрасГму
- •Эффективность использования аппарата «тонзиллор» в лечении больных хроническим тонзиллитом
- •Акмеологические условия совершенствования деятельности факультетов повышения квалификации преподавателей медицинских вузов
- •Опыт последипломной подготовки врачей первичного звена по вопросам иммунопрофилактики инфекционных заболеваний
- •Опыт применения Кутасепта г в лечении воспалительных заболеваний уха
- •Возможности витаминотерапии в комплексном лечении гастроэнтерологических больных
- •Особенности питания детей дошкольного и раннего школьного возрастов, проживающих в г. Ростове-на-дону.
- •Маркеры тубуло-интерстициального фиброза при хроническом гломерулонефрите
- •Способы раннЕй диагностики и патогенез поражения сердца у больных рефрактерноЙ артериальной гипертензией при сахарном диабете 2 типа
- •Случай гипертрофической кардиомиопатии с обструкцией выносящего тракта левого желудочка у пациента с болями в сердце
- •Бенчмаркинг – инновационная технология модернизации рынка медицинских услуг
- •«Гипертония на рабочем месте» современного руководителя первичного звена здравоохранения
- •Новая шкала прогнозирования кардиоваскулярного риска у больных артериальной гипертензией в общей врачебной практике
- •Распределение больных по группам кардиоваскулярного риска
- •Шкала суммарной бальной оценки наличия высокого и очень высокого сердечно-сосудистого риска у больных аг
- •Диагностическая ценность шкалы суммарной бальной оценки наличия высокого и очень высокого сердечно-сосудистого риска у больных аг
- •Дифференциальный подход врача первичного звена к диагностике и выбору тактики лечения хронического геморроя
- •Хронический миофасциальный болевой синдром тазового дна в практике врача-проктолога
- •Выявление зависимости плотности костей скелета от габаритного и компонентного уровня варьирования у студентов в целях профилактики остеопороза
- •Гендерные различия показателей плотности костей
- •Внутренняя картина болезни пациента в практике врача первичного звена здравоохранения
- •Психоэмоциональный стресс – социально-значимая патология руководителей муниципального здравоохранения
- •Трудный пациент: хроническая эозинофильная пневмония
- •«Синдром эмоционального выгорания» у врачей как важнейшая составляющая профессиональной деформации
- •Новый взгляд на желчнокаменную болезнь
- •Болезнь гоше (наследственный дефицит активности
- •Использование ромипластима в качестве предоперационной подготовки больных идиопатической тромбоцитопений при выполнении плановой спленэктомии
- •К вопросу о диагностике туберкулезного лимфаденита
- •Результаты анализа архивных данных гистологических исследований клиники РостГму с 2002 по 2012 год.
- •Диагностика мегалобластной анемии и фуникулярного миелоза
- •Для заметок
Случай гипертрофической кардиомиопатии с обструкцией выносящего тракта левого желудочка у пациента с болями в сердце
Сидоров Р. В., Долтмурзиева Н. С., Ерошенко О. Л., Моргунов М.Н.
Ростовский государственный медицинский университет, Ростов-на-Дону
На сегодняшний день гипертрофическая кардиомиопатия является актуальной проблемой современной кардиологии и терапии. Это объясняется следующими причинами: во-первых, существующим мнением о редкой встречаемости данного заболевания, хотя результаты эпидемиологических исследований (например, CARDIA) свидетельствуют о заболеваемости в популяции данной патологии 1:500, что в расчете на российскую популяцию составляет около 285000 пациентов ГКМП; во-вторых, в практической медицине диагностика данной патологии является во многих случаях поздней, что во многом связано с недостаточным уровнем знаний практических врачей о диагностических аспектах данной патологии, несмотря на то что в 2003 г. появился международный экспертный консенсусный документ по ГКМП (ACC/ESC); в третьих, клиническая картина и данные осмотра не являются специфичными и часто приходится проводить дифференциальную диагностику среди множества разнообразной кардиальной патологии.
Актуальность данной патологии связана с наличием проградиентного течения заболевания у ряда пациентов с ГКМП и развитием смертельных осложнений (нарушений ритма сердца, внезапной сердечной смерти, хронической сердечной недостаточности – ХСН). Наконец, очень мало данных по изучению длительного наблюдения за пациентами с ГКМП, результатами лечения данной патологии и их исходами, особенно в Российской Федерации.
Гипертрофическая кардиомиопатия (ГКМП) – заболевание, характеризующееся генетическими нарушениями в кардиомиоцитах, нарушением диастолической функции и асимметричной гипертрофией левого и/или правого желудочка, было впервые описано Teare в 1958 г.
Наличие первичного генного дефекта, неблагоприятный генетический фон, факторы внешней среды приводят к развитию гипертрофии миокарда (локальной или симметричной) перегородки, верхушки, правого или левого желудочка (ЛЖ). Характерными признаками ГКМП являются специфические гистологические изменения с нарушением взаимной ориентации мышечных волокон, изменением формы ядра с появлением перинуклеарного нимба, резко выраженной гипертрофией волокон с образованием рядов с тенденцией к завихрениям, наличием клеточного фиброза.
Целью нашего сообщения является наблюдение за пациентом с обструктивной формой ГКМП, оценка значимости клинических и инструментальных данных.
Пациент Т., 45 лет, поступил в кардиохирургическое отделение клиники Ростовского государственного медицинского университета (РостГМУ) в октябре 2012 года с жалобами на боли за грудиной сжимающего характера, одышку при ходьбе до 250–300 м, учащенное ритмичное сердцебиение, сопровождающееся слабостью, головокружение, однократный эпизод потери сознания на фоне физической активности.
Из анамнеза заболевания было известно, что с подросткового возраста у пациента во время диспансерного наблюдения при аускультации сердца определялся шум. Впервые синкопальное состояние на фоне интенсивной физической активности больной перенес в сентябре 2012 года. Несмотря на этот эпизод, пациент за медицинской помощью не обращался. Значительное ухудшение состояния возникло 19 октября 2012 года, когда на фоне физической активности у пациента появились интенсивные пекущие боли за грудиной, сопровождающиеся одышкой, потливостью, слабостью. Пациент был госпитализирован в стационар по месту жительства, на основании данных клиники и электрокардиографического исследования (рис. 1) был поставлен предварительный диагноз острого коронарного синдрома с подъемом сегмента ST, который через сутки был заменен на диагноз Q–позитивного инфаркта миокарда передне-септально-апикальной области. В клинику медицинского университета пациент был направлен для выполнения коронароангиографии.
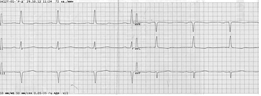
Рис. 1. Электрокардиограмма пациента Т. (19.10.2012 г.)
При объективном обследовании в кардиохирургическом отделении обращали на себя внимание данные аускультации сердца в виде систолического шума с максимальной интенсивностью в точке Боткина-Эрба, не проводящегося на сосуды шеи, вариабельного в зависимости от положения тела (шум уменьшался в горизонтальном положении). В ходе обследования в клинике РостГМУ данных, подтверждающих острое повреждение миокарда, не получено, количественный уровень МВ-фракции креатинфосфокиназы и тропонита Т не превышал допустимых значений. При электрокардиографическом исследовании (рис. 2) у пациента выявлены амплитудные критерии гипертрофии миокарда левого желудочка, признаки систолической перегрузки левого желудочка, а также патологические комплексы QS в отведениях V1–V4 с сохраняющимся подъемом сегмента ST более 2 мм. При сравнении с предыдущими электрокардиограммами изменений не отмечалось, что также противоречит диагнозу инфаркта миокарда передне-септально-апикальной области (отсутствует стадийность изменений).
 Рис.
2. Электрокардиограмма пациента
Рис.
2. Электрокардиограмма пациента
Пациенту выполнено эхокардиографическое исследование (31.10.2012). Исследование проводилось по стандартной методике на эхосканере Philips Envisor. В В- и М-режимах, режиме постоянноволновой допплерографии (CW-допплерография) и цветового допплеровского картирования были оценены следующие морфофункциональные параметры: толщина стенок правого и левого желудочков, размеры их полостей, состояние клапанного аппарата, показатели систолической и диастолической функции левого желудочка. В ходе исследования была выявлена асимметричная гипертрофия ЛЖ: толщина базального сегмента МЖП в диастолу (МЖПд) составила 20 мм, толщина срединного и апикального сегментов МЖПд – 14 мм, толщина миокарда в области верхушки ЛЖ – 15 мм, толщина задней стенки ЛЖ – 12 мм, индекс асимметрии – 1,6. Размер ЛП – 43 мм, размеры полости ЛЖ и показатели систолической функции оставались в пределах нормативных: КДР 48 мм, КСР 31 мм, ФВ 62%. При оценке характера движения митрального клапана в М-режиме было выявлено преднесистолическое движение передней створки (ПС МК) и её диастолическое касание МЖП (рис. 3).

Рис. 3. Переднесистолическое движение передней створки митрального клапана
Оценка структуры и характера движения створок АК указывала на отсутствие структурных изменений створок: створки три, тонкие подвижные, раскрытие в систолу составило 21 мм, систолический поток на АК максимальной скоростью 1,5 м/с, максимальный градиент 9 мм рт. ст., в М-режиме зарегистрировано средне-ситолическое прикрытие створок АК и их систолическое дрожание. В режиме CW-допплерографии в выходном тракте ЛЖ отмечено ускорение систолического потока до 3,22 м/с, пиковый градиент составил 41 мм рт. ст., что соответствует обструкции кровотока в выносящем тракте. В диастолу на МК регистрировалась струя регургитации 1 степени. Показатели диастолической функции ЛЖ: Е/А трансимитрального потока 0,7, время замедления пика Е 210 мс, время изоволюметического расслабления 100 мс. На основании полученных результатов нами было дано следующее заключение: эхокардиографическая картина соответствует асимметричной форме гипертрофической кардиопатии с обструкцией выходного тракта ЛЖ, диастолическая дисфункция ЛЖ 1 типа, расширение ЛП, недостаточность МК 1 степени.
При анализе данных суточного мониторирования ЭКГ диагностических критериев ишемии миокарда в виде преходящего смещения сегмента ST более 1 мм получено не было. Однако отмечалась частая вентрикулярная экстрасистолия высоких градаций по Lоwn, эпизодами по типу би- и тригеминии (рис. 4). Такое относительно большое количество желудочковых нарушений ритма связано, по всей видимости, со значительным фиброзом и разволокнением миокарда, являющимися типичными патоморфологическими признаками ГКМП. Пароксизмов желудочковой тахикардии в ходе исследования не зарегистрировано.
В
связи с наличием синдрома стенокардии
пациенту выполнена коронаровентрикулография,
не выявившая гемодинамически значимого
стенозирования коронарных артерий.
Однако при выполнении вентрикулографии
л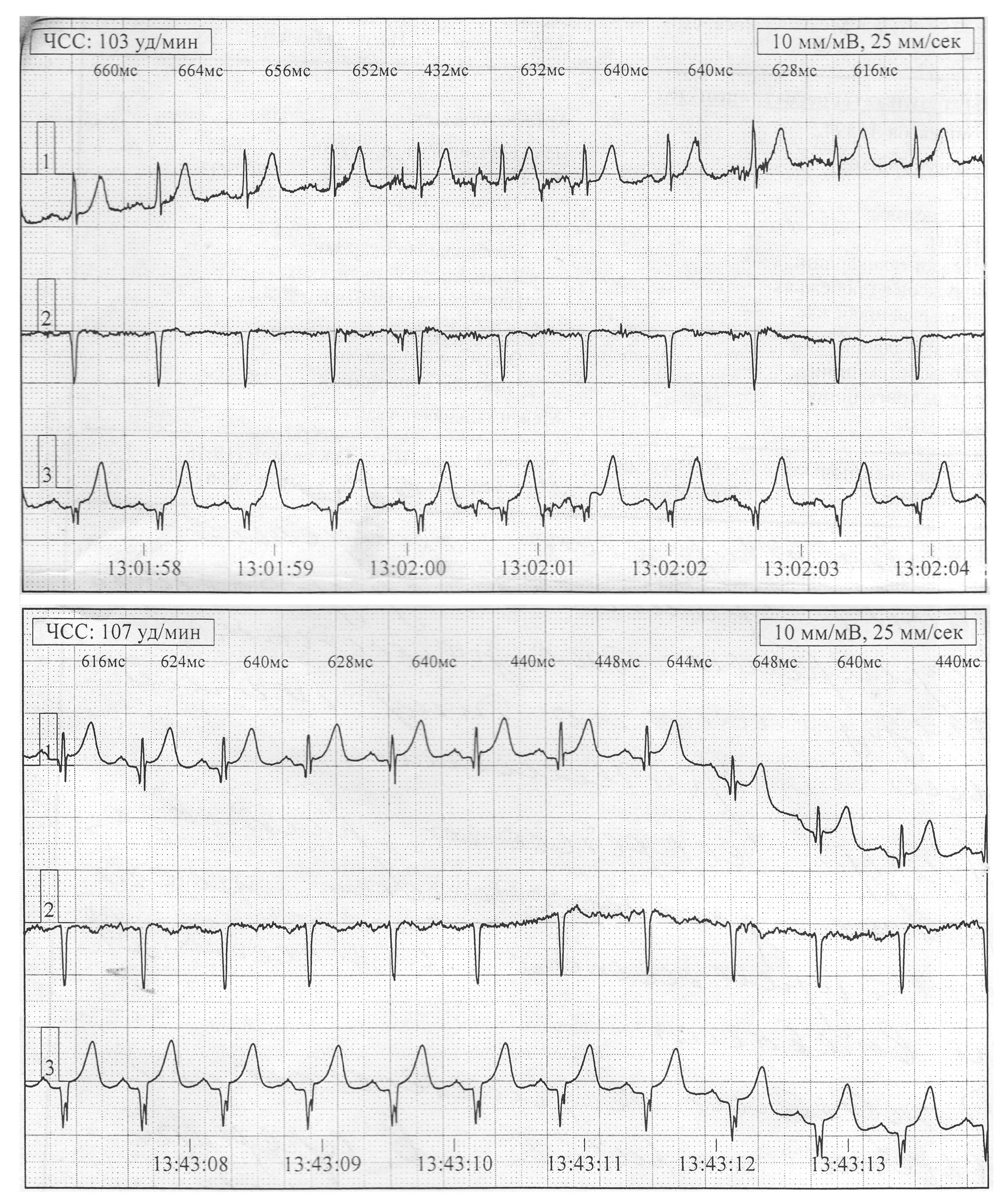 евого
желудочка отмечалось сужение выносящего
тракта левого желудочка.
евого
желудочка отмечалось сужение выносящего
тракта левого желудочка.
Рис. 4. Данные суточного мониторирования ЭКГ пациента Т. (01.11.2012 г.)
Таким образом, на основании данных клиники, физикального исследования и инструментальных методов диагностики, включающих электрокардиографию, эхокардиографическое исследование, суточное мониторирование ЭКГ и коронаровентрикулографию, пациенту был поставлен диагноз: идиопатическая гипертрофическая кардиомиопатия с обструкцией выносящего тракта левого желудочка, III стадия по NYHA. Назначена комбинированная терапия бета-блокаторами (метопролола сукцинат) и недигидропиридиновыми антагонистами кальция (верапамил). Выбор комбинированной терапии был обусловлен необходимостью выраженного отрицательного хроно- и инотропного действия медикаментозной терапии при данной патологии и невозможностью титрования доз препаратов в режиме монотерапии, учитывая нормотензию у пациента (средние цифры артериального давления 110/80–105/70 мм рт. ст.).
Выводы
1. ГКМП остается нозологией, сложной для диагностики и лечения в клинической практике и по настоящее время.
2. Метод ультразвукового исследования сердца с доплерометрией систолического потока в выходном тракте ЛЖ является самым важным в ранней диагностики кардиомиопатий и рекомендуется всем пациентам с подозрением на ГКМП с субаортальной обструкцией.
2. Необходимо совершенствовать методы ранней диагностики и лекарственной терапии при ГКМП, а также своевременно выявлять осложнения данного заболевания для улучшения прогноза у таких больных.
3. Остаются нерешенными ряд вопросов: изучение распространенности ГКМП в России, степени распространенности ХСН при данной патологии, расширение возможностей генетических анализов для точной диагностики ГКМП, применение ИАПФ при стабильном течении ГКМП, ранняя диагностика в детском и юношеском возрасте, что требует преемственности между педиатрами и кардиологами.
Список литературы
Якушин С. С., Филиппов Е. В. Гипертрофическая кардиомиопатия: результаты пятилетнего наблюдения // Болезни сердца и сосудов. – 2006. Т. 2. № 2.
Ультразвуковое исследование сердца и сосудов / Под ред. О. Ю. Атькова. – М.: Эсмо, 2009.
Barry J. Maron, William J. Mckenna, A Report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the European Society of Cardiology Committee for Practice Guidelines // Eur H Journal. – 2003; 15: 756–92.
Ferrans V. J., Morrow A. G., Roberts W. C. Myocardial ultrastructure in idiopathic hypertrophic subaortic stenosis. A study of operatively excised left ventricular outflow tract muscle in 14 patients // Circulation. – 1972; 45: 769–92.
Maron B. J., Roberts W. C. Quantitative analysis of cardiac muscle cell disorganization in the ventricular septum of patients with hypertrophic cardiomyopathy // Circulation. – 1979; 59: 689–706.
Maron B. J. Hypertrophic cardiomyopathy // Lancet. – 1997; 350: 127–33.
Maron B. J., Moller J. H., Seidman C. E. et al. Impact of laboratory molecular diagnosis on contemporary diagnostic criteria for genetically transmitted cardiovascular diseases: hypertrophic cardiomyopathy, long-QT syndrome, and Marfan syndrome. [A statement for healthcare professionals from the Councils on Clinical Cardiology, Cardiovascular Disease in the Young, and Basic Science, American Heart Association] // Circulation. – 1998; 98: 1460–71.
Maron B. J. Hypertrophic cardiomyopathy: a systematic review // JAMA. – 2002; 287: 1308–20.
Spirito P., Seidman C. E., McKenna W. J., Maron B. J. The management of hypertrophic cardiomyopathy // N Engl J Med. – 1997; 336: 775–85.
Teare D. Asymmetrical hypertrophy of the heart in young adults // Br Heart J. – 1958; 20: 1–18.
Wigle E. D., Sasson Z., Henderson M. A. et al. Hypertrophic cardiomyopathy. The importance of the site and the extent of hypertrophy. A review // Prog Cardiovasc Dis. – 1985; 28: 1–83.
Maron B. J., Spirito P. Implications of left ventricular remodeling in hypertrophic cardiomyopathy // Am J Cardiol. –ы 1998; 81: 1339–44.
Fuster V., Ryden L. E., Asinger R. W. et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology // EurHeart J. – 2001; 22: 1852–923.
