
- •Національна академія наук україни Інститут біології клітини нан України
- •Про науково-дослідну роботу відділу молекулярної генетики та біотехнології за 2012 рік
- •Ідентифікація нових генів, задіяних в контролі толерантності дріжджів до етанолу
- •Вплив генів, що викликають надсинтез глутатіону, на толерантність дріжджів до етанолу
- •3. Ідентифікація генів, що контролюють стійкість дріжджів до вищих спиртів
- •Вивчення ролі генів, що визначають стійкість до індукторів оксидативного стресу, у синтезі глутатіону.
- •24 Год Intra Intra 48 год 24 год Extra 48 год Extra Вміст gsHextra, нмоль/од590
- •2. Програмно-цільова та конкурсна тематика нан України
- •2.1. Тематика, що виконувалась за завданнями цільових програм прикладних досліджень.
- •VII. Конференції, семінари, з’їзди тощо.
- •VIII. Створення та використання об’єктів інтелектуальної власності.
- •IX. Видавнича діяльність
- •XI. Закордонні відрядження у 2012 році:
- •XV. Розвиток матеріально-технічної бази досліджень.
- •XVI. Стан інформаційного забезпечення відділу
24 Год Intra Intra 48 год 24 год Extra 48 год Extra Вміст gsHextra, нмоль/од590
Рис. 28 Вміст внутрішньоклітинного (GSHintra) та позаклітинного (GSHextra) GSH в інсерційних мутантів 2А-17, 3А-6, 4А-27, 4А-31, що містять одну копію інсерційної касети в геномі, порівняно з диким типом Н. роlymorpha NCYC495 (495 YFP) і штамом-реципієнтом NCYC495 leu1-1 при рості на мінімальному середовищі з глюкозою при 370С (середні значення 3-5 експериментів).
Отримані
результати вказують на те, що всі
MNNGR
Н2О2S
СdS
інсерційні мутанти,
які містили одну копію інсерційної
касети, характеризувалися зниженим
рівнем внутрішньоклітинного та
позаклітинного GSH
у 3-30 разів. Виділення
інсерційної касети pL2
з фрагментами геномної ДНК пошкоджених
генів проводили після
часткового
гідролізу
геномної ДНК
інсерційних мутантів
H.
polymorpha
ендонуклеазою рестрикції Sau3A
та самолікування
отриманих фрагментів. З геномної ДНК
штамів 4А-27, 4А-31, 3А-6 було виділено плазміди
більшої молекулярної маси ніж плазміда
pL2
та проаналізовано їх за допомогою ПЛР
аналізу. С
Іншим напрямком роботи був відбір інсерційних мутантів H. polymorpha резистентних до сполук прооксидантної дії та токсичних сполук, таких як пероксид водню (Н2О2), іони кадмію (Cd2+), 1-хлор-2,4-динітробензен (CDNB) та різних варіантів їх сумішей. Трансформантів відбирали з зони інгібування росту, яка утворювалася навколо диска з певною токсичною сполукою (рис. 29).
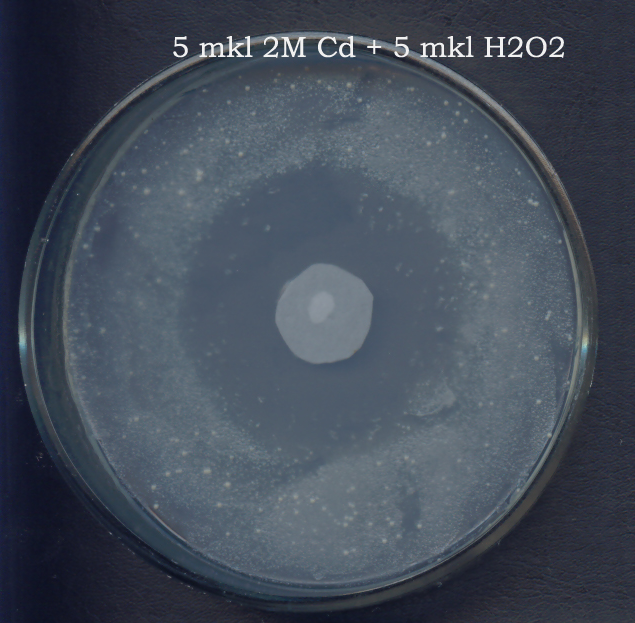

Р
Відібрані Н2О2RCdR інсерційні мутанти додатково були перевірені на резистентність до сполук прооксидантної дії (Н2О2, Cd2+, CDNB), а також на чутливість до формальдегіду (Fd). Оскільки інсерційні мутанти були відібрані як такі, що імовірно мають підвищений рівень синтезу GSH, вони мали би характеризуватися більшою резистентністю до дії Fd порівняно із штамом дикого типу. Чутливість до формальдегіду перевіряли крапельним тестом, наносячи радіально на чашки з мінімальним середовищем суспензію клітин певної оптичної густини (ОД = 0,5 та 1,0). Через 20-24 год в центр чашки поміщали диск з фільтрувального паперу, на який наносили 2,5 mM Fd, 5-6 год витримували при t = 40C, для того щоб він дифундував у середовище, після чого ставили в термостат на 370C, через 5-6 діб оцінювали інтенсивність росту. Після перевірки 108 Н2О2RCdR CDNBR інсерційних мутантів було відібрано відібрано вісім (14-5:5, 14-5:7, 14-9:2, 14-9:8, 16-27:3, 16-27:5, 16-80:3, 16-80:5), які проявили найбільшу резистентність до Fd (FdR) на різних середовищах. Відомо, що при рості на гліцерині Fd за участю фермента формальдегідредуктази відновлюється до метанолу, а потім за участю алкогольоксидази знову окислюється до формальдегіду, тому при використанні гліцерину як джерела вуглецю пул Fd є більшим порівняно з глюкозою, яка репресує активність алкогольоксидази та формальдегідредуктази, ферментів залучених в дисиміляційний шлях Fd. Для перевірки рівня внутрішньоклітинного GSH цих мутантів був проведений ростовий експеримент (90 год), проби на визначення GSH відбирали з інтервалом ~ 20 год. Результати експерименту показали, що у двох Н2О2RCdR CDNBR FdR інсерційних мутантів ( 14-9:8 та 14-5:5) вміст GSH був вищим ніж у штама дикого типу H. polymorpha NCYC495 (YFP) на 48 та 69 год росту. Для подальшого дослідження цих штамів проводили короткотривалий інкубаційний експеримент з Fd. В попередніх дослідженнях було показано, що Fd здійснює позитивну регуляцію експресії гена HpGSH2, що є гомологічним до GSH1 S. cerevisiae. Оскільки ми намагаємося отримати мутанти з пошкодженою негативною регуляцією біосинтезу GSH, був використаний Fd як індуктор транскрипційних факторів, залучених в позитивну регуляцію його синтезу. Отримані результати вказують на те, що концентрація Fd 4 мМ в середовищі призводить до часткового лізису клітин, однак під дією Fd штам 16-27:5 здатний синтезувати в 2,5 рази більше GSH порівняно із штамами дикого типу за тих же умов. Це може свідчити про порушений механізм регуляції синтезу цього трипептиду в клітинах мутантного штама (рис.30).
Подальша ідентифікація кількості копій інсерційної касети в геномі мутантного штама H. polymorpha 16-27:5 за допомогою Саузерн-аналізу та секвенування пошкоджених генів дадуть можливість оцінити їх можливий вплив на регуляцію метаболізму GSH в клітині дріжджів.
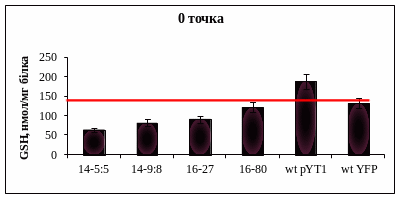

Рис. 30. Вміст внутрішньоклітинного GSH (GSHintra) у Н2О2R CdR CDNBR FdR інсерційних мутантів 14-5:5, 14-9:8, 16-27:5, 16-80:5 та штамів дикого типу WT pYT1, WT YFP) в умовах 3 год інкубації на мінімальному середовищі з глюкозою та Fd (усереднені дані двох експериментів).
Література:
Costa V, Amorim MA, Reis E, Quintanilha A, Moradas-Ferreira P Mitochondrial superoxide dismutase is essential for ethanol tolerance of Saccharomyces cerevisiae in the post-diauxic phase // Microbiology.- 1997. –Vol.143 ( Pt 5). –P.1649-56.
Du X., Takagi H.N-Acetyltransferase Mpr1 confers ethanol tolerance on Saccharomyces cerevisiae by reducing reactive oxygen species // Appl Microbiol Biotechnol. – 2007. – Vol. 75(6). – P. 1343-1351.
Griffith, O.W. Biologic and pharmacologic regulation of mammalian
glutathione synthesis // Free Radical Biology and Medicine. – 1999. –
Vol.27(9–10). – P.922–935.
Kiel JA, Rechinger KB, van der Klei IJ, Salomons FA, Titorenko VI, Veenhuis M The Hansenula polymorpha PDD1 gene product, essential for the selective degradation of peroxisomes, is a homologue of Saccharomyces cerevisiae Vps34p // Yeast. -1999. – Vol. 15, N9. – P.741–754.
Mollapour M., Shepherd A. and Piper P.W. Presence of the Fps1p aquaglyceroporin channel is essential for Hog1p activation, but suppresses Slt2(Mpk1)p activation, with acetic acid stress of yeast // Microbiology. – 2009. – Vol.155. – Р. 3304–3311.
Nomura M., Takagi H. Role of the yeast acetyltransferase Mpr1 in oxidative stress: regulation of oxygen reactive species caused by a toxic proline catabolism intermediate // Proc Natl Acad Sci U S A. – 2004. – Vol. 101(34). – P. 12616-12621.
Passmore L.A., Barford D. Getting into position: the catalytic mechanisms of protein ubiquitylation // Biochem J. – 2004. – Vol. 379(Pt 3). – P. 513-525.
Piper P.W. The heat shock and ethanol stress responses of yeast exhibit extensive similarity and functional overlap / P.W. Piper // FEMS Microbiol Lett. – 1995. – Vol. 134(2-3). – P. 121-127.
Pugh D.J., Ab E., Faro A. et al. DWNN, a novel ubiquitin-like domain, implicates RBBP6 in mRNA processing and ubiquitin-like pathways // BMC Struct Biol. – 2006. – Vol. 5. – P. 6:1.
Takahashi T, Shimoi H, Ito K (2001) Identification of genes required for growth under ethanol stress using transposon mutagenesis in Saccharomyces cerevisiae. Mol Genet Genomics 265(6):1112–1119
Teixeira, Miguel C.; Raposo, Luis R.; Mira, Nuno P.; et al. Identification of Saccharomyces cerevisiae Genes Required for Maximal Tolerance to Ethanol // Appl. Environm. Microbiol. - Vol. – 75, N 18/ - P. 5761-5772.
Ubiyvovk VM, Blazhenko OV, Gigot D, Penninckx M, Sibirny AA (2006) Role of gamma-glutamyltranspeptidase in detoxification of xenobiotics in the yeasts Hansenula polymorpha and Saccharomyces cerevisiae. Cell Biol Int 30:665–671
Ubiyvovk VM, Nazarko TY, Stasyk OG, Sohn MJ, Kang HA, Sibirny AA (2002) GSH2, a gene encoding gamma-glutamylcysteine synthetase in the methylotrophic yeast Hansenula polymorpha. FEMS Yeast Research 2:327–332
Ubiyvovk VM, Telegus YV, Sibirny AA (1999) Isolation and characterization of glutathione deficient mutants of the methylotrophic yeast Hansenula polymorpha. Microbiology (Moscow) 68:33–39
