
- •1 Описание cvd-метода
- •1.1 Процессы
- •1.1.1 Основные реакции диссоциации карбонилов металлов
- •1.1.2 Основные реакции диссоциации галогенидов металлов
- •1.2 Установка для нанесения покрытий cvd методом
- •1.3 Области применения cvd-покрытий
- •2 Механизмы роста тонких пленок
- •2.1 Механизмы роста пленок на подложках
- •2.2 Структура пленок
- •1Μmmmmmmmmmmmььmm
- •3 Методы исследования
- •3.1 Конфокальная микроскопия
- •3.2 Электронная микроскопия
- •3.2.1 Трансэмиссионная (просвечивающая) микроскопия
- •3.2.2 Растровая (сканирующая) микроскопия
- •3.3 Физические методы
- •3.3.1 Магнитный метод
- •3.3.2 Токовихревой метод
- •3.3.3 Акустический метод
- •3.4 Механические испытания
- •3.4.1 Нанотвердомер
- •3.4.2 Машина трения
- •3.4.3 Высокотемпературная машина трения
- •3.4.4 Скратч – тестер
- •3.4.5 Импакт – тестер
- •4 Краткое описание технологического процесса
РЕФЕРАТ
Пояснительная записка содержит: 92 с., 40 рис., 16 табл., 22 лит. ист.
CVD-МЕТОД, ЗАЩИТНЫЕ ПЛЕНКИ, CVD-УСТАНОВКА, РОСТ ТОНКИХ ПЛЕНОК, МЕТОДЫ ИССЛЕДОВАНИЯ, ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ
Работа представляет собой раздел методического пособия, посвященного современным технологиям нанесения защитных пленок и покрытий. Цель работы – рассмотреть процесс получения пленок и покрытий CVD-методом, конструкцию CVD-установки, применение изделий с защитными покрытиями, а так же методы исследования свойств пленок.
В работе приведено описание процессов получения тонких пленок, конструкция установки для получения CVD-пленок, применение готовых изделий, особенности роста и структуры пленок на подложках, предложены методы исследования свойств пленок.
Коротко описан технологический процесс получения CVD-покрытий на твердосплавных изделиях.
Рассмотрены вопросы охраны труда и экологии, разработан сетевой график выполнения работы и определены затраты на разработку методического пособия.
THE ABSTRACT
СОДЕРЖАНИЕ
ЗАДАНИЕ……………………………………………………………………….2 |
РЕФЕРАТ………………………………………………………………………..3 THE ABSTRACT………………………………………………………………..4 |
ВВЕДЕНИЕ……………………………………………………………………..7 |
1 ОПИСАНИЕ CVD-МЕТОДА …………………………………………….…8 |
1.1 Процессы …………………………………………………………….8 1.1.1 Основные реакции диссоциации карбонилов металлов……..8 1.1.2 Основные реакции диссоциации галогенидов металлов……..12 |
1.2 Установки для нанесения покрытий……………………………...15 |
1.3 Области применения CVD-покрытий……………………………..17 |
2 РОСТ ТОНКИХ ПЛЕНОК………………………………………………….23 |
2.1 Механизмы роста пленок на подложках………………………….23 |
2.2 Текстура в пленках…………………………………………………29 |
3 МЕТОДЫ ИССЛЕДОВАНИЯ ПОКРЫТИЙ……………………………....32 |
3.1 Конфокальная микроскопия……………………………………….32 |
3.2 Электронная микроскопия…………………………………………33 |
3.2.1 Трансэмиссионная (просвечивающая) микроскопия………....35 3.2.2 Растровая (сканирующая) микроскопия……………………….37 3.3 Физические методы………………………………………………...41 |
3.3.1 Магнитный метод…………………………………………….....41 |
3.3.2 Токовихревой метод…………………………………………….42 |
3.3.3 Акустический метод…………………………………………….42 |
3.4 Механические испытания………………………………………….44 |
3.4.1 Нанотвердомер……………………………………………….…44 |
3.4.2 Машина трения………………………………………………….46 |
3.4.3 Высокотемпературная машина трения………………………...47 |
3.4.4 Скратч–тестер………………………………………………...…49 3.4.5 Импакт-тестер…………………………………………………...51 4 КРАТКОЕ ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА НАНЕСЕНИЯ CVD-ПОКРЫТИЙ НА КИРОВГРАДСКОМ ЗАВОДЕ ТВЕРДЫХ СПЛАВОВ……………………………………………………………………..54 5 ОРГАНИЗАЦИОННО-ЭКОНОМИЧЕСКАЯ ЧАСТЬ ЭКСПЕРИМЕТА………………………………………………………………………………58 |
5.1 Краткое описание эксперимента…………………………………..58 |
5.2 Планирование научно – исследовательской работы……………..58 |
5.3 Построение сетевого графика……………………………………...61 |
5.3.1 Установление логической связи между работами……………61 |
5.3.2 Временная оценка продолжительности работ………………...62 |
5.3.3 Построение сетевого графика………………………………….63 |
5.3.4 Расчет параметров сетевого графика………………………….64 |
5.4 Смета затрат на проведение НИР…………………………………64 |
5.4.1 Затраты по статье расходов «материалы»…………………….65 |
5.4.2 Затраты на электроэнергию……………………………………65 |
5.4.3 Затраты по статье «Амортизация»…………………………….66 |
5.4.4 Затраты на заработную плату………………………………….66 |
5.4.5 Затраты по статье «ЕСН»………………………………………67 |
5.4.6 Накладные расходы…………………………………………….67 |
5.4.7 Смета затрат на проведение исследований…………………...67 |
5.5 Оценка эффективности НИР………………………………………68 |
6 БЕЗОПАСНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ…………………………….69 |
6.1 Введение…………………………………………………………….69 |
6.2 Описание объекта дипломирования………………………………70 |
6.3 Безопасность труда…………………………………………………71 |
6.3.1 Опасные производственные факторы………………………....74 |
6.3.2 Вредные производственных факторы…………………………75 |
6.4 Эргономичность………………………………..……………….......77 |
6.5 Пожарная безопасность…………………………………………….79 |
6.7 Чрезвычайные ситуации…………………………………………...79 |
6.8 Выводы……………………………………………………………...83 |
7 ПРИРОДОПОЛЬЗОВАНИЕ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ…..84 |
7.1 Действие электромгнитного излучения…………….……...……..84 |
7.2 Защита от электромагнитного излучения………………………...84 |
7.3 Выводы……………………………………………………………...88 |
ЗАКЛЮЧЕНИЕ………………………………………………………………..89 |
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ ………………………...90 |
ВВЕДЕНИЕ
Важным, бурно развивающимся направлением науки о материалах является инженерия поверхности применительно к созданию функциональных наноструктурных пленок и покрытий.
В настоящее время один из самых распространенных методов для нанесения износостойких покрытий на режущий инструмент является метод химического осаждения из парогазовой фазы (ХОП) или CVD-метод (Chemical Vapour Deposition) [1].
Метод химического осаждения (CVD) практически не имеет ограничений по химическому составу покрытий. Все присутствующие частицы могут быть осаждены на поверхность материала. Какие покрытия при этом образуются, зависит от комбинации материалов и параметров процесса. В ходе процесса CVD в реактор подается смесь газов. При этом происходит химическая реакция между атомами осаждаемых металлов и молекулами реакционного газа на или около поверхности покрываемого материала. Состав покрытия зависит от парциального давления реакционного газа и скорости осаждения покрытия.
CVD процессы происходят при давлениях между 100 и 1000 Па. В результате обеспечивается нанесение покрытия на всю поверхность изделия. Для получения одинаковых свойств покрытия во всем объеме реактора необходимо обеспечить оптимальные потоки газа. Для этого применяется специальная система подачи газа, так называемый газовый душ. Установки CVD имеют довольно большой размер. Для предотвращения опасных выбросов газов в атмосферу требуется система фильтров.
Благодаря высокой подвижности и интенсивности процессов массопереноса, присущих газообразным средам, метод CVD покрытий обладает исключительной "кроющей" способностью. Возможность обеспечивать высокие массовые потоки металлсодержащего соединения в газообразном состоянии к покрываемой поверхности позволяет реализовать высокую производительность процессов нанесения покрытия, в которых скорость роста может достигать от нескольких сотен микрон в час до нескольких миллиметров в час.
Относительная простота очистки от большинства примесных элементов на стадии получения металлсодержащих соединений благодаря избирательности процессов химического взаимодействия исходных продуктов на нагретой поверхности, дополнительная дистилляция в процессе его перевода в газообразное состояние из твердого или жидкого состояния, в котором эти соединения обычно находятся при нормальных условиях, обусловливают высокую степень чистоты получаемых CVD методом покрытий [2].
Таким образом, среди известных методов нанесения покрытий высокого качества методы CVD находится вне конкуренции в большинстве случаев, когда необходимо наносить равномерные по толщине, высокоплотные покрытия на изделия сложной формы с развитой поверхностью, в том числе, на внутренние поверхности, протяженные и глухие полости, отверстия и трубы.
1 Описание cvd-метода
1.1 Процессы
Формирование покрытий CVD методом происходит за счет протекания на нагретой поверхности изделий гетерогенных процессов разложения (водородного восстановления) металлсодержащих химических соединений (карбонилы металлов, иодидные или хлоридные соединения) находящихся в реакционном объеме в газообразном состоянии. [1]
Благодаря высокой подвижности и интенсивности процессов массопереноса, присущих газообразным средам, метод CVD покрытий обладает исключительной "кроющей" способностью. Возможность обеспечивать высокие массовые потоки металлсодержащего соединения в газообразном состоянии к покрываемой поверхности позволяет реализовать высокую производительность процессов нанесения покрытия, в которых скорость роста может достигать от нескольких сотен микрон в час до нескольких миллиметров в час.
Относительная простота очистки от большинства примесных элементов на стадии получения металлсодержащих соединений благодаря избирательности процессов химического взаимодействия исходных продуктов на нагретой поверхности, дополнительная дистилляция в процессе его перевода в газообразное состояние из твердого или жидкого состояния, в котором эти соединения обычно находятся при нормальных условиях, обусловливают высокую степень чистоты получаемых CVD методом покрытий. [1]
1.1.1 Основные реакции диссоциации карбонилов металлов
Карбонильные металлические покрытия представляют собой сложные образования, состоящие в основном из металла и его соеденений с углеродом и кислородом. Суммарное количество примесей этих элементов составляет 1…3 %, а в виде соединений с соответствующим металлом достигает 30 %.
Термическое разложение карбонилов металлов (реакция 1.1) в CVD-методе представляет собой сложный химический процесс, сопровождающийся рядом побочных реакций, обуславливающих содержание примесей в металле.
Mx(CO)y → xM + yCO (1.1)
Поэтому необходимо установить схему всех химических реакций, протекающих при образовании металла.
В число побочных реакций входят распад CO (реакция Белла-Будуара) и взаимодействие металла, оксидов и карбидов металла с CO и CO2.
Ниже
приведены результаты расчетов изменения
энергии Гиббса Δ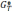 от температуры в интервале 300…1000 0С
для реакций, протекающих при термическом
разложении карбонилов металлов V,
VI,
VII
и VIII
групп. Сначала рассматриваются основные
реакции (распад карбонилов), а затем
побочные (с учетом основных реакций).
от температуры в интервале 300…1000 0С
для реакций, протекающих при термическом
разложении карбонилов металлов V,
VI,
VII
и VIII
групп. Сначала рассматриваются основные
реакции (распад карбонилов), а затем
побочные (с учетом основных реакций).
Изменение
энтальпии 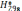 и энтропии
и энтропии 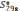 реакции
термической диссоциации карбонила
определяется из соотношений (1.2), (1.3):
реакции
термической диссоциации карбонила
определяется из соотношений (1.2), (1.3):
Δ = Σ конечных веществ - Σ карбонила металла (1.2)
Δ = Σ конечных веществ - Σ карбонила металла (1.3)
Результаты расчета функций Δ = f(T) для реакций термического разложения карбонилов металлов представлены на рисунке 1.1, который наглядно иллюстрирует термодинамические возможности образования металлов из карбонилов в интервале 200…1000 К.
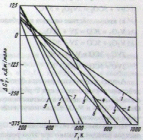
1 – Ni(CO)4; 2 – Fe(CO)5; 3 – Cr(CO)6; 4 – Mo(CO)6; 5 – W(CO)6; 6 – Co2(CO)8, 7 – Mn2(CO)10, 8 –Re2(CO)10, 9 – Os3(CO)12.
Рисунок 1.1 Функция Δ = f(T) для реакции термической диссоциации паров карбонилов металлов в CVD-процессах [1]
Из рисунка видно, что термодинамически наиболее склонны к термораспаду трехъядерные карбонилы, такие как Os3(CO)12, двухъядерные - Re2(CO)10 и Мn2(СО)10, одноядерные карбонилы металлов [1].
Ниже представлены схемы реакций (1.4)…(1.13) образования железа, из пентакарбонильного соединения, а так же побочные реакции образования примесей [1].
1) образование железа и его взаимодействие с СО (реакции (1.4)…(1.8)):
Fe(CO)5 = Fe + 5СО (1.4)
СО = 0,5СО2 + 0,5С (1.5)
3Fe + 4СО = Fe304 + 4С (1.6)
15Fe + 4CO = Fe304 + 4Fe3C (1.7)
6Fe + 2СО = 2Fe3C + С02 (1.8)
2) взаимодействие железа с С02 (реакции (1.9),(1.10)):
3Fe + 2С02 = Fe304 + 2С (1.9)
9Fe + 2С02 = Fe304 + 2Fe3C (1.10)
3) взаимодействие оксидов и карбидов железа с СО (реакции (1.4)…(1.8)):
Fe304 + 6СО = Fe3C + 5С02 (1.11)
Fe304 + 4СО = 3Fe + 4С02 (1.12)
Fe3C + 4СО = Fe304 + 5C (1.13)
Углерод может образовывать с железом твердые растворы переменной концентрации, а также карбиды железа, из которых наиболее изучен цементит Fe3C. Хотя известно также о существовании высших карбидов железа Fe2C и FeC, в современной диаграмме состояния Fe-C фигурирует только карбид Fe3C, карбид же Fe2C в силу малой возможности его образования даже при температурах выше 500 К не учитывается.
В связи с изложенным при термодинамическом рассмотрении побочных реакций, которые могут протекать на подложке при разложении пентакарбонила железа между твердой и газообразной фазами, мы ограничимся реакциями с участием магнетита Fe304 и цементита Fe3C. В случае распада Fe(CO)5 мы учитываем также нитрид железа Fe4N, поскольку часто процесс идет в присутствии NH3 [1].
Оценивая полученные нами величины изменения энергии Гиббса ΔGT рассмотренных реакций ((1.4)…(1.13)) с учетом особенностей карбонильного процесса, мы можем сделать следующие выводы.
Из реакции взаимодействия железа с СО (реакции (1.6)…(1.8)) при 500…600 К с наибольшей глубиной превращения протекает реакция (1.7), приводящая к образованию магнетита и цементита. Эта реакция, по-видимому, является основным процессом, обуславливающим наличие в образующихся пленках железа примесей связанных кислорода и углерода.
Реакция (1.6), приводящая к образованию примесей магнетита и элементарного углерода, формально также протекает с большой глубиной превращения. Однако нетрудно увидеть, что уравнение (1.6) является суммой учетверенного уравнения (1.5) и уравнения (1.12) с обратным знаком, т.е. оно выражает результирующий процесс распада СО и окисления железа образовавшимся при этом диоксидом углерода. Из них первая реакция в рассматриваемом интервале температур протекает достаточно глубоко, а вторая практически невозможна. Поэтому реакция (1.6) не отражает действительной картины взаимодействия железа с СО и ее не следует принимать во внимание.
Реакция (1.11), по-видимому, протекает, в действительности, как дополнительный процесс, обуславливающий появление в железных покрытиях добавочных количеств цементита, а в газе разложения - примесей С02. Реакция (1.9), приводящая к образованию магнетита и элементарного углерода, формально протекает с большой глубиной превращения. Однако уравнение (1.9) является суммой удвоенного уравнения (1.5) и уравнения (1.12) с обратным знаком. Поэтому, как и уравнение (1.6), его не надо принимать во внимание.Таким образом, реакции взаимодействия железа с С02 в реальных условиях процесса термического разложения Fe(CO)5, вероятнее всего, не имеют места.
Согласно расчетам, реакция взаимодействия железа с аммиаком, приводящая к образованию нитрида Fe4N и водорода, в рассматриваемых условиях процессов протекает с небольшой глубиной превращения. В действительности, железные покрытия, полученные в присутствии аммиака, всегда содержат азот, связанный с металлом. Это указывает на то, что процесс воздействия аммиака на железо протекает более сложно, например с образованием карбонитридов железа. В дальнейшем изложении принимаем, что взаимодействие железа с аммиаком протекает по уравнению (1.14):
4Fe + NH3 = Fe4N + 1,5Н2 (1.14)
Реакция (1.12), приводящая к образованию элементного железа и С02, идет с малой глубиной превращения и ее можно не принимать во внимание. Реакция взаимодействия магнетита с водородом, приводящая к образованию элементного железа и воды, протекает с малой глубиной превращения и также не принимается во внимание.
Реакция распада СО (1.5) при 500…600 К протекает с большой глубиной превращения и имеет место, когда процесс термического разложения пентакарбонила железа проводится в отсутствие аммиака. В этом случае реакция (1.5) обуславливает наличие в железных покрытиях элементного углерода, а в газе разложения наряду с реакцией (1.11) идет реакция образования примеси С02.
Реакция распада аммиака при 500…600 К протекает достаточно глубоко и имеет место, когда процесс термического разложения Fe(CO)5 проводится в присутствии аммиака. Эта реакция обуславливает появление в газе разложения примесей азота и водорода.
На основании изложенного можно предложить следующую наиболее достоверную схему реакций, протекающих при получении железных пленок и покрытий из пентакарбонила железа:
1) процесс разложения Fe(CO)5 проводят в отсутствие аммиака по основной (1.4). Наряду с ней протекают побочные реакции (1.5), (1.7) и (1.11) между твердой и газообразной фазами, причем глубина превращения для реакции (1.7) существенно выше, чем для реакции (1.11). Этими побочными реакциями определяется наличие в железных покрытиях примесей магнетита, цементита и элементарного углерода, а в газе разложения - примеси С02;
2) процесс разложения Fe(CO)5 проводят в присутствии аммиака по основной реакции (1.4). Наряду с ней протекают побочные реакции (1.7) и (1.11) между твердой и газообразной фазами, причем глубина превращения для реакции (1.7) существенно выше, чем для реакции (1.11). Эти побочные реакции обуславливают наличие в железных покрытиях примесей магнетита, цементита и элементного углерода, а в газе разложения - примесь С02;
3) процесс разложения Fe(CO)5 проводят в присутствии аммиака по основной реакции (1.4). Наряду с ней протекают побочные реакции (1.7) и (1.11) между твердой и газообразной фазами, а также побочные реакции в газообразной фазе:
2NH3 = N2 + 3H2 (1.15)
2СО + 2Н2 = СН4 + CO2 (1.16)
СО + 3Н2 = СН4 + Н2O (1.17)
причем глубина превращения реакции (1.7) существенно выше, чем реакции (1.11).
Эти побочные реакции определяют наличие в железных покрытиях примесей магнетита, цементита и связанного азота, а в газе разложения - примеси С02, азота, водорода и небольших количеств метана и воды [1].
По такой же схеме можно получить покрытия из таких металлов как ванадий, хром, молибден, вольфрам, марганец, рений, осмий и рутений [1].
