
- •Камера сгорания как 1 из основных элементов гтд
- •Типы Камер сгорания.
- •3.Основные элементы камеры сгорания гтд
- •4.Основы теории горения. Формы горения. Вид пламени. Тепловой эффект реакции
- •Химическая кинетика. Термомеханические уравнения
- •Скорость хим реакций.
- •2 Вида горения газов в гомогенной системе:
- •Химическое равновесие. Константа хим равновесие, влияние т, р, с на нее
- •Уравнение Аррениуса. Распределение Максвелла-Больцмана.
- •Цепные реакции
- •Катализ. Особенности горения высокомолекулярных углеводородов
- •Основы теории воспламенения газовых смесей. Тепловое самовоспламенение
- •Воспламенение смеси в потоке. Реактор идеального смешения Лонгвелла
- •Реактор идеального смешения Лонгвелла
- •Вынужденное воспламенение( зажигание). Зажигание твс высокотемпературным телом. Искровое зажигание.
- •Зажигание твс высокотемпературным телом
- •Искровое зажигание
- •T0,t1,t2,t3-если не восплам.
- •3 Случая смеси:
- •Процесс распространения пламени. Процесс нормального распространения пламени в однородной смеси
- •Процесс нормального распространения пламени в однородной смеси.
- •Турбулентное горение однородной смеси.(Теория поверхностного горения Щелкина)
- •2) (Зубцы оч большие рисуем)
- •Ламинарное диффузионное пламя
- •Диффузионное турбулентное горение. Горение жидкого топлива
- •18. Образование вредных выбросов в процессе горения.
Химическая кинетика. Термомеханические уравнения
Хим. реакция – превращение одного или нескольких веществ в отличные от них по хим. составу продукты реакции.
В ядерной реакции 1 атом в другой превращается, а в химической теже атомы тока рекомбинируют
Суммарный эффект реакции можно записать:
топливо + окислитель продукты реакции
![]()
Данное выражение описывает только начало и конец процесса, а не его протекание.
Большинство реакций горения протекает через образование промежуточных продуктов реакции, которые бывают 2х типов:
1. Стабильные (СО, Н2, С2Н2 и т.д.)
2. Нестабильные (Н, ОН, О, СН)-радикалы
Промежуточные реакции, в которых топливо и окислитель превращаются в продукты реакции бывают 2х типов:
бимолекулярные реакции А+В C(слева 2)
![]()
тримолекулярные (в акте реагирования 3 ккомпонента)
Н+Н+М
![]() +M
+M
термомеханические уравнения
аА+вВ![]()
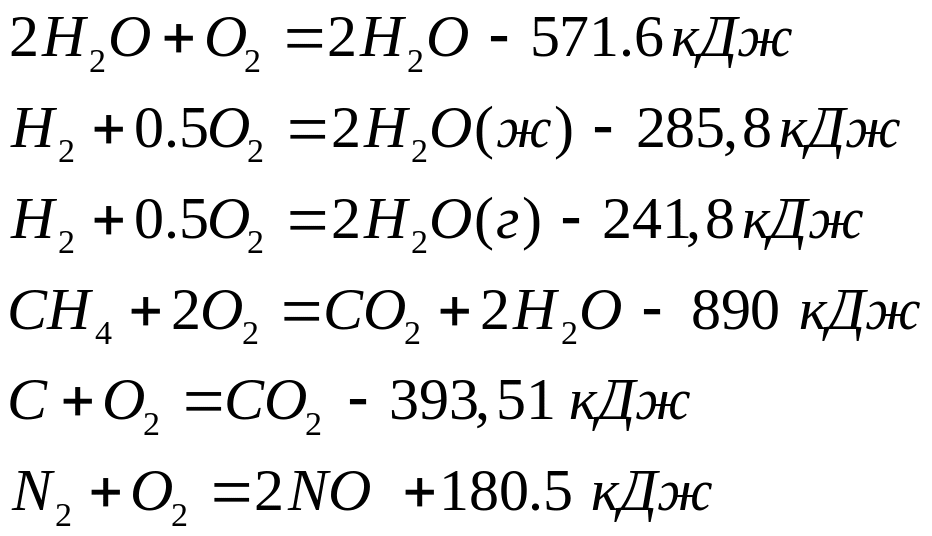 ур-я
от 1-го до 5 (начиная с н2о)
ур-я
от 1-го до 5 (начиная с н2о)
Особенностью термохимических уравнений является то что при работе с ними формулы веществ и результат можно перетаскивать справа влево и назад.
Допускается почленное сложение и вычитание веществ.
С+2Н2=СН4
Вычтем ур-я 5 и 1 из 4
СН4+СО2- О2-С- О2-2Н2- О2=О(-890+394+571.6=-76кДж)
Умножим на (-1) и СН4 вправо
Умножим обе части
С+2Н2= СН4 +76 кДж
Существуют два основных закона на которых основываются все термохимические расчёты:
1.Закон Лавуазье-Лапласа: тепловой эффект прямой реакции ≈ тепловому эффекту обратной реакции только с обратным знаком.
2.Закон Гесса: тепловой эффект реакции зависит только от конечного и начального состояния веществ и не зависит от промежуточной стадии процесса.
Пример закона Гесса:
СН4+2О2=СО2+2Н2О+Х кДж
СН4=С+2+2Н2 -74.85 кДж
С+О2=СО2 -393.51 кДж
2Н2+О2+2Н2О -2*241.82 кДж
СН4+2О2=СО2+2Н2О (-393.51-2*241.88+74.85=-802.3 кДж)
Скорость хим реакций.
Скорость хим реакций -это изменение концентрации реагентов веществ в единицу времени.
При рассмотрении вопроса о скорости хим. реакции необходимо различать реакции протекающие в гомогенной системе и в гетерогенной системе.
Гомогенная – система состоящая из веществ находящихся в одинаковом фазовом состоянии. Если реакция протекает в гомогенной системе то она может идти во всем объеме, если реакции протекает между веществами образую гетерогенную систему то она может идти на поверхности раздела фаз.
2 Вида горения газов в гомогенной системе:
1. горение при полном перемешивании
2. горение предварительно неперемеш.(диффузионное горение)
Скорость гомогенной реакции- количество вещества, вступающего в реакцию, за единицу времени, в единицу объема систем.
![]()
С![]() корость
гетерогенной реакции-количество
вещества, вступившего в реакцию или
образовавшегося в результате реакции
за единицу времени на единице площади
поверхности раздела фаз
корость
гетерогенной реакции-количество
вещества, вступившего в реакцию или
образовавшегося в результате реакции
за единицу времени на единице площади
поверхности раздела фаз
Горение- совокупность физ и хим
процессов. Время процесса горения
определяется временем хим реаг. И
временем сопутствующих физ процессов,
![]()
приводящих к созданию однородной горючей смеси
Если τхим>> τфиз считается что горение происходит в кинетич области. Время процесса горения определяется τхим
τхим<< τфизто тормозной фактор-процесс доставки окислителя в зону раздела фаз, процесс происходит в диффузионной области.
При горении твердого или жидкого топлива подвод кислорода к поверхности реагирования осуществляется за счет молекулярной диффузии, скорость которой определяется законом Фика.
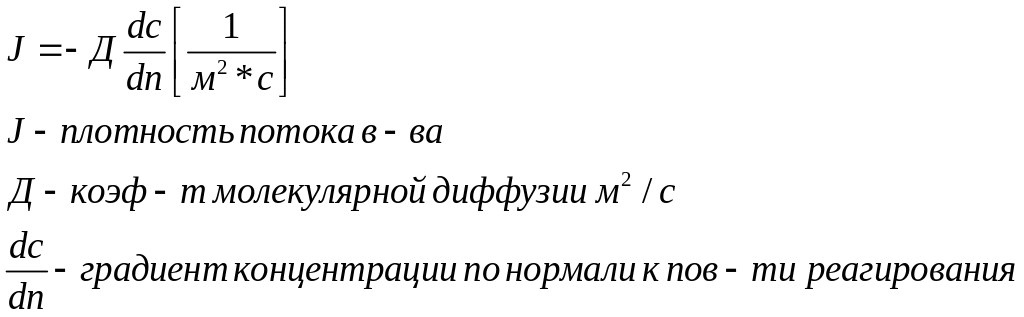
Для осуществления процесса химического реагирования необходимо чтобы реагирующие частицы сблизились настолько чтобы атомы одной из них испытывали действие электрического поля другой =>скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующего вещества

![]()
Полученное соотношение выражает закон действующих масс для хим. реакции:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ.
