
- •Предмет физиологии растений и основные направления исследований
- •Методы физиологии растений
- •Задачи физиологии растений
- •Краткая история физиологии растений
- •1. Природа и функции основных химических компонентов растительной клетки
- •Элементарный состав растений
- •Углеводы
- •Растительные пигменты
- •Фитогормоны
- •Фитонциды
- •Фитоалексины
- •2. Особенности структурной организации растительной клетки
- •Клеточная оболочка
- •Вакуоль
- •Пластиды
- •3. Органы, ткани и функциональные системы высших растений
- •1. Регуляция активности ферментов
- •2. Генетическая система регуляции
- •3. Мембранная регуляция
- •4. Трофическая регуляция
- •5. Электрофизиологическая регуляция
- •6. Гормональная система регуляции
- •Ауксины
- •Цитокинины
- •Гиббереллины
- •Абсцизины
- •Брассиностероиды
- •1. Термодинамические основы водного обмена растений
- •2. Водный баланс растений.
- •Поглощение и передвижение воды.
- •Транспирация.
- •Физиология устьичных движений
- •Пути снижения интенсивности транспирации
- •1. История фотосинтеза
- •2. Лист как орган фотосинтеза
- •3. Хлоропласты и фотосинтетические пигменты
- •Пигменты хлоропластов
- •Хлорофиллы
- •Каротиноиды
- •4. Световая фаза фотосинтеза
- •Организация и функционирование пигментных систем
- •5. Темновая фаза фотосинтеза
- •Фотодыхание
- •1. Сапротрофы
- •2. Паразиты
- •3. Насекомоядные растения
- •Гликолитическое расщепление глюкозы
- •Гликолиз
- •Цикл Кребса
- •Электрон-транспортная цепь
- •Окислительное фосфорилирование
- •Энергетический выход гликолитического дыхания
- •2. Пентозофосфатное расщепление глюкозы
- •4 Рибулозофосфат 2 рибулозофосфат
- •3. Промежуточные продукты дыхания
- •4. Жиры и белки как дыхательный субстрат
- •1. Элементы‚ необходимые для растительного организма
- •2. Признаки голодания растений
- •3. Антагонизм ионов
- •4. Поглощение минеральных веществ
- •5. Ионный транспорт в растении
- •Радиальное перемещение ионов в корне
- •Восходящий транспорт ионов в растении
- •Поглощение ионов клетками листа
- •Отток ионов из листьев
- •6. Азотное питание растений
- •Ассимиляция нитратного азота
- •Ассимиляция аммиака
- •Накопление нитратов в растениях
- •1. Клеточные основы роста и развития
- •2. Закон большого периода роста
- •3. Гормональная регуляция роста и развития растений
- •Влияние фитогормонов на рост и морфогенез растений
- •Использование фитогормонов и физиологически активных веществ
- •4. Физиология покоя семян
- •5. Процессы, протекающие при прорастании семян
- •6. Покой растений
- •7. Физиология старения растений
- •8.Осенняя окраска листьев и листопад
- •9. Влияние абиотических факторов на рост и развитие растений Температура
- •10. Влияние микроорганизмов на рост растений
- •11. Движения растений
- •Фототропизмы
- •Геотропизмы
- •Другие виды тропизмов
- •1. Холодостойкость растений
- •2. Морозоустойчивость растений
- •3. Зимостойкость растений
- •4. Влияние на растения избытка влаги в почве
- •5. Засухоустойчивость растений
- •Влияние на растения недостатка влаги
- •Физиологические особенности засухоустойчивости
- •6. Жароустойчивость растений
- •7. Солеустойчивость растений
- •1. Основные термины и понятия
- •2. Методы переноса генетической информации Трансформация растений Тi-плазмидой
- •Векторные системы на основе Тi-плазмид
- •Физические методы переноса генов в растительные клетки
- •Бомбардировка микрочастицами
- •3. Получение трансгенных растений
- •Выведение растений, устойчивых к насекомым-вредителям, вирусам и гербицидам
- •Получение растений, противостоящих неблагоприятным воздействиям и старению
- •Изменение окраски цветков
- •Изменение пищевой ценности растений
- •Растения как биореакторы
3. Хлоропласты и фотосинтетические пигменты
Лист растения — орган, обеспечивающий условия для протекания фотосинтетического процесса. Функционально же фотосинтез приурочен к специализированным органеллам — хлоропластам. Хлоропласты высших растений имеют форму двояковыпуклой линзы (диска), которая наиболее удобна для поглощения солнечных лучей. Их размеры, количество, расположение в клетке также полностью отвечают назначению: как можно эффективнее поглощать солнечную энергию, как можно полнее усваивать углерод. На различных сельскохозяйственных объектах установлено, что количество хлоропластов в клетке измеряется десятками. Это обеспечивает высокое содержание этих органелл на единицу поверхности листа. Так, на 1 мм2 листа фасоли приходится 283 тыс. хлоропластов, у подсолнечника — 465 тыс. Диаметр хлоропластов в среднем 0,5—2 мкм, длина 5—10 мкм, объем 30— 40 мкм3. Малый размер хлоропластов и большое количество их в одной клетке обусловливают громадную общую суммарную рабочую поверхность.
Хлоропласты способны к активным движениям — изменению ориентации тела и перемещению в пространстве. Скорость движения хлоропластов около 0,12 мкм/с. Их передвижения вызываются физическими и химическими факторами. Например, под влиянием яркого света хлоропласты поворачиваются узкой стороной диска к падающим лучам и перемещаются на боковые стенки клеток. Хлоропластам присуща также хемотаксическая чувствительность — они передвигаются в направлении более высокой концентрации СО2 в клетке.
Пигменты хлоропластов
Фотосинтез связан с избирательным поглощением пигментами света в видимой части солнечного спектра. Фотосинтетические пигменты составляют 10—15 % сухой массы хлоропластов. Они характеризуются большим разнообразием и по химической природе делятся на две группы — хлорофиллы и каротиноиды.
Хлорофиллы
В настоящее время известно несколько различных форм хлорофилла, которые обозначают латинскими буквами. Хлоропласты высших растений содержат хлорофилл а и хлорофилл b. Они были идентифицированы русским ученым М.С. Цветом (1906) с помощью разработанного им метода хроматографии. Структурная формула хлорофилла, предложенная Г. Фишером (1939), получила окончательное подтверждение в 1960 г. в результате двух независимо проведенных работ в США и ФРГ по искусственному синтезу хлорофилла а.
Хлорофилл — сложный эфир дикарбоновой кислоты хлорофиллина, у которой одна карбоксильная группа этерифицирована остатком метилового спирта‚ а другая – остатком непредельного спирта фитола:

На рисунке 8, дана структурная формула хлорофилла а. Четыре пиррольных кольца (I—IV) соединены между собой метановыми мостиками (α‚β‚ γ‚ ε), образуя порфириновое ядро. Атомы азота пиррольных колец четырьмя координационными связями взаимодействуют с атомом Mg. В структуре порфиринового ядра есть также циклопентановое кольцо, содержащее химически активную карбонильную группу. Структура, состоящая из тетрапиррольного и циклопентанового колец, получила название форбина.
Порфириновое кольцо представляет собой систему из девяти пар чередующихся двойных и одинарных, т. е. конъюгированных, связей с 18 делокализованными π-электронами. Хлорофилл b отличается от хлорофилла а тем, что у третьего углерода второго пиррольного кольца вместо метильной находится альдегидная группа. Структура хлорофилла, лишенная фитола, называется хлорофиллидом. При замещении атома магния протонами водорода образуется феофитин.
Согласно закону Гротгуса — одному из фундаментальных законов светохимии фотохимически деятельны только поглощенные лучи. Поэтому изучение спектров поглощения пигментов, и в первую очередь хлорофилла, является решающим для понимания механизма фотосинтеза и разработки путей его регуляции. Не случайно этой ключевой проблеме посвящен классический труд К.А. Тимирязева «Об усвоении света растениями».
Отличительной особенностью всех пигментов является наличие в их составе системы слабо удерживаемых делокализованных электронов, возбуждаемых квантами видимой части солнечного спектра. Это лежит в основе их свойства — избирательного поглощения света. Резко выраженные максимумы поглощения хлорофиллов находятся в сине-фиолетовой и красной частях спектра (рис. 9). Максимумы поглощения раствора хлорофилла а в этиловом спирте — 428—430 и 660—663 нм соответственно, хлорофилла b — 452—455 и 642—644 нм. Хлорофиллы очень слабо поглощают оранжевые и желтые лучи и совсем не поглощают зеленые и инфракрасные. Поэтому раствор хлорофилла а имеет сине-зеленый цвет, хлорофилла b — желто-зеленый.
Поглощение в сине-фиолетовой части спектра обусловлено системой конъюгированных 9 пар одинарных и двойных связей порфиринового ядра молекулы хлорофилла с 18 делокализованными π-электронами, которые возбуждаются квантами с энергией 4,5 .10-19 Дж, соответствующей этим лучам. Поглощение в красной области спектра (энергия кванта 3 .10-19 Дж) связано с гидрированием двойной связи у C7—C8 в IV пиррольном кольце (при восстановлении протохлорофиллида до хлорофиллида), присутствием магния в порфириновом ядре и наличием циклопентанового кольца (V). Эти же особенности структуры способствуют снижению поглощения в желтой и зеленой частях спектра.

Рис. 8. Структурная формула хлорофилла
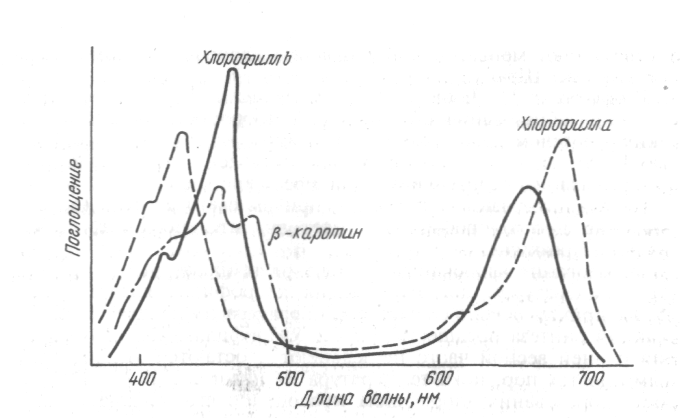
Рис. 9. Спектры поглощения пигментов хлоропластов
Даже небольшое изменение в строении молекул приводит к значительным различиям в положении максимумов поглощения. Так, у хлорофилла b, отличающегося от хлорофилла а заменой метильной группы на альдегидную, максимумы поглощения света оказываются более сближенными за счет смещения сине-фиолетового в длинноволновую, а красного — в коротковолновую области. Кроме того, хлорофилл b более полно использует сине-фиолетовый свет, чем хлорофилл а; в красных лучах преимущества имеет хлорофилл а. Замещение магния протонами при обработке хлорофилла кислотой приводит к образованию феофитина, имеющего ослабленный красный максимум поглощения света и буро-зеленый цвет. Удаление остатков фитола и метилового спирта путем щелочного гидролиза слабо сказывается на оптических свойствах хлорофилла.
Существенное влияние на положение максимумов спектра поглощения оказывают природа растворителя и взаимодействие молекул хлорофилла друг с другом, а также с другими пигментами, белками и липидами в составе хлоропластов. У агрегированных молекул хлорофилла, взаимодействующих с белками, красный максимум поглощения сдвинут в более длинноволновую часть спектра. Степень связывания определяет точный максимум поглощения света.
Раствор хлорофилла обладает яркой вишнево-красной флуоресценцией — излучением поглощенных квантов света. В соответствии с правилом Стокса флуоресценция сдвинута в более длинноволновую часть по сравнению с поглощением света, максимум флуоресценции 650—668 нм. Хлорофилл в живом листе флуоресцирует слабо. Это связано с тем, что энергия поглощенных квантов в основном преобразуется в химическую, причем по степени флуоресценции листа можно судить об эффективности фотосинтеза. Чем интенсивнее флуоресценция, тем ниже КПД использования поглощенной энергии.
Механизмы избирательного поглощения света и флуоресценции изучены достаточно хорошо. Поглощение кванта света сопровождается переходом в более богатое энергией короткоживущее возбужденное состояние, связанное с переходом электрона на более удаленную от ядра орбиталь. Электронные орбитали атомов характеризуются определенными энергетическими уровнями, возрастающими по мере удаления от ядра. Те кванты света, энергия которых соответствует разности энергий между двумя орбиталями, поглощаются с переходом электрона на более дальнюю орбиталь. Поэтому могут поглощаться только кванты света с совершенно определенной длиной волны. В отличие от атома возможные энергетические состояния молекул нельзя описать точно фиксированными энергетическими уровнями, они характеризуются широкими полосами в спектрах поглощения (рис. 10).

Рис. 10. Энергетические состояния молекулы хлорофилла и различные пути использования энергии электронного возбуждения. (Цифры указывают время жизни каждого из состояний молекулы.)
В органических молекулах почти все электроны спарены, т. е. находятся в одном и том же энергетическом состоянии, обладая противоположными спинами (основное синглетное энергетическое состояние — S0). Поглощение молекулой хлорофилла кванта красного света с энергией 170 кДж/моль квантов приводит к первому синглетному электронно-возбужденному состоянию — S1 время существования которого примерно 10-9 с. Возбужденная молекула хлорофилла переходит в стабильное состояние путем возвращения электрона на исходную орбиталь. Поглощенная энергия при этом может расходоваться различными способами: рассеиванием теплоты; потерей в виде излучения; возбуждением соседних молекул пигментов (перенос энергии к фотохимическим центрам); совершением фотохимической работы. Возможны также потеря части энергии в виде теплоты и переход молекулы из синглетного в метастабильное триплетное возбужденное состояние (с обращением спина электрона). Триплетное состояние длится гораздо дольше (> 10-4 с). Из триплетного состояния молекула может вернуться в основное за счет более длительного, чем флуоресценция, слабого длинноволнового свечения — фосфоресценции или направив энергию на фотохимические реакции.
Поглощение кванта в сине-фиолетовой области спектра (содержание энергии 300 кДж/моль квантов) приводит к возникновению исключительно краткого (< 10-12 с) второго возбужденного синглетного состояния (S2). За счет выделения части энергии в виде теплоты молекула переходит в S1, и дальнейшие события соответствуют возбуждению красным светом. Поэтому поглощение света в синей и красной областях дает одинаковый спектр флуоресценции (красный), а также равные количества фотохимической работы, несмотря на неодинаковое содержание энергии у поглощенных квантов. Этим объясняется более высокая эффективность красных участков солнечного спектра, о которой писал еще К.А. Тимирязев. Он предположил, что хлорофилл способен к окислительно-восстановительному превращению. Впервые реакция фотовосстановления хлорофилла была осуществлена в 1948 г. А.А. Красновским в модельных опытах. В качестве донора электронов использована аскорбиновая кислота.
Таким образом, молекула хлорофилла благодаря структурным изменениям и физико-химическим особенностям способна выполнять три важнейшие функции: избирательно поглощать энергию света; трансформировать ее в энергию электронного возбуждения (или запасать ее в виде энергии электронного возбуждения); фотохимически преобразовать энергию возбужденного состояния в химическую энергию. Для функционирования молекулы хлорофилла существенное значение имеет ее пространственная организация. Магний-порфириновое кольцо молекулы представляет собой почти плоскую пластинку толщиной 0,42 нм и площадью 1 нм2. Это гидрофильная фотоактивная часть молекулы хлорофилла. Длинный (2 нм) алифатический остаток фитола, образующий угол с порфириновым кольцом, — ее гидрофобный полюс, необходимый для взаимодействия молекулы хлорофилла с гидрофобными участками мембранных белков и липидов.
