
- •К лабораторному практикуму
- •Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •Реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •Криоскопическим методом
- •Реакция среды при гидролизе солей
- •Ацетатного буферного раствора по кислоте и щелочи
- •Моносахариды
- •Полисахариды
Экспериментальные данные и результаты измерений
-
1) Масса калориметрического стакана
 (г);
(г);2) Концентрация растворов
 =
= (моль/л);
(моль/л);3) Объем раствора
 (мл);
(мл);4) Температура раствора
 (градус):
(градус):5) Температура раствора

 (градус);
(градус);6) Начальная температура раствора
 (градус);
(градус);7) Температура после нейтрализации
 (градус);
(градус);8) Масса
 (г);
(г);9) Масса
 (г).
(г).
Выполните следующие нижеуказанные расчеты:
По закону Гесса рассчитайте теоретическое значение теплового эффекта реакции нейтрализации с использованием табличных значений:
 .
Отсюда
.
Отсюда
 =
=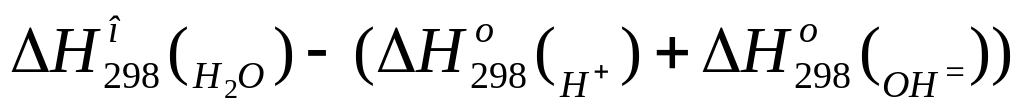 .
.Теплоемкость калориметра /
 /
находите по формуле:
/
находите по формуле:
 ,
,
где:
 –
удельная
теплоёмкость стекла, равная
–
удельная
теплоёмкость стекла, равная ;
; –
удельная
теплоёмкость раствора, равная
–
удельная
теплоёмкость раствора, равная

 ;
;
Стандартную энтальпию реакции нейтрализации определите по формуле:
![]() ,где:
,где:
 -
разность среднего арифметического
значения температуры после реакции
и среднего арифметического значения
температуры до реакции;
-
разность среднего арифметического
значения температуры после реакции
и среднего арифметического значения
температуры до реакции;

Определите абсолютную (а) и относительную (б) ошибку по следующим формулам:
а)![]() и б)
и б)
Выводы. 1) Делайте вывод о зависимости стандартной теплоты реакции от природы реагирующих кислот и оснований. 2) Объясните наличие относительной ошибки опыта.
Лабораторная работа №3. Зависимость скорости химической реакции от концентрации
Принцип
метода. Метод
основан на определении времени
![]() образования опалесценции, обусловленной
образованием серы /
образования опалесценции, обусловленной
образованием серы /![]() /
в ходе разложения динатрий тиосульфата
серной кислотой. Время
от начала реакции
(началом реакции считается момент
сливания растворов) до
заметного помутнения раствора зависит
от скорости реакции
/
в ходе разложения динатрий тиосульфата
серной кислотой. Время
от начала реакции
(началом реакции считается момент
сливания растворов) до
заметного помутнения раствора зависит
от скорости реакции
![]() .
Это дает возможность судить об
относительной скорости реакции: чем
больше скорость, тем меньше время.
.
Это дает возможность судить об
относительной скорости реакции: чем
больше скорость, тем меньше время.
Процесс разложения многостадийный:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
Скорость
второй реакции наименьшая, является
предметом изучения,
поэтому она и определяет скорость
разложения
![]() .
Образующаяся в результате
окислительно-восстановительного
процесса сера вызывает помутнение
раствора. Однако помутнение становится
заметным после того, как концентрация
серы достигнет определенной величины.
Следовательно, чем выше концентрация
веществ в смеси, тем быстрее между ними
идет реакция. Другими словами, скорость
химической реакции прямо пропорциональна
концентрациям реагирующих веществ в
степенях, равных стехиометрическим
коэффициентам –
закон действующих масс.
.
Образующаяся в результате
окислительно-восстановительного
процесса сера вызывает помутнение
раствора. Однако помутнение становится
заметным после того, как концентрация
серы достигнет определенной величины.
Следовательно, чем выше концентрация
веществ в смеси, тем быстрее между ними
идет реакция. Другими словами, скорость
химической реакции прямо пропорциональна
концентрациям реагирующих веществ в
степенях, равных стехиометрическим
коэффициентам –
закон действующих масс.
В
зависимости от значения порядка реакции
![]() можно выделить 4-е основные зависимости
скорости реакции от концентрации,
графики которых показаны на рисунке
2.1.
можно выделить 4-е основные зависимости
скорости реакции от концентрации,
графики которых показаны на рисунке
2.1.
|
Рис. 2.1. Зависимость скорости реакции от концентрации для химических реакций разного порядка: 1- = 0; 2 - 0 < < 1; 3– =1; 3– >1. |
Цель работы. Установить зависимость скорости реакции разложения динатрия тиосульфата / /. Определить порядок данной реакции.
Приборы и оборудование: секундомер, бюретки вместимостью 25 мл, стаканы вместимостью 50 мл, мензурки.
Реактивы: серная кислота и динатрий тиосульфата с концентрацией 0,15 моль/л; вода дистиллированная.
Ход работы:
В 8 стаканов (4 пары) из бюреток (* лучше пипеткой) налейте объемы 0,15 М раствора и дистилированной воды, приведенные в таблице №3.1.
В первый стакан прилейте 15 мл 0,15 М раствора H2SO4, одновременно включите секундомер. Определите время от момента добавления кислоты до появления в растворе слабой опалесценции. Опыт повторите 2 раза.
Проведите аналогичные опыты с 2, 3 и 4- ми стаканами.
Данные и результаты эксперимента внесите в таблицу №2.1.
Таблица 2.1
Зависимость
скорости разложения
от
ее концентрации /![]() /
/
№ опыта |
Объем, мл |
Общий объем, мл |
моль/л
|
Промежуток времени от начала отсчета до появления мути, сек. |
,
|
||||
|
|
|
|
|
|
|
|||
1. |
15 |
0 |
15
|
|
|
|
|
|
|
2. |
10 |
5 |
|
|
|
|
|
|
|
3. |
5 |
10 |
|
|
|
|
|
|
|
4. |
3 |
12 |
|
|
|
|
|
|
|
Обработка результатов. Выполните следующие нижеуказанные расчеты:
а)
Для всех проведенных опытов (т.е. 1, 2, 3 и
4-й), пользуясь полученными данными,
определите молярную концентрацию
тиосерной кислоты
![]() по формуле:
по формуле:
1)
![]() .
.
б) Вычислите для всех проведенных опытов (т.е. 1, 2, 3 и 4-й) по формуле:
1)
![]() .
.
в) Рассчитайте скорость химической реакции для всех проведенных опытов (т.е. 1, 2, 3 и 4-й) по формуле:
1)
![]() .
.
Выводы. 1) Постройте график зависимости скорости реакции (ось ординат) от концентрации (ось абсцисс) реагирующих веществ. Согласно закону действия масс зависимость скорости реакции от концентрации должна выражаться прямой линией, проходящей через начало координат. 2) Сделайте вывод о зависимости скорости реакции от концентрации и определите порядок реакции.
Лабораторная работа №4. Определение молярной массы неэлектролита

