
- •К лабораторному практикуму
- •Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •Реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •Криоскопическим методом
- •Реакция среды при гидролизе солей
- •Ацетатного буферного раствора по кислоте и щелочи
- •Моносахариды
- •Полисахариды
![]()
К лабораторному практикуму
(в количестве 18 тем)
Экспериментальная часть
Дисциплина – химия
Специальность /Направление подготовки – стоматология 060201
Разработчик ____________ Сергеева С.А.
(подпись)
Лабораторная работа №1. Кислотно-основное титрование (нейтрализация)
Оборудование: пипетки Мора и градуированные вместимостью 5 или 10 мл, резиновые груши, бюретки вместимостью 25 мл на штативе; воронки; мерные колбы на 100 мл, конические колбы вместимостью 250 мл, мензурки, цилиндры, электрическая плитка.
Реактивы: раствор первичного стандарта – 0,1 моль/л дигидрат щавелевой кислоты, раствор титранта – гидроксид натрия (приблизительная концентрация 0,1 моль/л), соляная кислота с ρ=1,04 г/мл; индикаторы – растворы фенолфталеина и метилоранжа; дистиллированная вода.
Опыт №1. Установление точной концентрации рабочего раствора NaOH
Цель работы. Научиться стандартизировать титранты по первичному стандарту с применением прямого титрования, а именно: получить навыки работы пипетками Мора, бюретками и выполнения титрования; научиться выбирать индикаторы для конкретных случаев кислотно-основного титрования; научиться выполнять расчеты по результатам титрования.
Принцип метода. В основе метода лежит кислотно-основное титрование и закон эквивалентов: все вещества реагируют друг с другом в строгих весовых соотношениях, пропорциональных их молярным массам эквивалентов:

Стандартизацию
растворов щелочи проводят по дигидрату
щавелевой кислоты
![]() ;
титруют в присутствии фенолфталеина,
т.к. среда в точке эквивалентности
слабощелочная:
;
титруют в присутствии фенолфталеина,
т.к. среда в точке эквивалентности
слабощелочная:![]() .
Фактор эквивалентности щавелевой
кислоты равен
.
Фактор эквивалентности щавелевой
кислоты равен
![]() ,
эквивалентом является половина молекулы
щавелевой кислоты, молярная масса
эквивалента равна половине молярной
массы щавелевой кислоты. Для гидроксида
натрия фактор эквивалентности равен
1.
,
эквивалентом является половина молекулы
щавелевой кислоты, молярная масса
эквивалента равна половине молярной
массы щавелевой кислоты. Для гидроксида
натрия фактор эквивалентности равен
1.
Ход работы:
Бюретку промойте рабочим раствором NaOH и доведите уровень раствора в ней до «0» (правила мениска).
5 мл раствора дигидрат щавелевой кислоты с 0,1 моль/л переносите в коническую колбу для титрования, прибавьте 2-3 капли индикатора фенолфталеина и нагревайте на электрической плитке до кипения (до 50-60оС).
Горячий раствор титруйте рабочим раствором NaOH, прибавляя его из бюретки по каплям до появления неисчезающей в течение 30 с бледно-розовой окраски раствора. В точке эквивалента определите по шкале объем раствора
 –
–
 .
.Титрование повторите до тех пор, пока не будут получены 3 сходящихся (т.е. отличающихся друг от друга не более чем на 0,1 мл) результата. По окончании титрования бюретку закрывайте пробкой, чтобы раствор щелочи не поглощал углекислый газ из воздуха.
Из 3 сходящихся результатов титрования рассчитывайте точную молярную концентрацию эквивалента раствора по формуле:
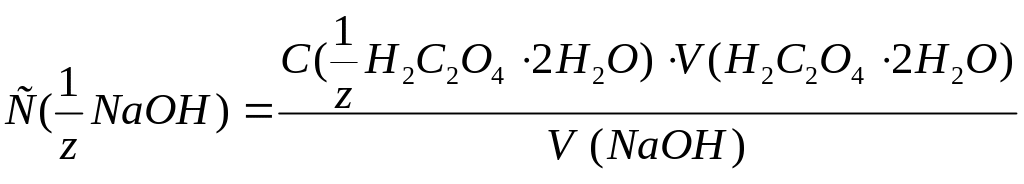 .
.Все вышеуказанные данные и результаты расчетов занесите в таблицу №2.1.
Таблица 2.1
Экспериментальные данные и результаты измерений
-
№

(л)
(л)
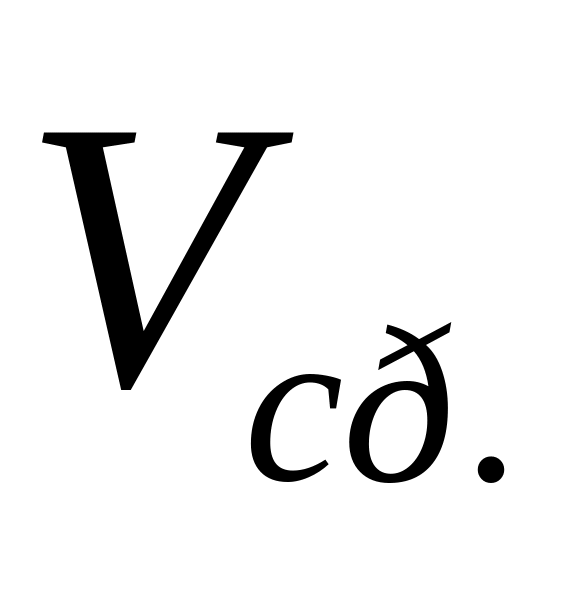
(л)

моль/л
1
2
3
Выводы. Вывод в данной работе может быть сформулирован так: 1) «Освоены правила работы с мерной посудой, используемой в титриметрическом анализе. 2) Методом прямого титрования с использованием в качестве первичного стандарта установлена молярная концентрация эквивалента титраната – раствора . =……….. моль/л».
Примечание: Стандартизированный раствор может быть использован в свою очередь как вторичный стандартный раствор для определения количества соляной кислоты. Но надо помнить, что гидроксид натрия медленно реагирует со стеклом с образованием силикатов, поэтому раствор нельзя долго хранить в стеклянном сосуде.
Опыт №2. Определение массовой доли соляной кислоты в фармакопейном препарате (Acidum hydrochiloridum dilutum)
Цель работы. Опытным путем определить в % содержание соляной кислоты в фармакопейном препарате (ρ = 1,04 г/мл).
Принцип
метода. В
основе метода лежит кислотно-основное
титрование.
В качестве
титранта применяют стандартизированный
раствор
(из опыта №1). Продуктами реакции между
сильной кислотой и сильным основанием
являются соль, не подвергающаяся
гидролизу и вода:
![]() ,
,
![]() .
В этом случае раствор в точке эквивалентности
имеет нейтральную реакцию, т.е.
.
В этом случае раствор в точке эквивалентности
имеет нейтральную реакцию, т.е.
![]() ,
поэтому титрование проводят в присутствии
метилоранжа.
,
поэтому титрование проводят в присутствии
метилоранжа.
Ход работы:
5 мл раствора соляной кислоты (ρ = 1,04 г/мл) переносите в мерную колбу на 100 мл, объем доводите дистиллированной водой до метки и тщательно перемешивайте.
Отбирайте пипеткой по 5 аликвоты соляной кислоты в колбы для титрования, добавляйте 1-2 капли индикатора метилоранжа и титруйте, постоянно перемешивая стандартным раствором гидроксида натрия из бюретки до желтого окрашивания.
Из 3-х сходящихся результатов титрования рассчитайте процентное содержание соляной кислоты в анализируемом образце.
 ,
,
где:
а – навеска, а
 ;
;
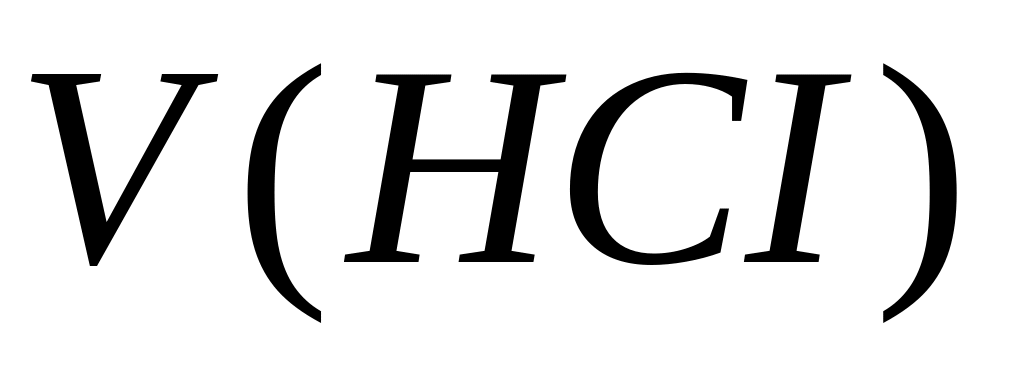 –
объем препарата взятый для определения,
мл
–
объем препарата взятый для определения,
млМ.м.(HCI)=36,46 г/моль;
V (пипетки) – объем аликвотной (точной) части разведения, взятый для титрования, мл.
Результаты внесите в таблицу №2.2.
Таблица 2.2
