
- •Методические указания
- •Часть I.
- •Введение. Общие правила выполнения лабораторных работ
- •Лабораторная работа № 1 основные типы химических реакций. Классы неорганических соединений
- •1.1 Теоретическая часть
- •1.2 Экспериментальная часть
- •Контрольные вопросы
- •Основные расчетные формулы молярных масс эквивалентов сложных веществ
- •2.2 Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа № 3 скорость химических реакций
- •3.1 Теоретическая часть
- •3.2 Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа № 4 растворы электролитов
- •4.1 Теоретическая часть
- •А. Реакции, идущие с образованием осадка
- •Б. Реакции, идущие с образованием газа
- •В. Реакции, идущие с образованием слабого электролита
- •4.2.2 Реакции ионного обмена
- •4.2.2.1 Реакции с образованием слабых электролитов
- •4.2.2.2 Реакции с образованием газа
- •4.2.2.3 Реакции с образованием осадков
- •4.2.2.4 Растворение осадков
- •4.2.2.5 Получение и растворение амфотерных гидроксидов
- •4.2.2.6 Реакции, идущие с образованием комплексного иона
- •Контрольные вопросы
- •Давление насыщенного пара воды при различных температурах
Контрольные вопросы
Что называют эквивалентом вещества?
Как определить эквивалент кислоты, основания, соли в кислотно-основных реакциях?
Как определить эквивалент вещества в окислительно-восстановительных реакциях?
Что такое моль эквивалентов и молярная масса эквивалентов?
Рассчитайте молярные массы эквивалентов следующих веществ в реакциях обмена: NaOH, H2S;
 ,
Ca(OH)2;
H2SO4,
NH4OH.
Составьте уравнения реакций.
,
Ca(OH)2;
H2SO4,
NH4OH.
Составьте уравнения реакций.К раствору, содержащему 1 г соляной кислоты, прибавили раствор, содержащий 1 г гидроксида натрия. Будет ли полученный раствор нейтральным, кислым или щелочным? Ответ подтвердите расчетом.
Лабораторная работа № 3 скорость химических реакций
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
3.1 Теоретическая часть
Скорость химической реакции (v) определяется изменением концентрации ΔС одного из реагирующих веществ (или продукта реакций) в единицу времени. Концентрация выражается числом молей вещества, содержащихся в 1 л (моль/л), и наиболее употребляемая единица измерения скорости – моль на литр-секунду моль/(л∙с).
В химической кинетике пользуются понятием средней скорости в данном интервале времени Δt:
![]() . (3.1)
. (3.1)
Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени:
![]() . (3.2)
. (3.2)
Скорость химической реакции зависит в первую очередь от природы реагирующих веществ. Скорость гомогенной реакции от концентрации реагентов, а гетерогенной реакции – от площади соприкасающихся фаз, т.е. степени дисперсности. Скорости всех реакций зависят от температуры, многих реакций – от присутствия катализаторов.
Зависимость скорости химической реакции от концентраций выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Например, для реакции
2NO + O2 → 2NO2 (3.3)
закон действия масс может быть записан:
v = kс2(NO) ∙ с(O2), (3.4)
где v – скорость химической реакции; k – константа скорости; c(NO) и с(O2) – концентрации реагирующих веществ.
Реакция в гетерогенной системе, например
С(к) + О2(г) → СО2(г) (3.5)
осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации газообразного вещества, но и от площади поверхности раздела. Для указанной реакции закон действия масс имеет вид
v = k ∙ с (O2) S, (3.6)
где k – константа скорости; C(O2) – концентрация кислорода; S – площадь поверхности раздела между фазами.
В общем случае для реакций со сложным механизмом зависимость скорости реакции от концентрации описывается кинематическим уравнением, по форме аналогичным закону действующих масс. Например, для реакции:
аА + вВ ↔ продукты; (3.7)
![]() , (3.8)
, (3.8)
где «р» и «q» – эмпирические (найденные экспериментальным путем) коэффициенты, не обязательно совпадающие со стехиометрическими коэффициентами «а» и «в»; k – константа скорости реакции, размерность которой зависит от значений «р» и «q».
Константа скорости зависит от тех же факторов, что и скорость химической реакции, но не зависит от концентрации реагирующих веществ.
Величина р + q определяет порядок кинетического уравнения реакции, который показывает каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0, 1, 2 и более, он может быть также дробным.
Важной характеристикой реакции является период полупревращения t0,5 – – время, за которое в реакцию вступает половина исходного вещества. Для радионуклидов аналогичная величина называется периодом полураспада.
Для реакций нулевого порядка кинетическое уравнение имеет вид
![]() . (3.9)
. (3.9)
Обозначим через С0 начальную концентрацию реагента, через Сt – концентрацию реагента в момент времени t. Тогда
с0 – сt = kt (3.10) |
и
|
dim k = L–3T–1N, единица измерения – моль на литр-секунду [моль/(л·с) или кмоль/м3·с].
Для реакций первого порядка
![]() , (3.12)
, (3.12)
откуда
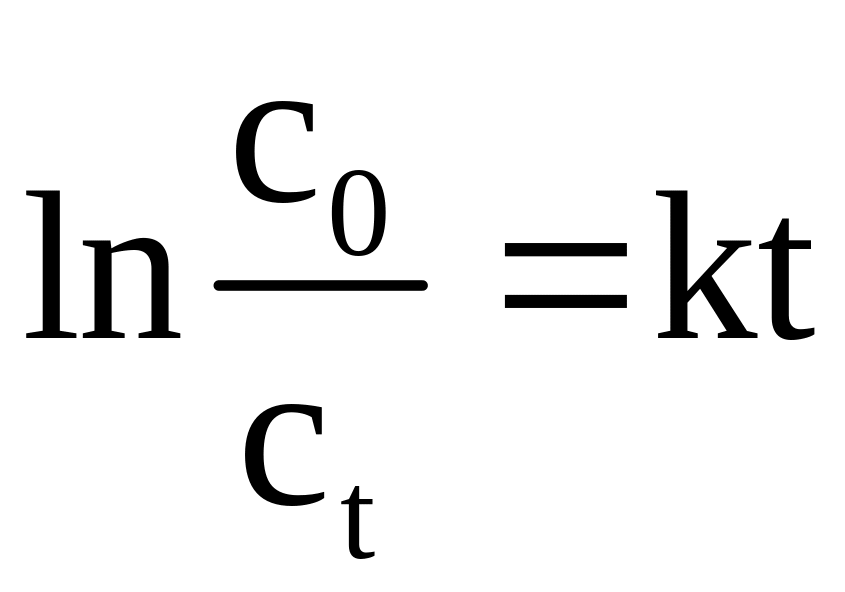 ;
(3.13)
;
(3.13)
dim k = T–1, единица измерения – секунда в минус первой степени (с–1).
Для реакций второго порядка
![]() , (3.14)
, (3.14)
откуда
 ;
(3.15)
;
(3.15)
dim k = L–3T–1N–1, единица измерения – литр на моль-секунду [л/(моль·с) или м3/кмоль·с].
Из приведенных уравнений можно сделать выводы:
1) Величина константы скорости уравнения первого порядка не зависит от способа выражения концентрации, а уравнений нулевого и второго порядков – зависит.
Например, если концентрацию выразить не в моль/л, а в миллимоль на литр, то величина константы скорости кинетических уравнений реакций нулевого порядка увеличится в 1000 раз, а величина константы скорости кинетических уравнений реакций второго порядка в 1000 раз уменьшится.
2) Величины констант скорости кинетических уравнений реакций всех порядков зависят от выбранной единицы времени. Например, если время выразить не в секундах, а в минутах, то величины констант возрастут в 60 раз.
3) Период полупревращения реакций первого порядка не зависит от начальной концентрации реагента, период полупревращения реакций нулевого порядка возрастает при увеличении с0, а реакций второго порядка – уменьшается. Анализируя зависимость периода полупревращения реакции от начальной концентрации реагента, можно определить порядок реакции.
Скорость реакции зависит от температуры. В соответствии с эмпирическим правилом Вант-Гоффа скорость большинства реакций увеличивается приблизительно в 2-4 раза при повышении температуры на 10 ºС:
kT+ΔT = kT · ΔT/10, (3.18)
где – температурный коэффициент скорости реакций.
Многие каталитические реакции не подчиняются этому правилу, для большинства из них < 2.
Более точную зависимость скорости химической реакции от температуры устанавливает уравнение Аррениуса:
![]() ,
(3.19)
,
(3.19)
где k0 – предэкспоненциальный множитель, пропорциональный числу столкновений реагирующих частиц; Еа – энергия активации реакции; Т - температура по шкале Кельвина; е – основание натурального логарифма; R – универсальная газовая постоянная (в системе СИ равна 8,314 Дж/моль·К).
Энергия активации реакции Еа – энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты реакции. Dim Еа = L2 МT–2N, единица измерения – джоуль на моль (Дж/моль).
Уравнение Аррениуса для двух температур имеет следующий вид:
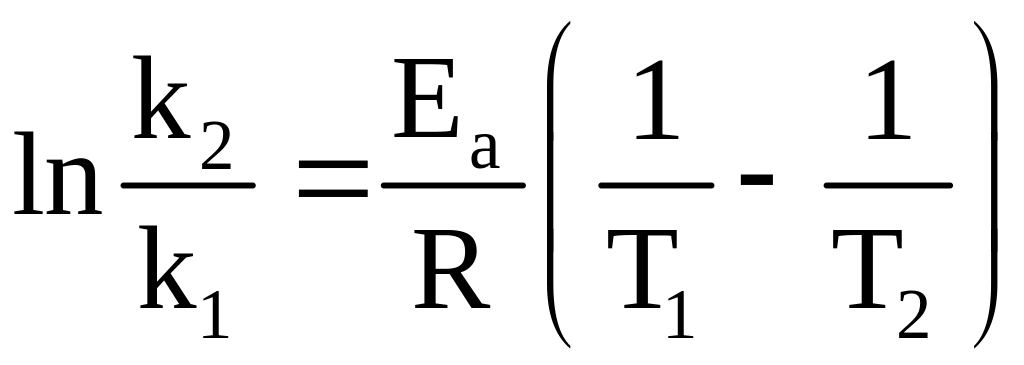 , (3.20)
, (3.20)
или
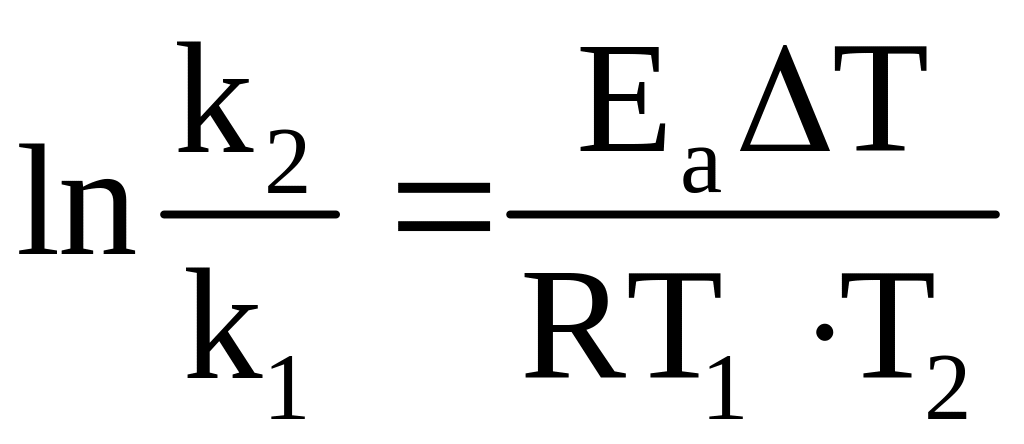 ,
(3.21)
,
(3.21)
где k1 и k2 – константы скорости при температуре Т1 и Т2 соответственно.
 . (3.22)
. (3.22)

 (3.11)
(3.11)