
- •Техническая термодинамика
- •Общие указания
- •Содержание
- •1.Параметры состояния рабочего тела.
- •2. Идеальные газы и основные газовые законы.
- •3. Газовые смеси
- •4. Теплоемкость газов
- •5. Первый закон термодинамики
- •Смешение газов
- •6. Круговые процессы
- •Цикл Карно
- •7. Основные газовые процессы. Изохорный процесс
- •8. Изобарный процесс
- •9. Изотермический процесс
- •10. Адиабатный процесс
- •11. Политропный процесс
- •12. Циклы холодильных установок
- •Цикл воздушной холодильной установки
- •13. Второй закон термодинамики
- •14. Влажный воздух
- •Задачи.
- •Приложение
- •I. Молекулярные массы, плотности и объемы киломолей при нормальных условиях и газовые постоянные важнейших газов
- •II. Теплоемкость окиси углерода
- •III. Теплоемкость воздуха
- •IV. Насыщенный пар аммиака (нn3)
- •V. Насыщенный водяной пар (по температурам)
- •VI. Вода и перегретый водяной пар
- •VII. Адиабатное и политропное расширение газов
- •Литература
5. Первый закон термодинамики
Первый закон термодинамики устанавливает эквивалентность при взаимных превращениях механической и тепловой энергии и математически может быть выражен следующим образом:
Q = U + L,
Где Q – количество теплоты, превращенной в работу (Дж);
L – работа, полученная за счет теплоты Q (Дж);
U – внутренняя энергия (Дж);
В табл. 5.1 и 5.2 даны соотношения между различными единицами энергии и мощности.
Таблица 5.1.
Соотношения между единицами энергии
Единицы измерения |
Дж |
кгс∙м |
кал |
Джоуль |
1 |
0,102 |
0,239 |
Килограмм-сила-метр |
9,8067 |
1 |
2,343 |
Калория |
4,1868 |
0,42686 |
1 |
Килокалория |
4,1868∙103 |
4,2686∙102 |
103 |
Киловатт-час |
3,6∙106 |
3,67∙105 |
8,6∙105 |
Фут-фунт-сила |
1,356 |
0,138 |
0,325 |
Единицы измерения |
кал |
кВт∙ч |
ft∙lbf |
Джоуль |
2,39∙10-4 |
2,78∙10-7 |
0,7376 |
Килограмм-сила-метр |
2,343∙10-3 |
2,72∙10-6 |
7,233 |
Калория |
10-3 |
1,16∙10-6 |
3,088 |
Килокалория |
1 |
1,16∙10-3 |
3,088∙103 |
Киловатт-час |
8,6∙102 |
1 |
2,653∙106 |
Фут-фунт-сила |
3,25∙10-4 |
3,76∙10-7 |
1 |
Таблица 5.2
Соотношения между единицами мощности
Единицы измерения |
Вт |
кгс∙м/с |
кал/с |
ft∙lbf/s |
л.с. |
Ватт |
1 |
0,102 |
0,239 |
0,7376 |
1,36∙10-3 |
Килограмм-сила-метр в секунду |
9,8067 |
1 |
2,343 |
7,233 |
1,33∙10-2 |
Калория в секунду |
4,1868 |
0,427 |
1 |
3,088 |
5,6∙10-3 |
Фут-фунт-сила в секунду |
1,3558 |
0,138 |
0,3246 |
1 |
1,84∙10-3 |
Лошадиная сила |
736 |
75 |
175,5 |
542,5 |
1 |
Пользуясь первым законом термодинамики, можно определить коэффициент полезного действия (к. п. д.) теплосиловых установок ηст, характеризующий степень совершенства превращения ими теплоты в работу.
Если расход топлива на 1 кВт∙ч (удельный расход топлива) b выражен в кг/(кВт∙ч), а теплота сгорания топлива Qрн в кДж/кг, то к.п.д. теплосиловой установки:
ηст=3600/Qрнb, (5.1)
Аналитическое выражение первого закона термодинамики или основное уравнение теплоты в дифференциальной форме для любого тела:
dQ=dU+dL, (5.2)
где dQ – количество теплоты, сообщенное извне рабочему телу массой М кг;
dU – изменение внутренней энергии рабочего тела;
dL – работа, совершенная рабочим телом по преодолению внешнего давления, «внешняя работа» расширения.
Для бесконечно малого изменения состояния 1 кг любого газа уравнения (5.2) примет следующий вид:
dq=du+dl, (5.3)
Так как
dl=pdv,
то
dq=du+ pdv, (5.4)
Для конечного изменения состояния уравнения (5.2) и (5.3) соответственно имеют вид:
Q=∆U+L, (5.5)
и
q=∆u+l, (5.6)
Работа расширения 1 кг газа:
dl=pdv,
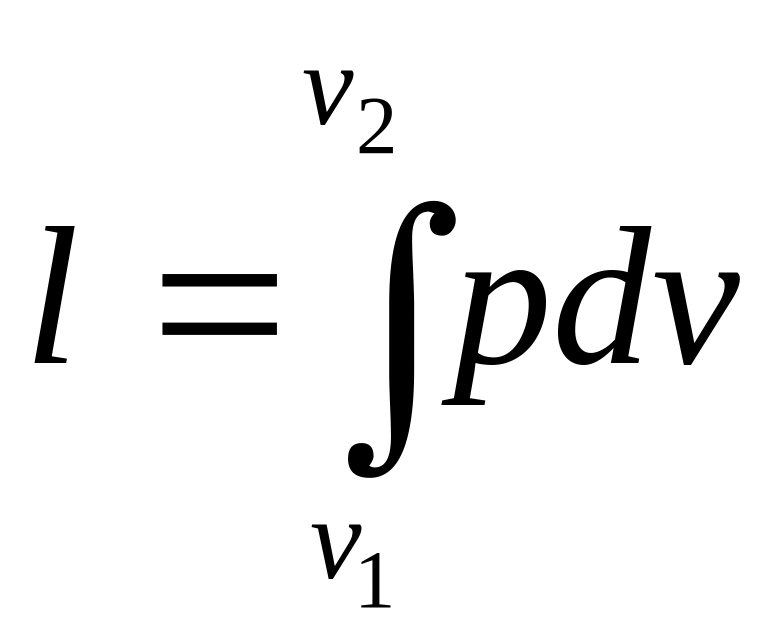 (5.7)
(5.7)
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1 кг):
du=cv dt, (5.8)
Интегрируя это выражение в пределах температур (t1 – t2), получаем:
∆u=cvm(t1-t2), (5.9)
где cvm – средняя массовая теплоемкость при постоянном объеме в пределах (t1 – t2).
В технической термодинамике выражение (u+pv) является параметром состояния, который называют энтальпией, и обозначают буквой - i.
i= u+pv (5.10)
Основное уравнение первого закона, выраженное через энтальпию, имеет вид:
dq=di - vdp, (5.11)
Для идеальных газов:
di=cpdT
Следовательно,
![]() (5.12)
(5.12)
где cpm – средняя массовая теплоемкость при постоянном давлении в пределах от 0 до Т.
интегрируя уравнение (59) при р=const, получаем:
qр=i2 – i1, (5.13)
Таким образом количество теплоты в процессе при Р=const численно можно найти как разность энтальпий конечного и начального состояния.
