
- •1. Основные понятия термодинамики: термодинамическая система, параметры экстенсивные и интенсивные, функция состояния, ее свойства. Уравнения состояния.
- •1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
- •2) Работа любого циклического процесса равна его теплоте:
- •3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).
- •4. Нулевой закон термодинамики. Эмпирическая температура.
- •6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
- •7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.
- •8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
- •12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
- •16.Циклические процессы. Термодинамический кпд. Цикл Карно. Приведите цикл Карно на диаграмме p(V). Кпд цикла Карно.
- •17.Теорема Карно. Теорема Клаузиуса. Теорема Карно-Клаузиуса. Свойства цикла Карно.
- •19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
- •24.Системы переменного состава. Химический потенциал как парциальная молярная величина экстенсивного свойства системы. Приведите выражения для приращений функций dF,dG для систем переменного состава.
- •26.Уравнения Гиббса-Дюгема. Какие важные соотношения можно получить, используя эти уравнения.
- •27. Приведите выражения для химического потенциала компонента в идеальных и реальных газовых системах. Какие факторы влияют на значение химического потенциала. Что такое летучесть компонента?
- •53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
- •54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.
- •55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
- •56. Экстракция. Сформулируйте закон распределения Нернста. От каких факторов зависит численное значение коэффициента распределения? Применение экстракции в фармации.
- •65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
- •75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •97. Понятие катализа. В чем состоит ключевое отличие гомогенного катализа от гетерогенного? От каких факторов зависит скорость реакции в случае гомогенного и в случае гетерогенного катализа?
- •99. Ферментативный катализ. Теория Михаэлиса-Ментен. Основные постулаты теории Константа Михаэлиса. Экспериментальные методы определения константы Михаэлиса.
65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
а) I2(тв) + 2е = 2I; б) MnO4- + 8H+ + 5e = Mn2+ + 4Н2O.
Укажите, для каких из этих систем восстановительные потенциалы зависят от pН среды, и как эти потенциалы будут изменяться (увеличиваться или уменьшаться) при добавлении в раствор небольших количеств кислоты или щелочи.
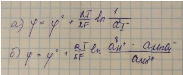
Восст. потенциал зависит от pH у марганца.
При добавлении к нему кислоты концентрация протонов увеличится, восст. потенциал тоже увеличится. При добавлении щелочи протонов будет меньше, восст. потенц. уменьшится.
66. Металлооксидные электроды II рода. Приведите электродную реакцию, выражение для электродного потенциала, условную запись электрода. Применение электрода. Приведите пример электрохимической цепи с сурьмянооксидным электродом для измерения pH. Какую функцию выполняет этот электрод в данной цепи?


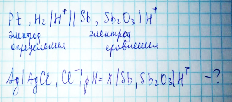
Выполняет роль электрода сравнения.
67. Электроды с инертным электродным материалом. Хингидронный электрод. Запишите электродную реакцию, уравнение Нернста для электродного потенциала. В каких средах можно использовать хингидронный электрод для измерения pH. Приведите условную запись электрохимической цепи, с помощью которой можно измерять pH.



68. Электроды с инертным электродным материалом. Газовые электроды. Какие требования предъявляют к электродному материалу в газовых электродах. Водородный электрод. Устройство, электродная реакция, уравнение Нернста для водородного электрода. Применение.

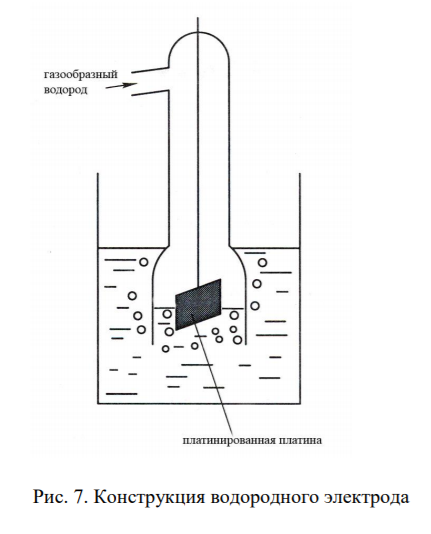
В газовых электродах могут быть использованы не любые металлы, а лишь те, которые обладают высокой каталитической активностью по отношению к реакции газ — ионы газа в растворе. Кроме того, потенциал металла в газовом проводнике не должен зависеть от активности других ионов, присутствующих в растворе, в частности от активности собственных металлических ионов. Являясь катализатором реакции между газом и его ионами в растворе, металл газового электрода в то же время должен быть инертным по отношению к другим возможным реакциям. Наконец, металл в газовом электроде должен обеспечивать создание по возможности большей поверхности раздела, на которой могла бы протекать обратимая реакция перехода газа в ионное состояние. Всем этим требованиям лучше всего удовлетворяет платина, которая чаще всего и используется при конструировании газовых электродов. Для создания развитой поверхности платину покрывают электролитически платиновой чернью.


69. Сложные Red-OX электроды. Приведите примеры перманганатного электрода в кислой и нейтральной средах. Приведите электродные реакции. Запишите уравнение Нернста для этих электродов. Где используют эти электроды?

Электродный потенциал сложных окислительно-восстановительных электродов зависит от водородного показателя среды. Используются для измерения pH.
70. Стеклянный электрод. Устройство. Запишите уравнение электродной реакции и соответствующее уравнение Нернста для электродного потенциала. Применение стеклянного электрода. Приведите условную запись электрохимическом цепи, с помощью которой можно измерить pH раствора.
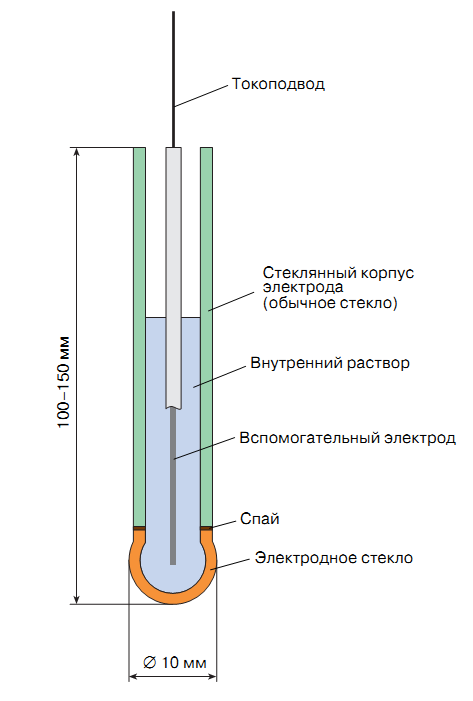



71. Потенциометрические методы анализа. Применение стеклянного хлорсеребряного электродов для определения концентрации соляной кислоты. Приведите интегральную и дифференциальную кривые титрования соляной кислоты щелочью NaOH. Как определить точку эквивалентности.
Основаны на использовании электродвижущей силы электрохимической (потенциометрической ) ячейки от концентрации (активности) определяемого вещества в анализируемой растворе. Простейшая потенциометрическая ячейка содержит два электрода; потенциал одного из них прямо или косвенно зависит от концентрации определяемого вещества – его называют индикаторным (ионселективным) электродом; и второй электрод относительно которого измеряется потенциал индикаторного электрода, называемый электродом сравнения.



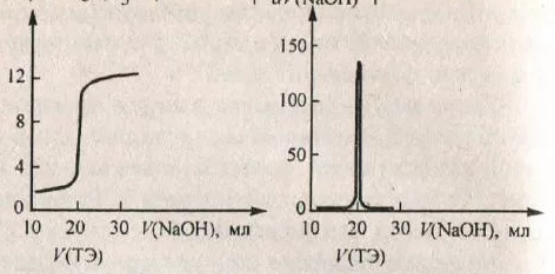

Точка эквивалентности в титриметрическом анализе - момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
Определение точки эквивалентности:
С помощью pH-метров При достижении точки эквивалентности pH резко изменяется
На графике: на дифф. графике это пик. На интегральном изменение pH:
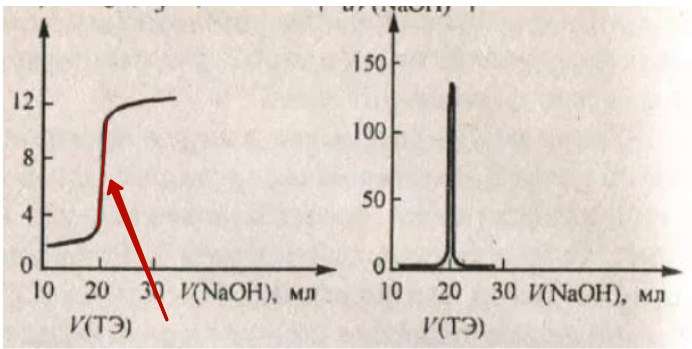
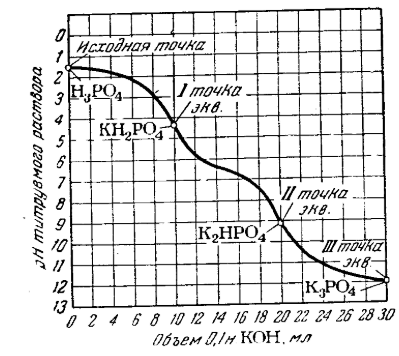
72. Потенциометрические методы анализа. Применение стеклянного и хлорсеребряного электродов для определения концентрации фосфорной кислоты. Приведите интегральную и дифференциальную кривые титрования форсфорной кислоты щелочью NaOH. Как определить точку эквивалентности. Определите концентрацию фосфорной кислоты по различным точкам эквивалентности.
см. выше +

При добавлении гидроксида натрия протекает первая стадия нейтрализации:
Н3РО4 + NaOH → NaH2PО4 + Н2О.
От начала титрования до первой точки эквивалентности ортофосфорная кислота в избытке, гидроксид натрия нейтрализует ее по первой стадии не полностью.
В растворе присутствует буферная смесь (Н3РО4 + NaH2PО4).
В первой точке эквивалентности вся ортофосфорная кислота оттитрована по первой стадии, в растворе присутствует только кислая соль NaH2PО4.
После первой и до второй точки эквивалентности происходит нейтрализация по второй стадии:
NaН2РО4 + NaOH → Na2HPО4 + Н2О.
В растворе присутствуют буферная смесь слабая «кислота» NaН2РО4- и ее соль Na2HPО4.
Во второй точке эквивалентности вся ортофосфорная кислота оттитрована по второй ступени и в растворе присутствует кислая соль Na2HPО4.

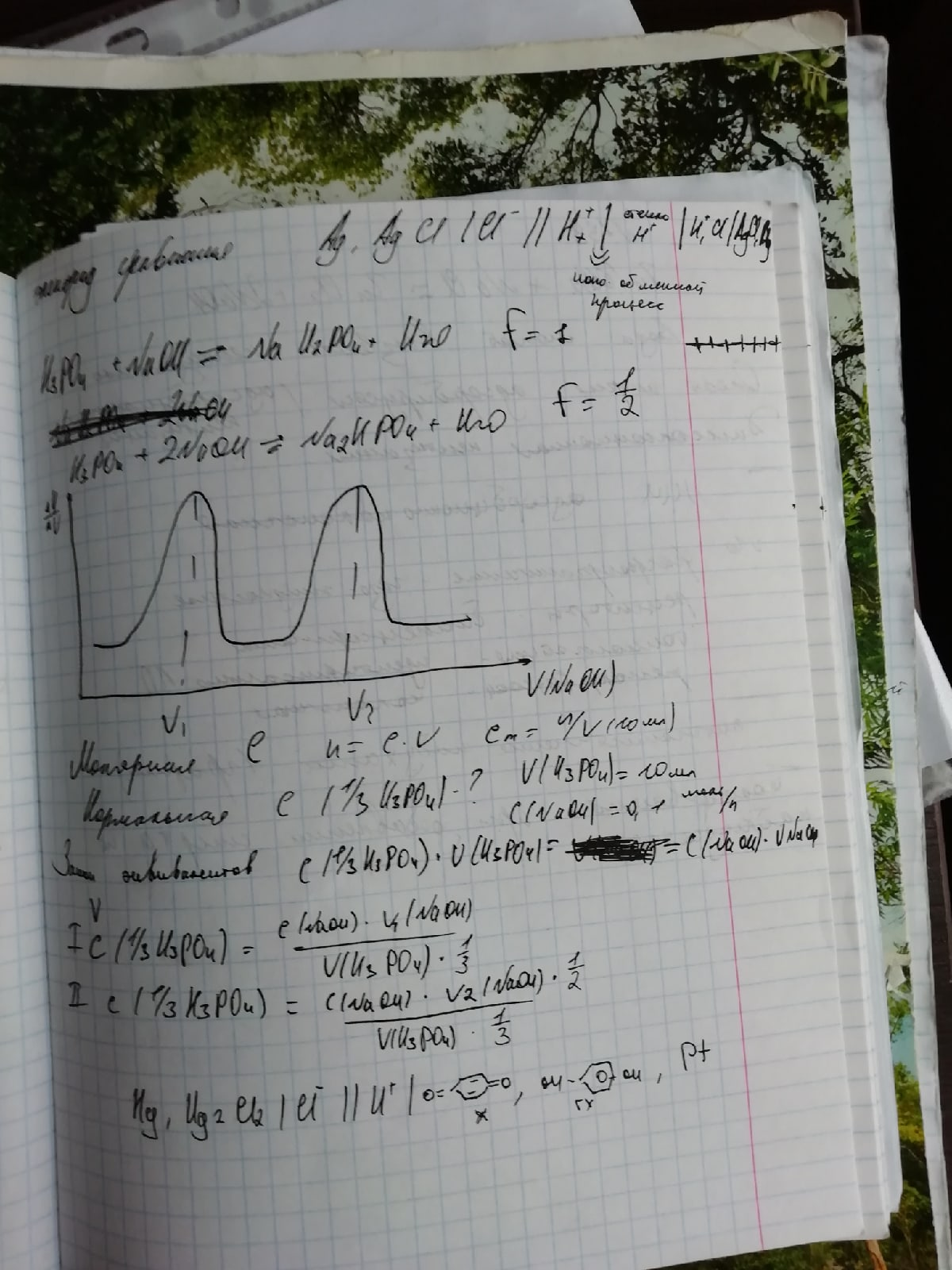
73. Приведите краткую запись гальванической цепи, состоящей из никелевого электрода, погруженного в раствор хлорида никеля с активностью ионов Ni2+ 0,1 моль/л и кадмиевого электрода, погруженного в раствор сульфата кадмия с активностью ионов Cd2+ = 10 -3 моль/л. Для предупреждения возникновения диффузионного потенциала растворы соединены солевым мостиком из насыщенного раствора KCl. Запишите формулу для рассчета ЭДС данной гальванической цепи.
Как считать:
ОВ потенциал будет меньше у того, у кого активность (концентрация) ионов меньше — прямая зависимость.
Cd2+ — анод. Ni2+ — катод.
Cd|Cd2+||KCl||Ni2+|Ni
φ(а) = -0,4 + (0,059/2) * lg0.01 = -0.459
φ(к) = -0,25 + (0,059/2) * lg0.1 = -0,2795
E= φ(к) - φ(а) = -0,2795 + 0.459 = 0,1795
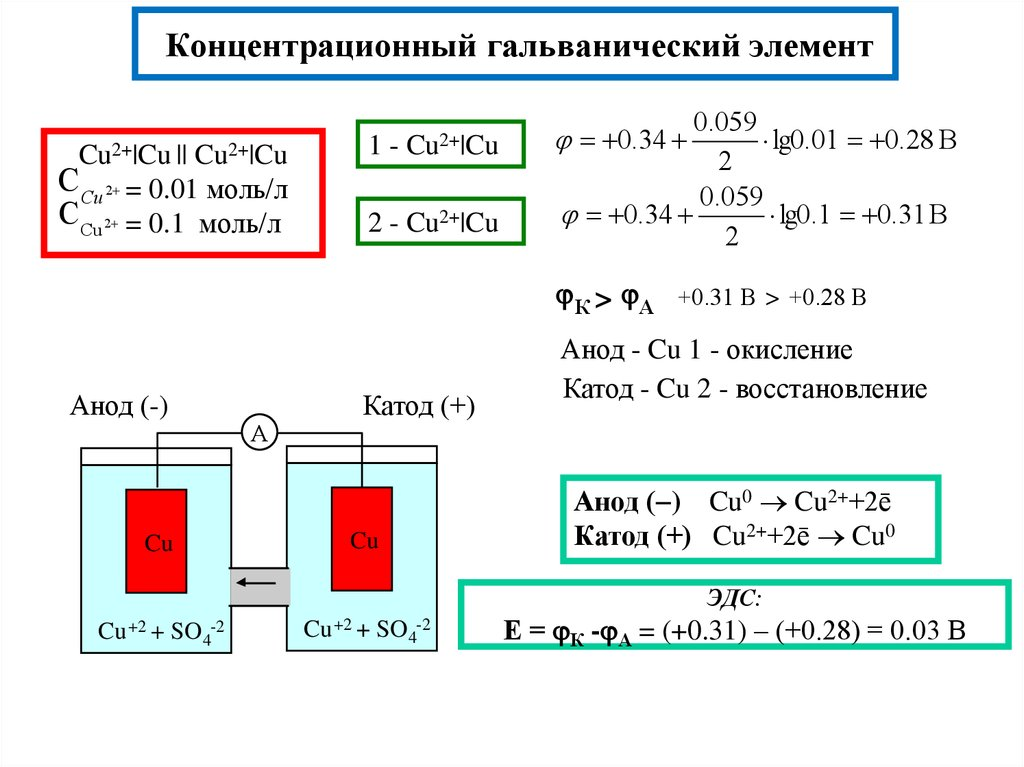
74. Электроды I рода. Где используются электроды 1 рода. Что такое медно-цинковый элемент Даниэля-Якоби? Приведите схему и условную запись элемента. Какие полуреакции протекают на его электродах? Укажите тип (электрохимический или концентрационный) и знаки электродов гальванического элемента:
Cu | CuSO4 || CuSO4 | Cu
0,5M 0.025M

Металлические электроды первого рода часто используют в качестве индикаторных электродов в аналитической химии. Индикаторные электроды позволяют определить активность (концентрацию) ионов металла путем измерения их потенциалов.



Укажите тип (электрохимический или концентрационный) и знаки электродов гальванического элемента:
Cu | CuSO4 || CuSO4 | Cu
0,5M 0.025M
Концентрационный элемент — это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С1 > С2. Катодом в этом гальваническом элементе является электрод, погруженный в раствор с большей концентрацией, а анодом соответственно погруженным в раствор с меньшей концентрацией.
Купрум слева с большей концентрацией — катод, а справа — анод.
