
- •1. Основные понятия термодинамики: термодинамическая система, параметры экстенсивные и интенсивные, функция состояния, ее свойства. Уравнения состояния.
- •1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
- •2) Работа любого циклического процесса равна его теплоте:
- •3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).
- •4. Нулевой закон термодинамики. Эмпирическая температура.
- •6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
- •7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.
- •8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
- •12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
- •16.Циклические процессы. Термодинамический кпд. Цикл Карно. Приведите цикл Карно на диаграмме p(V). Кпд цикла Карно.
- •17.Теорема Карно. Теорема Клаузиуса. Теорема Карно-Клаузиуса. Свойства цикла Карно.
- •19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
- •24.Системы переменного состава. Химический потенциал как парциальная молярная величина экстенсивного свойства системы. Приведите выражения для приращений функций dF,dG для систем переменного состава.
- •26.Уравнения Гиббса-Дюгема. Какие важные соотношения можно получить, используя эти уравнения.
- •27. Приведите выражения для химического потенциала компонента в идеальных и реальных газовых системах. Какие факторы влияют на значение химического потенциала. Что такое летучесть компонента?
- •53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
- •54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.
- •55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
- •56. Экстракция. Сформулируйте закон распределения Нернста. От каких факторов зависит численное значение коэффициента распределения? Применение экстракции в фармации.
- •65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
- •75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •97. Понятие катализа. В чем состоит ключевое отличие гомогенного катализа от гетерогенного? От каких факторов зависит скорость реакции в случае гомогенного и в случае гетерогенного катализа?
- •99. Ферментативный катализ. Теория Михаэлиса-Ментен. Основные постулаты теории Константа Михаэлиса. Экспериментальные методы определения константы Михаэлиса.
1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
2) Работа любого циклического процесса равна его теплоте:
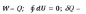
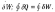
Работа (W) - форма передачи энергии под влиянием физических сил, имеющих направление (обобщённых сил Хi). Работа - функция процесса, зависит от пути (W>0, W<0). Работа считается положительной, если она производится системой (процесс расширения системы), отрицательной - если работа производится над системой со стороны окружающей среды (сжатие термодинамической системы). Работа квазистатического процесса всегда больше работы любого реального процесса. В системе СИ измеряется в Дж.
Виды работы - механическая, электрическая, магнитная и др. Бесконечно малая работа любого вида (δWi) - произведение обобщенной силы X, на изменение обобщенной координаты δхi=Хi*dхi; совершаемая под действием давления (р): δW=pdV. (Знак δ означает бесконечно малое приращение функции, которая не является функцией состояния).
Полезная работа (W) - сумма всех видов работ за исключением механической работы,бесконечно малая полезная работа - δW'
В
общем виде бесконечно малая работа
равна сумме механической и полезной
работ:

Простая термодинамическая система - система, в которой совершается только механическая работа; (δW =0).
Сложная термодинамическая система - система, в которой имеет место полезная работа; (δW'≠ 0).
Теплота (Q) - форма передачи энергии посредством хаотического движения молекул(путем теплообмена). Теплота - функция процесса, зависит от пути (Q>0 , Q<0) . Теплота, полученная от окружающей среды, считается положительной. Теплота, которая отводится от системы, считается отрицательной. Бесконечно малая теплота (δQ) не является полным дифференциалом. В системе СИ измеряется в Дж.
Внутренняя энергия (U) - характеризует общий запас энергии системы, за исключением кинетической и потенциальной энергии системы в целом. Она включает все виды энергии движения и взаимодействия частиц, составляющих систему. Внутренняя энергия - функция состояния. Имеет полный дифференциал dU. Абсолютное значение определить невозможно, определяют только ее изменение. В системе СИ измеряется в Дж.
Энтальпия системы (Н) - функция состояния H=U+PV
Полный дифференциал: dH = dU+PdV+VdP.
Абсолютное значение Н определить невозможно, определяют только ее изменение. В системе СИ измеряется в Дж.
Функции состояния: энтальпия, внутренняя энергия, энергия Гиббса, свободная энергия Гельмгольца, энтропия.
Функции процесса: теплота, работа.
Свойства функции состояния:
-
Численное значение однозначно определяется состоянием системы.
-
Изменение функции состояния не зависит от пути процесса, а определяется только начальным и конечным состояниями системы.
-
Функция состояния имеет полный дифференциал.
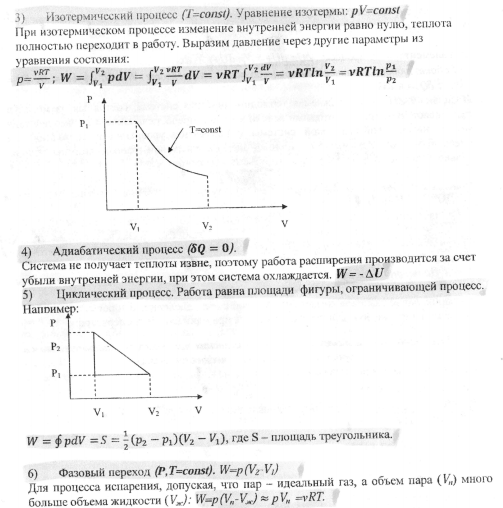
3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).

4. Нулевой закон термодинамики. Эмпирическая температура.
Нулевой закон ТД: Если системы А и В находятся каждая в тепловом равновесии с системой С, то можно утверждать, что системы А и В находятся в тепловом равновесии друг с другом.
Пусть системы А и С обладали равновесными давлениями и объемами Р'А, V’A и Р'с, V’с соответственно. Если привести эти системы в контакт, то установятся новые равновесные давления и объемы: PA, VA и Рс, Vc соответственно, но теперь они связаны условием равновесия, причем fA (РА, VA) = fc (Рс, Vc ).
Таким образом, существует функция f (Р, V), значение которой одинаково для двух систем, находящихся в равновесии друг с другом. Для трех систем А, В, С:
fA (РА, VA) = fB (РБ, VB) = fc (Рс, Vc) =1, или f (Pc, Vc, t) - 0
Функция f(P, V), определенная таким образом, называется эмпирической температурой t.
Нулевой закон термодинамики лежит в основе измерения температуры с помощью термометров.
5. Теплоемкость. Физический смысл удельной и молярной теплоемкости. Единицы измерения. Связь между теплоемкостью при P=const и теплоемкостью при V=const для идеальных газов (уравнение Майера).
Теплоемкость - отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры (при отсутствии химической реакции, переходов вещества из одного агрегатного состояния в другое и при условии, что полезная работа на совершается). Теплоемкость обычно рассчитывают либо на единицу массы вещества (удельная теплоемкость - Дж/г*К), либо на 1 моль вещества (молярная теплоемкость - Дж/моль*К)
Средняя теплоемкость (Сср): Сср = Q/ΔT, ΔТ = Т2-Т1, где Т1 и Т2- температуры нагреваемой системы до и после нагревания соответственно.
Истинная
теплоемкость (С)
- отношение бесконечно малой теплоты к
бесконечно малому изменению температуры:
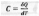
Молярная теплоемкость при постоянном давлении (калорический коэффициент Ср, Дж/моль*К) - частная производная по температуре от энтальпии Н:
Ср=(дН/дТ)Р
Для бесконечно малого изменения энтальпии v моль систем: dH = vCpdT.
Для полного изменения: ΔН = v СРΔТ (если Ср= const)
Молярная теплоемкость при постоянном объеме (калорический коэффициент Сv, Дж/моль*К) - частная производная по температуре от внутренней энергии U:
Cv=(dU/dT)v
Для бесконечно малого изменения внутренней энергии v моль системы: dU =v Сv dT. Для полного изменения: ΔU= v СvΔТ (если Сv=const)
Соотношение между калорическими коэффициентами Ср и Сv. Уравнение Майера Для 1 моль идеального газа энтальпия и внутренняя энергия связаны между собой соотношением: H= U + Р V= U + RT
(дH/дT)P = (дU/дT)v+R,
откуда: Cp=Cv + R (уравнение Майера).
|
Идеальный газ |
Сv (Дж/мольК) |
Ср (Дж/мольК) |
|
Одноатомный |
3/2 R |
5/2 R |
|
Двухатомный |
5/2 R |
7/2 R |
|
Трехатомный (молекулы линейного строения) |
7/2 R |
9/2 R |
Для жидкостей и твердых веществ коэффициент термического расширения очень мал, поэтому с достаточной точностью можно считать, что СР= Сv.
