
- •1. Основные понятия термодинамики: термодинамическая система, параметры экстенсивные и интенсивные, функция состояния, ее свойства. Уравнения состояния.
- •1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
- •2) Работа любого циклического процесса равна его теплоте:
- •3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).
- •4. Нулевой закон термодинамики. Эмпирическая температура.
- •6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
- •7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.
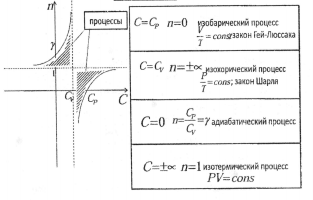
- •8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
- •12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
- •16.Циклические процессы. Термодинамический кпд. Цикл Карно. Приведите цикл Карно на диаграмме p(V). Кпд цикла Карно.
- •17.Теорема Карно. Теорема Клаузиуса. Теорема Карно-Клаузиуса. Свойства цикла Карно.
- •19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
- •24.Системы переменного состава. Химический потенциал как парциальная молярная величина экстенсивного свойства системы. Приведите выражения для приращений функций dF,dG для систем переменного состава.
- •26.Уравнения Гиббса-Дюгема. Какие важные соотношения можно получить, используя эти уравнения.
- •27. Приведите выражения для химического потенциала компонента в идеальных и реальных газовых системах. Какие факторы влияют на значение химического потенциала. Что такое летучесть компонента?
- •53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
- •54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.
- •55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
- •56. Экстракция. Сформулируйте закон распределения Нернста. От каких факторов зависит численное значение коэффициента распределения? Применение экстракции в фармации.
- •65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
- •75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •97. Понятие катализа. В чем состоит ключевое отличие гомогенного катализа от гетерогенного? От каких факторов зависит скорость реакции в случае гомогенного и в случае гетерогенного катализа?
- •99. Ферментативный катализ. Теория Михаэлиса-Ментен. Основные постулаты теории Константа Михаэлиса. Экспериментальные методы определения константы Михаэлиса.
6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
Теплота любого циклического процесса равна его работе.
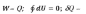
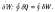
7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.

Теплота
адиабатического процесса: Q=0
8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
Политропический процесс - общий случай термодинамического процесса, в котором изменяются все параметры.
Уравнения политропы - уравнения, связывающие между собой параметры в политропическом процессе.
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа»
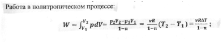
Теплота
в политропическом процессе:
![]()
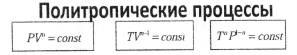
n - показатель
политропы
![]()
Зависимость показателя политропы от теплоемкости:
10.
1 моль идеального газа изобарически при
Р1 расширяется от V1 до V2,
затем изотермически сжимают до исходного
объема и при этом объеме достигает
исходного состояния. Представьте процесс
на диаграмме p(V).
Как называется такой процесс? Как
графически определить теплоту этого
процесса? Является теплота положительной
или отрицательной величиной? Ответ
поясните.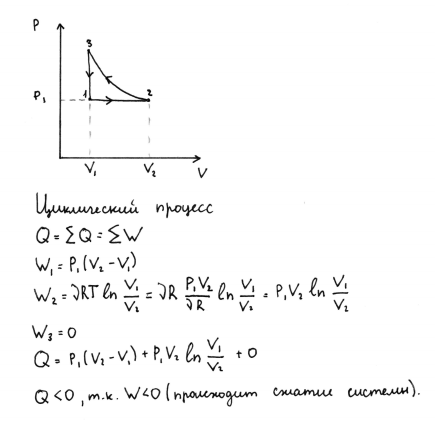
11.2 моль 1-атомного идеального газа находятся при давлении P1 и объеме V1. Газ адиабатически сжимают до V2, затем изохорически понижают температуру, и давление газа становится равным Р2, а затем изотермически расширяют до исходного объема. Представьте процесс на диаграмме p(V). Чему равно изменение внутренней энергии в этом процессе?
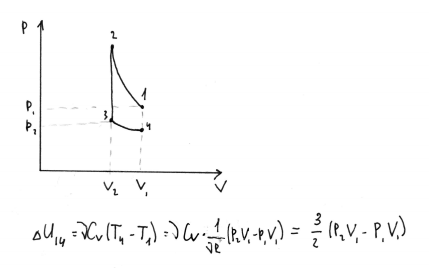
12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
Термохимические уравнения - химические уравнения, в которых указаны агрегатные состояния веществ.
Тепловой эффект реакции равен изменению энтальпии (ΔН, изобарный процесс, Р =const) или изменению внутренней энергии (ΔU, изохорный процесс, V — const ) системы, если соблюдаются условия:
а) процесс протекает необратимо (P=const или И= const);
б) в системе не совершается никакая работа, кроме работы расширения ;
в) продукты реакции имеют ту же температуру, что и исходные вещества.
Стандартная молярная энтальпия реакции, АН0 - изменение энтальпии при стандартных условиях (Р = 1 атм, Т = 298 К).
Стандартная теплота образования (Q) или стандартная молярная энтальпия образования вещества (ΔН0о6р(298 К ) или ΔН0f (298 К) - тепловой эффект реакции образования 1 моль вещества из простых веществ в стандартных условиях.
Теплота образования (энтальпия образования) простого вещества равна нулю.
Стандартная теплота сгорания (Q) или стандартная молярная энтальпия сгорания вещества (ΔН°сг (298 К) или ΔсН° (298 К) - тепловой эффект реакции полного сгорания 1 моль вещества в кислороде в стандартных условиях.
Закон Гесса: тепловой эффект реакции не зависит от пути процесса, а определяется только начальным и конечным состояниями системы.
Суммарный тепловой эффект многостадийного процесса равен алгебраической сумме тепловых эффектов отдельных стадий, например:
![]()
Следствия из закона Гесса
Первое следствие: тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты в уравнении реакции, и суммой теплот образования исходных веществ, умноженных на соответствующие стехиометрические коэффициенты.
![]()
Аналогичное следствие справедливо и для теплового эффекта реакции ΔUxp. при V = const.
Второе следствие: тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ, умноженных на соответствующие стехиометрические коэффициенты в уравнении реакции, и суммой теплот сгорания продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты.
![]()
Аналогичное следствие справедливо и для теплового эффекта реакции ΔUx р при V= const
Третье следствие: тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье- Лапласа).
12. Тепловой эффект химической реакции. Влияние температуры на тепловой эффект химической реакции. Дифференциальная форма уравнения Кирхгофа. Интегральная форма уравнения при условии: а) теплоемкости участников химической реакции не зависят от температуры; б) теплоемкости участников химической реакции зависят от температуры. Привести графики зависимости ( ΔНР.ЦИИ) от температуры (Т).
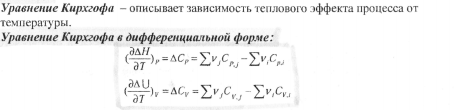


![]()

14, 15 Основные формулировки II начала термодинамики. Математическое выражение II начала термодинамики.Запишите равенство Клаузиуса. Для каких процессов оно выполняется. Понятие энтропии. Какими свойствами обладает энтропия и ее изменение? Как изменяется энтропия при переходе вещества из твердого в жидкое и газообразное состояние?
Второй закон термодинамики определяет наиболее вероятное направление, условия и пределы самопроизвольного протекания процессов.
Основные формулировки 2 начала термодинамики
Постулат Клаузиуса: Невозможно осуществить перенос тепла от более холодного тела, к более горячему без затраты работы
Постулат Томсона (Кельвина): Невозможно превратить какое-либо количество теплоты полностью в работу без того, чтобы часть теплоты не оказалась растраченной при более низкой температуре. Или:
Никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процессов. Или :
Монотермический двигатель, работающий циклически, невозможен.
Монотермический двигатель - двигатель, состоящий только из источника теплоты. Вечный двигатель второго рода невозможен. (Оствальд)
Вечный двигатель второго рода - воображаемая периодически действующая тепловая машина (двигатель), целиком превращающая теплоту, переданную окружающей средой, в работу.
Составляющие двигателя: нагреватель (источник теплоты) рабочее тело—> холодильник.
Иные формулировки 2 начала термодинамики
Г. Льюис: Каждая система, предоставленная сама себе, изменяется в направлении максимальной вероятности.
При протекании любого реального процесса невозможно обеспечить средства возвращения каждой из участвующих в нем систем в ее исходное состояние.
Э. Ферми : Состояние с максимальной энтропией является наиболее устойчивым для изолированной системы.
Равенство
Клаузиуса (математическое выражение 2
начала термодинамики)любой
замкнутый цикл можно представить как
сумму бесконечного большого числа
бесконечно малых циклов Карно, поэтому
для любого замкнутого обратимого цикла
будет справедливо выражение :
![]()
Энтропия (S) - функция состояния системы, приращение которой в обратимом процессе равно отношению элементарной теплоты δQ процесса к температуре, т.е. приведенной теплоте процесса. Изменение энтропии равно приведенной теплоте (математическая формулировка 2 начала термодинамики).
![]()
Энтропия измеряется в системе СИ в Дж/К.
Энтропию нельзя измерить опытным путем, но ее можно рассчитать на основании экспериментальных данных.
С ростом температуры энтропия вещества (системы) увеличивается :
Некоторые свойства энтропии :
-
Энтропия - функция состояния, имеет полный дифференциал, следовательно, ее изменение ΔS не зависит от пути процесса.
При протекании
химических реакций изменение энтропии
равно![]()
-
Энтропия обладает свойством аддитивности, т.е. энтропия равновесной системы равна сумме энтропий отдельных ее частей, а изменение энтропии всей системы равно сумме изменений энтропии ее частей. Изменение энтропии в сложном процессе равно сумме изменений энтропии в отдельных стадиях процесса.
-
Энтропия S - мера разупорядоченности (хаотичности) системы. Чем больше неупорядоченность системы, тем выше энтропия системы.
Например, энтропия (неупорядоченность) возрастает при превращении жидкости или твердого тела в газ; энтропия возрастает при растворении твердого вещества или жидкости в воде или в другом растворителе; энтропия уменьшается при растворении газа в воде или в другом растворителе.
Энтропия тем больше, чем сложнее химический состав вещества.
-
Энтропия является критерием возможности и направления процессов, а также состояния термодинамического равновесия в изолированных или адиабатически- изолированных системах. Если в изолированной системе протекает самопроизвольный необратимый процесс, то энтропия возрастает ΔS>0.
