
- •1. Основные понятия термодинамики: термодинамическая система, параметры экстенсивные и интенсивные, функция состояния, ее свойства. Уравнения состояния.
- •1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
- •2) Работа любого циклического процесса равна его теплоте:
- •3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).
- •4. Нулевой закон термодинамики. Эмпирическая температура.
- •6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
- •7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.
- •8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
- •12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
- •16.Циклические процессы. Термодинамический кпд. Цикл Карно. Приведите цикл Карно на диаграмме p(V). Кпд цикла Карно.
- •17.Теорема Карно. Теорема Клаузиуса. Теорема Карно-Клаузиуса. Свойства цикла Карно.
- •19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
- •24.Системы переменного состава. Химический потенциал как парциальная молярная величина экстенсивного свойства системы. Приведите выражения для приращений функций dF,dG для систем переменного состава.
- •26.Уравнения Гиббса-Дюгема. Какие важные соотношения можно получить, используя эти уравнения.
- •27. Приведите выражения для химического потенциала компонента в идеальных и реальных газовых системах. Какие факторы влияют на значение химического потенциала. Что такое летучесть компонента?
- •53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
- •54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.
- •55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
- •56. Экстракция. Сформулируйте закон распределения Нернста. От каких факторов зависит численное значение коэффициента распределения? Применение экстракции в фармации.
- •65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
- •75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •97. Понятие катализа. В чем состоит ключевое отличие гомогенного катализа от гетерогенного? От каких факторов зависит скорость реакции в случае гомогенного и в случае гетерогенного катализа?
- •99. Ферментативный катализ. Теория Михаэлиса-Ментен. Основные постулаты теории Константа Михаэлиса. Экспериментальные методы определения константы Михаэлиса.
53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
Активность (a) -такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
Активность может быть как меньше, так и больше номинальной концентрации вещества в растворе. Активность чистого растворителя, а также растворителя в не слишком концентрированных растворах принимается равной 1. За 1 принимается также активность твёрдого вещества, находящегося в осадке, или жидкости, не смешивающейся с данным раствором. В бесконечно разбавленном растворе активность растворённого вещества совпадает с его концентрацией.
Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
Коэффициент активности - это своеобразный поправочный коэффициент, показывающий, насколько реальность отличается от идеала.
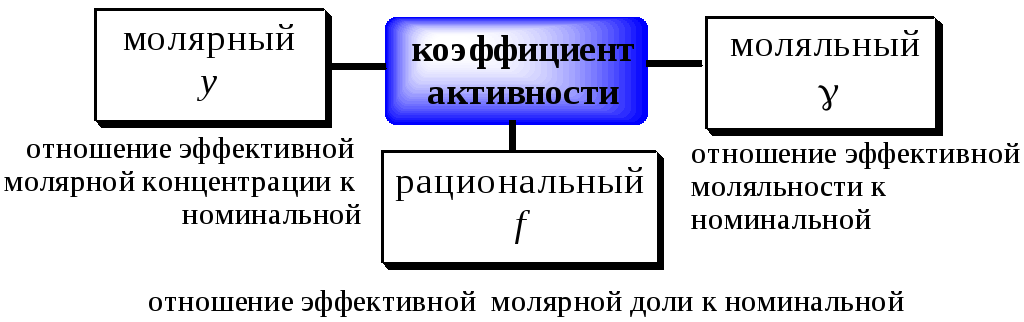

Коэффициент активности находится в обратной зависимости от концентрации электролита.
Ионная сила раствора (I, размерность концентрации) – это полусумма произведений концентраций всех ионов в растворе на квадрат их заряда.
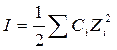
где Zi – заряд i-го иона; Ci — моляльная (молярная) концентрация иона (с учетом стехиометрического коэффициента)
Правило ионной силы:
Средний ионный коэф.активности зависит только от ионной силы р-ра и не зависит от других ионов,нах-ся в р-ре. Область применения: 0,01-0,02 моль/кг
(При добавлении в р-р сильного эл-та, не имеющего общих ионов с нашей малораств. солью ПР не изм-ся, т.к.зависит только от Т и р.Раств-ть уменьшится, т.к. увеличится I.)
54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.


Также необходимо учитывать следующие факторы:
-Влияние рН водной среды -Использование маскирующих агентов -Взаимное влияние экстрагируемых веществ

55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
Важной характеристикой экстракции является фактор (или степень) извлечения
R = n (A) / n (A)нач ,
где n (A) – количество вещества в органической фазе;
n (A)нач - начальное количество вещества в водном растворе.
Очевидно, что:
n (A) = [A]o * Vo ,
n(A)нач = САо * Vв = [А]в *Vo + [A]в * Vв ,
где САо – концентрация вещества А в начальном водном растворе.
Тогда, фактор извлечения будет иметь вид:
R = [A]o * Vo / [A]o Vo + [A]в *Vв .
Поделим числитель и знаменатель полученного выражения на [А]в*Vo и найдем:
R = ( [A]o / [А]в) / ( [А]в / [А]в+Vв / Vo ) = D / ( D + Vв/Vo ),
где D = [A]o / [А]в , r = Vo / Vв ,
Тогда R = D / ( D + 1/r ) .
Это уравнение относится к однократной экстракции и остается справедливым при многократном повторении этой операции. Степень извлечения при m – кратной экстракции:
Rm = 1 – ( 1 / ( D* r + 1 )m ) .
Физический смысл данного уравнения состоит в том, что целесообразнее экстрагировать маленькими порциями растворителя несколько раз, чем 1-2 раза большими порциями экстрагента. Степень извлечения возрастает по мере увеличения числа операций m при данном объеме экстрагента.
Кратко:

Степень извлечения вещества с помощью экстракции зависит от свойств выбранного растворителя и от состояния вещества в водной фазе. Некоторые вещества можно практически полностью извлечь при однократной экстракции. Для других требуется двух -, трех - или многократная экстракция.
