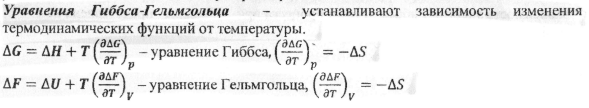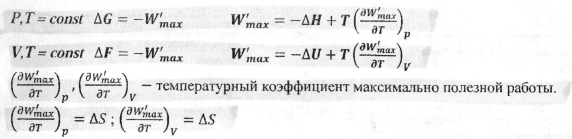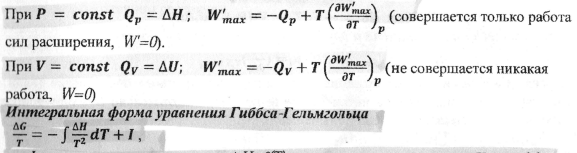- •1. Основные понятия термодинамики: термодинамическая система, параметры экстенсивные и интенсивные, функция состояния, ее свойства. Уравнения состояния.
- •1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
- •2) Работа любого циклического процесса равна его теплоте:
- •3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).
- •4. Нулевой закон термодинамики. Эмпирическая температура.
- •6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
- •7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.
- •8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
- •12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
- •16.Циклические процессы. Термодинамический кпд. Цикл Карно. Приведите цикл Карно на диаграмме p(V). Кпд цикла Карно.
- •17.Теорема Карно. Теорема Клаузиуса. Теорема Карно-Клаузиуса. Свойства цикла Карно.
- •19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
- •24.Системы переменного состава. Химический потенциал как парциальная молярная величина экстенсивного свойства системы. Приведите выражения для приращений функций dF,dG для систем переменного состава.
- •26.Уравнения Гиббса-Дюгема. Какие важные соотношения можно получить, используя эти уравнения.
- •27. Приведите выражения для химического потенциала компонента в идеальных и реальных газовых системах. Какие факторы влияют на значение химического потенциала. Что такое летучесть компонента?
- •53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
- •54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.
- •55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
- •56. Экстракция. Сформулируйте закон распределения Нернста. От каких факторов зависит численное значение коэффициента распределения? Применение экстракции в фармации.
- •65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
- •75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •97. Понятие катализа. В чем состоит ключевое отличие гомогенного катализа от гетерогенного? От каких факторов зависит скорость реакции в случае гомогенного и в случае гетерогенного катализа?
- •99. Ферментативный катализ. Теория Михаэлиса-Ментен. Основные постулаты теории Константа Михаэлиса. Экспериментальные методы определения константы Михаэлиса.
19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
Расчет изменения энтропии в различных обратимых процессах.
1.Изохорический процесс, V - const
![]()
2.Изобарический процесс, нагревание или охлаждение при Р= const:
a.теплоемкость - величина постоянная (Ср = const) в исследуемом интервале
температур
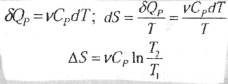
b.теплоемкость зависит от температуры (реальная система, Ср=f(T)), тогда изменение энтропии вычисляют следующим образом:
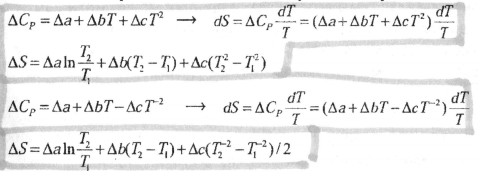
3. Изотермический процесс, обратимое расширение или сжатие при T= const:
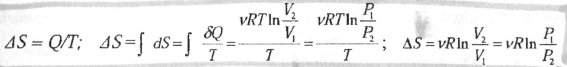
Для необратимого изотермического процесса ΔS >Q/T
4.Адиабатический процесс, δQ = 0; S = const; ΔS=0
5.Изменение энтропии при смешивании двух идеальных газов (изобарно - изотермический процесс):
![]()
6.Расчет
изменения энтропии фазового превращения
(например, плавление, испарение и т.д. -
изобарно-изотермический процесс):
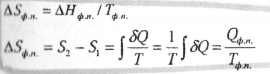
При подводе к системе теплоты (процессы плавления, испарения) - энтропия возрастает.При отводе теплоты (процессы кристаллизации, конденсации) - энтропия уменьшается.
7.Для химической реакции
![]()

20. 1 моль идеального газа находится при давлении P1 и объеме V1. Газ адиабатически сжимают до V2, затем изохорически повышают температуру, и давление газа становится равным Р2, а затем изотермически расширяют до исходного объема и при этом объеме возвращают в исходное состояние. Представьте процесс на диаграмме p(V). Чему равны изменения энтропии и энтальпии в этом процессе?
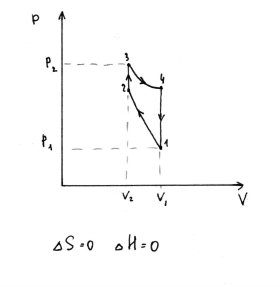
21.2 моль идеального одноатомного газа изобарически при P1 расширяют от V1 до V2, затем изотермически сжимают до исходного объема. Представьте процесс на диаграмме p(V), запишите выражение для расчета ΔS через заданные параметры.
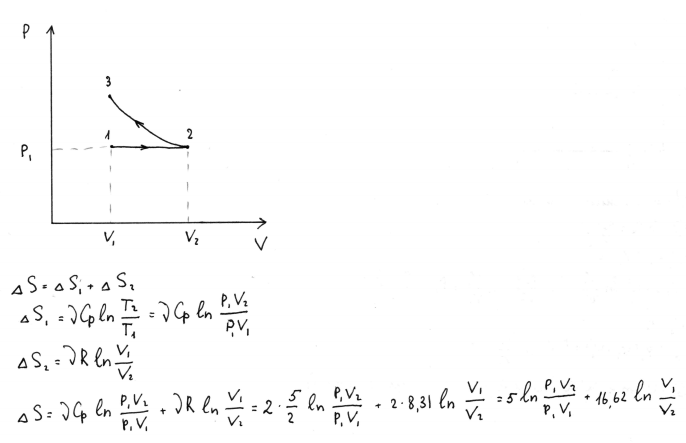
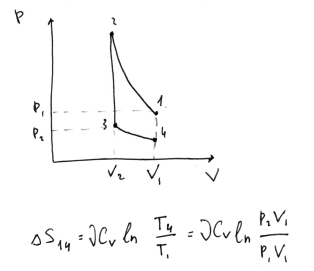
22. 1 моль идеального газа находится при давлении P1 и объеме V1. Газ адиабатически сжимают до V2, затем изохорически понижают температуру, и давление газа становится равным Р2, а затем изотермически расширяют до исходного объема. Представьте процесс на диаграмме p(V). Чему равно изменение энтропии в этом процессе?
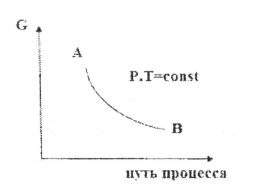
23.Объединенное уравнение I и II начала термодинамики. Характеристические термодинамические функции U,H,G, F. Приращение функций dF,dG (ΔF, ΔG). Их значение для описания состояния равновесия и возможности самопроизвольного протекания процессов в закрытых термодинамических системах. Приведите график зависимости энергии Гиббса от пути процесса при P,T=const.

Характеристические функции такие функции состояния, посредством которых, а также с помощью их частных производных можно получить полную термодинамическую характеристику системы.(U- внутренняя энергия; Н- энтальпия; G - энергия Гиббса; F- энергия Гельмгольца). Эти функции называют также термодинамическими потенциалами.
Соотношения между характеристическими термодинамическими функциями.
H = U + PV; G = H-TS; F = U-TS
TS- связанная энергия, также является функцией состояния.

Зависимость энергии Гиббса от пути процесса:
24.Характеристические термодинамические функции ΔF, ΔG и максимально полезная работа процесса. Приведите условия термодинамического равновесия в системе при V,T=const.
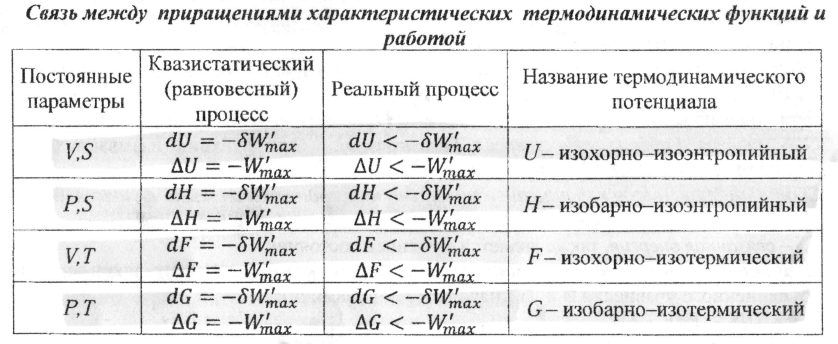
Условия равновесия:
![]()