
- •1. Основные понятия термодинамики: термодинамическая система, параметры экстенсивные и интенсивные, функция состояния, ее свойства. Уравнения состояния.
- •1) Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение ею работы.
- •2) Работа любого циклического процесса равна его теплоте:
- •3. Работа. Определение работы в изотермически, изохорическом, изобарическом и адиабатическом процессах. Изобразите эти процессы на диаграмме p(V).
- •4. Нулевой закон термодинамики. Эмпирическая температура.
- •6. Теплота. Определение теплоты в изотермическом, изохорическом, изобарическом процессах. Теплота циклического процесса.
- •7.Адиабатический процесс. Уравнения адиабаты работа и теплота в адиабатическом процессе.
- •8,9.Политропический процесс. Уравнения политропы. Работа и теплота в политропическом процессе.Показатель политропы. Привести график зависимости показателя политропы (n) от теплоемкости (с).
- •12. Закон Гесса и следствия из него. Дайте определения тепловому эффекту химической реакции, стандартной энтальпии образования и сгорания веществ. Термохимическое уравнение реакции.
- •16.Циклические процессы. Термодинамический кпд. Цикл Карно. Приведите цикл Карно на диаграмме p(V). Кпд цикла Карно.
- •17.Теорема Карно. Теорема Клаузиуса. Теорема Карно-Клаузиуса. Свойства цикла Карно.
- •19.Равенство Клаузиуса. Расчет энтропии в различных термодинамических процессах с идеальным газом: изохорическом, изобарическом, изотермическом, адиабатическом, политропическом.
- •24.Системы переменного состава. Химический потенциал как парциальная молярная величина экстенсивного свойства системы. Приведите выражения для приращений функций dF,dG для систем переменного состава.
- •26.Уравнения Гиббса-Дюгема. Какие важные соотношения можно получить, используя эти уравнения.
- •27. Приведите выражения для химического потенциала компонента в идеальных и реальных газовых системах. Какие факторы влияют на значение химического потенциала. Что такое летучесть компонента?
- •53. Что такое активность и коэффициент активности? Как зависит коэффициент активности от общей концентрации электролита? Сформулируйтe правило ионной силы Льюиса-Рендалла.
- •54. Дайте определение экстракции. Какие факторы влияют на процесс экстракции? Коэффициент распределения.
- •55. Экстракция. Что называется степенью извлечения r? От каких факторов зависит численное значение степени извлечения?
- •56. Экстракция. Сформулируйте закон распределения Нернста. От каких факторов зависит численное значение коэффициента распределения? Применение экстракции в фармации.
- •65. Запишите уравнение Нернста для электродного потенциала следующих систем в водных растворах:
- •75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
- •97. Понятие катализа. В чем состоит ключевое отличие гомогенного катализа от гетерогенного? От каких факторов зависит скорость реакции в случае гомогенного и в случае гетерогенного катализа?
- •99. Ферментативный катализ. Теория Михаэлиса-Ментен. Основные постулаты теории Константа Михаэлиса. Экспериментальные методы определения константы Михаэлиса.
75. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для следующей ов-реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
H2O2 + 2KI = l2(aq) + 2КОН. Запишите электродные реакции и приведите условную запись гальванического элемента, в котором обратимо протекает эта реакция, руководствуясь правилами ИЮПАК.
E= φ(к) - φ(а) = 1.234
φ(к) = 1.77
φ(а) = 0.536
I2+ 2e = 2I- анод H2O2 + 2e = 2OH- катод
ΔrG298 = -ZEF = - (1.234*2*96478) = -238107 Дж = -238,107 кДж
=> самопроизвольное протекание возможно
Условная запись:
I2 | I- || OH- | H2O2
76. Рассчитайте значения эдс в стандартных условиях и ΔrG298 для окислительно- восстановительной реакции и сделайте вывод о возможности ее самопроизвольного протекания в данных условиях:
2KMnO4 + 16НСl = 2КCl + 2МnCl2 + 5Cl2 + 8Н20. Запишите электродные реакции и
приведите условную запись гальванического элемента, в котором обратимо протекает эта реакция, руководствуясь правилами ИЮПАК.
E= φ(к) - φ(а) = 1.51-1.359 = 0,151
ΔrG298 = -ZEF = - (0.151*10*96478) = -145.681 кДж
Реакция пойдет в прямом направлении.
Анод: Cl2 + 2e = 2Cl-
Катод: MnO4- + 8H+ + 5e = Mn2+ + 4H2O
Cl2 | Cl- || MnO4-, Mn2+, H+| Pt
77. Рассчитайте значения ЭДС в стандартных условиях и константу равновесия (Ка) Для окислительно-восстановительной реакции: 2Fe3+ + 2I- = 2Fe2+ + I2
сделайте вывод о возможности ее самопроизвольного протекания в данных условиях. Запишите электродные реакции и приведите условную запись гальванического элемента, в котором обратимо протекает эта реакция руководствуясь правилами ИЮПАК.
E= φ(к) - φ(а) = 0,771 - 0,536 = 0,235
Реакция пойдет в прямом направлении.
катод: Fe3+ +1e = Fe2+ анод: I2 + 2e = 2I-
E0 = (RT/ZF)*lnKa
lgKa = 0.235/(0.059/2) = 7,9661
Ka = 9.249 * 10^7
I2 | I- || Fe3+, Fe2+ | Pt
78. Составьте уравнение реакции между FeSO4, и КMnO4 в растворе серной кислоты. Рассчитайте значения ЭДС в стандартных условиях и константу равновесия для данной окислительно-восстановительной реакции, сделайте вывод о возможности ее самопроизвольного протекания в стандартных условиях. Запишите электродные реакции и приведите условную запись гальванического элемента, в котором обратимо протекает эта реакция, руководствуясь правилами ИЮПАК.
10FeSO4 + 2KMnO4 +8H2SO4 -> 2MnSO4 +5 Fe2(SO4)3 + K2SO4 + 8H2O
E= φ(к) - φ(а) = 1.51-0.771 = 0.739
катод: MnO4- + 8H+ + 5e = Mn2+ + 4H2O анод: Fe3+ +1e = Fe2+
E0 = (RT/ZF)*lnKa
lgKa = 0.739/(0.059/5) = 62.6271
Ka = 4.24 * 10^62
Pt | Fe2+, Fe3+ || MnO4-, Mn2+, H+| Pt
79. Физические гальванические элементы. Приведите примеры таких элементов. Приведите выражение для ЭДС таких цепей. От каких факторов она зависит.



80. Дайте определение порядка реакции по веществу и общего (полного) кинетического порядка реакции. Может ли порядок реакции быть нулевым, дробным, отрицательным? От каких факторов зависит порядок данной реакции? Экспериментальные методы определения порядка реакции.
Общий порядок реакции:

Порядки по веществам равны стехиометрическим коэффициентам.

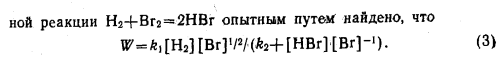





81. Необратимые реакции 1 порядка. Что называется порядком химической реакции? Период полупревращения для реакции 1 порядка. Приведите примеры реакций 1 порядка. Каким образом на основе экспериментальных данных можно определить порядок реакции и константу скорости реакции 1 порядка? Приведите характерные для реакции 1 порядка графические зависимости.



Все реакции радиоактивного распада являются реакциями первого порядка. Также можно привести в пример реакции изомеризации, распада некоторых молекул в газовой фазе: N2O5, CH3-O-CH3 и т.д.
Методы, при помощи которых можно определить реакции 1 порядка:
1. Метод подбора уравнений.
Метод состоит в подстановке экспериментальных данных по концентрации веществ для каждого момента от начала реакции в кинетические уравнения различных порядков (этот прием ничего не дает, если порядок реакции превышает 3 или является дробным):
k = (1/t) lnс0/с (первый порядок)
Порядок реакции будет соответствовать тому уравнению кинетики, для которого при различных начальных концентрациях исходных веществ и в различные моменты времени при заданной температуре константа скорости будет величиной постоянной.
2. Графические интегральные методы.
Находят такую функцию от концентрации, отложив которую на графике, в зависимости от времени, получают прямую линию.
3. По периоду полупревращения.
По зависимости периода полупревращения от начальной концентрации:
И другие методы, приведенные ранее.
82. Дайте определение порядка реакции. Какие экспериментальные данные необходимы для его определения? Можно ли на основании измерения порядка реакции судить о ее сложности? Молекулярность химической реакции. Приведите примеры моно- и бимолекулярных реакций.
См. выше +
Какие экспериментальные данные необходимы для его определения?

Можно ли на основании измерения порядка реакции судить о ее сложности?


83. Поясните термин "молекулярность" реакции. Почему молекулярность реакций не превышает трех? В чем различие понятий "порядок" и "молекулярность" химической реакции? Может ли молекулярность быть больше или меньше порядка реакции? Для каких реакций порядок и молекулярность всегда совпадают?
См. выше +


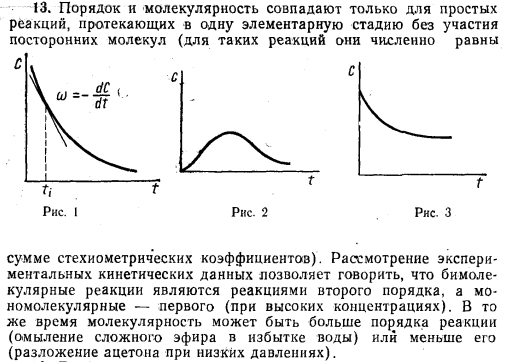
84. В каких координатах наблюдается линейная зависимость между концентрацией реагирующего вещества и временем для реакций нулевого, первого и второго порядков? Вещество X в растворе участвует в реакции 1-го порядка X—>У. Напишите кинетическое уравнение данной реакции. Изобразите схематически
графическую зависимость с(х) = f(t) и ln(c) = f(t).
См. выше +
Кинетическое уравнение:

При интегрировании:

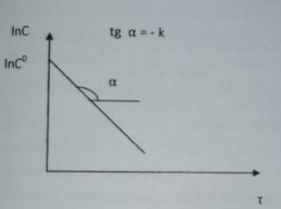
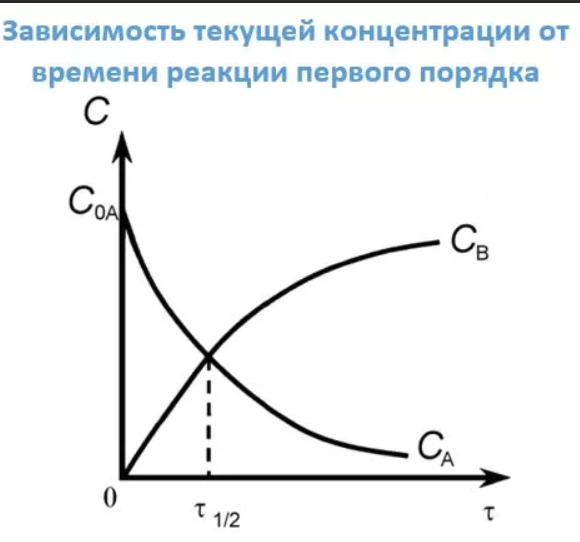
85. Необратимая реакция 2-го порядка: 2А—>В. Нарисуйте график зависимости концентрации исходного вещества и продукта реакции от времени. Запишите основное кинетическое уравнение. Приведите уравнение зависимости обратной концентрации 1/С от времени. Как период полупревращения зависит от начальной концентрации? Как графически определить константу скорости реакции? Какова ее размерность?



86. Для реакции А + 2В -> С + D запишите основное кинетическое уравнение, если она имеет нулевой порядок по веществу А и второй порядок по веществу В. Приведите зависимость 1/C(B) =f(t). Как графически определить константу скорости реакции. Какова ее размерность.
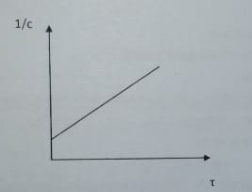
87. Влияние температуры на скорость химической реакции? Приведите уравнение Аррениуса. Что такое энергия активации? Приведите зависимость In K = f(1/T). Как на основании экспериментальных данных определить энергию активации?


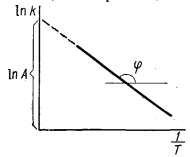


88. Какой смысл вкладывается в понятие «энергия активации»? Какая стадия сложной реакции определяет общую скорость процесса — с наименьшей или с наибольшей энергией активации? Как на основании экспериментальных данных можно определить энергию активации? Приведите график зависимости In K = f(1/T).
См. выше +

Принцип лимитирующей стадии - скорость последовательной реакции определяется скоростью наиболее медленной стадии, суммарная скорость параллельных реакций определяется скоростью наиболее быстрой стадии.
89. При определенных условиях реакция Н2(г) + Вг2(г) = 2НВг(г) имеет первый порядок по водороду и 0.5 порядок по брому. Запишите кинетическое уравнение этой реакции. Каков ее суммарный порядок? Рассчитайте константу скорости этой реакции и определите ее размерность, если при концентрациях обоих реагентов по 0.25 моль/л скорость реакции равна 5*10^-4 моль* л -1 * с-1.
v=k*c^1(H2)*C^0.5(Br2)
подставляем концентрации и считаем
суммарный порядок реакции 1,5
90. Сложные химические реакции. Какие реакции называются сложными? Принцип независимости протекания химических реакций. Какая реакция называется лимитирующей. Примеры сложных реакций.



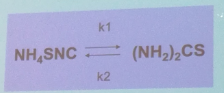
91. Обратимая реакция первого порядка. Кинетические уравнения. Приведите характерные кинетические кривые. Примеры обратимых реакций.

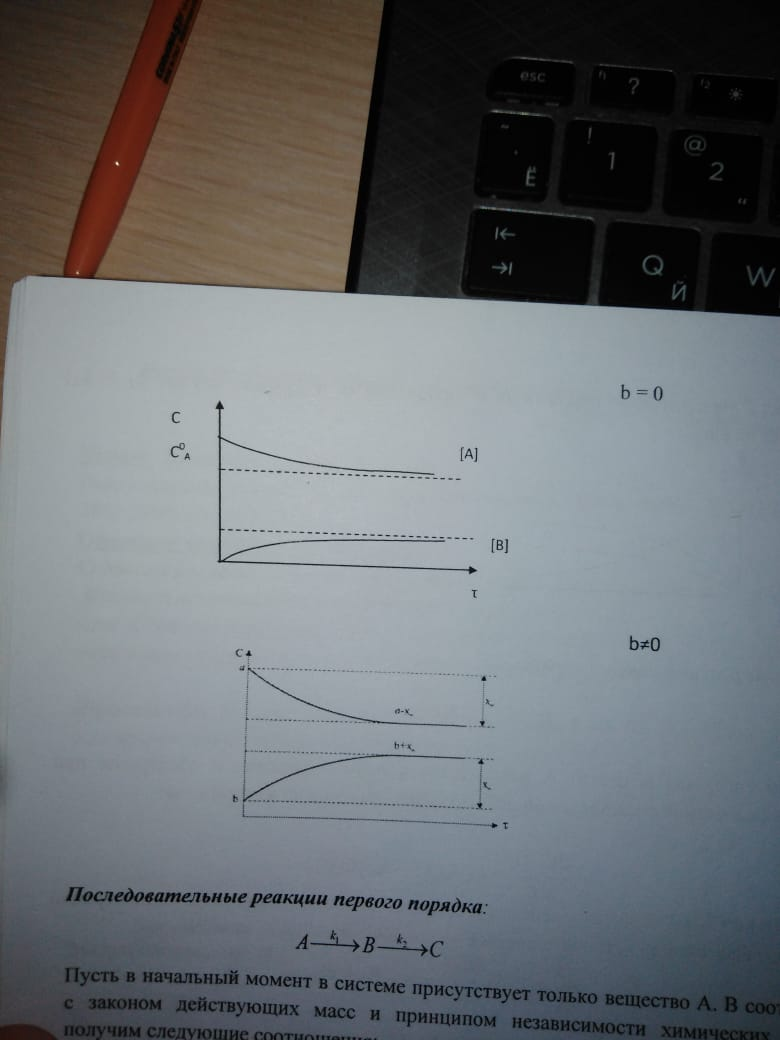


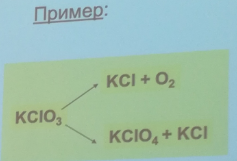
92. Параллельные реакции. Кинетические уравнения. Приведите характерные кинетические кривые. Примеры параллельных реакций.

93. Последовательные реакции. Кинетические уравнения. Приведите характерные кинетические кривые. Примеры последовательных реакций.


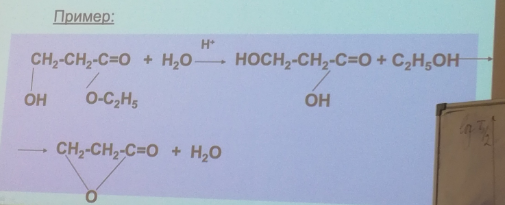
94. Последовательные реакции. Крайние случаи в кинетике последовательных реакций, «переходное» и «вековое равновесие». Примеры последовательных реакций.
Примеры см. выше



95. Бимолекулярные реакции в газовой фазе. Схема Линдемана.




Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Доп. инфо:

96. Теория активных соударений. Основные положения. Физический смысл энергии активации.
Физ. смысл см. выше
Сильное влияние температуры на скорость химической реакции объясняет теория активных столкновений
Основные положения:
-
не каждое столкновение приводит к химической реакции
-
к химическому взаимодействию приводят только те столкновения, в которых участвуют частицы, обладающие энергии, необходимые для данного взаимодействия (энергия активации) при их столкновении частицы должны быть определенным образом сориентированы относительно друг друга

