
- •Часть 1
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №2 Способы очистки веществ от примесей
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №3 Определение плотности металла
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №4 Установление формулы кристаллогидрата
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №5 Определение молекулярной массы углекислого газа
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №6 Определение эквивалентной и атомной массы металла
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №7 Комплексные соединения
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №7 Скорость химических реакций
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №9 Химическое равновесие
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №10 Приготовление растворов
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №11 Произведение растворимости
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №12 Ионнообменные реакции
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №13 Гидролиз солей
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №14 Окислительно-восстановительные реакции
- •2. Теоретическая часть
- •3. Экспериментальная часть
Лабораторная работа №11 Произведение растворимости
1. Цель работы: получение, исследование и объяснение свойств некоторых малорастворимых и практически нерастворимых веществ с помощью справочных значений произведения растворимости.
2. Теоретическая часть
Твердые вещества характеризуются различной растворимостью в воде. Наряду с хорошо растворимыми веществами существуют малорастворимые и практически нерастворимые. Однако абсолютно нерастворимых веществ в природе нет. Любое вещество, хотя бы в ничтожной степени, но все же обладает растворимостью.
Растворимость вещества оценивается по концентрации его насыщенного раствора. Концентрация насыщенного раствора малорастворимого или практически нерастворимого вещества очень мала, т.е. раствор очень разбавлен. Если растворенное вещество является электролитом, то оно в очень разбавленном растворе практически нацело диссоциировано на ионы (в соответствии с законом разбавления Оствальда).
Рассмотрим равновесие между твердым осадком малорастворимой соли, например АgCl, и её ионами в растворе:
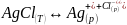
Уравнение для константы равновесия имеет вид:

Концентрация
твердой фазы
 ,
как величина постоянная, из выражения
для константы равновесия исключается.
Тогда константа равновесия определяется
только произведением концентраций
ионов
,
как величина постоянная, из выражения
для константы равновесия исключается.
Тогда константа равновесия определяется
только произведением концентраций
ионов
 и
и называется произведением
растворимости (ПР):
и
и называется произведением
растворимости (ПР):
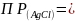
В
общем виде для соединения
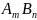

Величина произведения растворимости характеризует растворимость малорастворимых и практически нерастворимых веществ (электролитов) при постоянной температуре. Значения ПР приведены в справочниках и в табл.13.
Произведение растворимости позволяет вычислить концентрацию насыщенного раствора малорастворимого или практически нерастворимого электролита. Для соединения растворимость определяется по формуле
 ,
моль/л
,
моль/л
Для хлорида серебра концентрация насыщенного раствора или растворимость (S) вычисляется по формуле:

для
PbCl2
–
по формуле

для
Са3(РО4)2
–
по формуле
 .
.
По значениям ПР можно определять направление протекания ионообменных реакций в растворах в тех случаях, когда и в левой, и в правой частях уравнения реакции находятся малорастворимые или практически нерастворимые вещества. Например, реакция:
AgBr (ПР = 5,3·10-13) + КI = КBr + AgI (ПР = 8,3·10-17)
протекает в прямом направлении, а реакция:
AgBr (ПР = 5,3·10-13) + КСl = КBr + AgCl (ПР = 1,8·10-10)
– в обратном, то есть в сторону менее растворимых веществ. Такие реакции называются реакциями переосаждения малорастворимых веществ или реакциями двойного обмена.
Постоянство величины ПР не означает постоянства концентраций отдельных ионов. Концентрацию каждого из них можно изменять. Можно увеличить концентрацию Сl--ионов в насыщенном растворе хлорида серебра, добавив, например, НСl. Это нарушит состояние равновесия диссоциации, сдвинет его влево, так как избыточное (по сравнению с равновесным) количество ионов Сl- приведет к увеличению скорости обратной реакции осаждения (Ag+ + Cl- = AgCl). Вновь установившееся равновесие будет по-прежнему характеризоваться той же величиной ПР, однако равновесные концентрации изменятся: концентрация ионов Ag+ будет меньше, а ионов Cl- больше по сравнению с прежним состоянием равновесия. Дополнительное осаждение AgCl происходит потому, что при прибавлении соляной кислоты произведение концентраций ионов становится больше величины произведения растворимости:
[Ag+][Cl-] > ПР
Напротив, если понизить концентрацию, связав ионы Ag+ в комплекс [Ag(NH3)2]+, тогда осадок, в соответствии с принципом Ле-Шателье, начнет растворяться. Условием растворения осадка является соотношение:
[Ag+][Cl-] < ПР
Если в растворе находятся катионы нескольких различных металлов, то их можно перевести в осадок последовательно один за другим, связывая в малорастворимые или практически нерастворимые вещества с различными значениями ПР. Такая операция называется дробным осаждением; она применяется для разделения и очистки веществ, при их синтезе и анализе.
Таким
образом, произведение растворимости
ПР характеризует гетерогенное равновесие:
осадок
 раствор для малорастворимых и практически
нерастворимых веществ и широко
используется в химии и химической
технологии.
раствор для малорастворимых и практически
нерастворимых веществ и широко
используется в химии и химической
технологии.
