
- •Контрольні запитання і завдання
- •Контрольні запитання і завдання
- •Лабораторна робота № 3 добування карбон (іv) оксиду та вивчення його властивостей. Взаємоперетворння карбонатів та гідрогенкарбонатів
- •Деякі характерні реакції на катіони та аніони представлені в таблиці 1.
- •Виконання роботи
- •Лабораторна робота №8 розв’язування експериментальних задач на розпізнавання органічних речовин
- •Лабораторна робота № 9 вивчення властивостей полімерів
ЛАБОРАТОРНА РОБОТА №1
ТЕМА: ДОБУВАННЯ АМОНІАКУ. ВИВЧЕННЯ ЙОГО ВЛАСТИВОСТЕЙ. СОЛІ АМОНІЮ
МЕТА: Розглянути лабораторний спосіб добування амоніаку та його фізичні і хімічні властивості. Ознайомитися з характерними властивостями солей амонію. Закріплювати вміння складати рівняння реакцій, що підтверджують хімічні властивості амоніаку та солей амонію.
ТЕОРЕТИЧНА ЧАСТИНА
У лабораторії амоніак добувають з амонійних солей при дії на них лугів:
NH4 NO3 + NaOH = NaNО3 + NH3 + H2O
За звичайних умов амоніак NH3 – безбарвний газ із специфічним запахом, температура плавлення -78° С, температура кипіння -33° С. Амоніак у 0,6 разів легший за повітря. Добре розчинний у воді (1:700 за температури 20ºС), його водний розчин називають нашатирним спиртом.
Взаємодія амоніаку з водою полягає у виникненні зв’язків між NH3 і водою H2O. При розведенні у воді NH3 · H2O дисоціює лише частково:
NH3 + H2O « NH3 · H2O « NH4+ + ОН-
Водний розчин амоніаку – це слабка основа. Часто водний розчин амоніаку зображують формулою NH4ОН і називають амоній гідроксидом.
Дисоціацію можна умовно показати рівнянням:
NH4ОН « NH4+ + ОН-
Гідроксид амоніаку – нестійка сполука, тому його водний розчин має запах амоніаку:
NH4ОН « NH3 + H2O.
Як слабка основа гідроксид амонію здатен вступати в реакції нейтралізації з кислотами:
NH4ОН + HNO3 = NH4NO3 + H2O.
Добре реагує з кислотами і сухий амоніак:
NH3 + HNO3 = NH4NO3.
Якісна реакція на йон амонію – взаємодія з лугами при нагріванні. До отвору пробірки, де реагує суха суміш солі амонію та лугу або їх водні розчини, підносять змочений дистильованою водою червоний лакмусовий папірець. Нагрівають суху суміш до початку виділення газу, а розчин – до моменту закипання. Спостерігають посиніння зволоженого червоного лакмусового папірця внаслідок реакції:
NH4Сl + NaOH →NH4OH + NaCl,
H2O « NH3 · H2O « NH4+ + ОН-.
Катіон амонію веде себе подібно до йона калію К+. Солі амонію – білі кристалічні речовини, добре розчинні у воді, сильні електроліти, з йонним типом зв’язку. Дисоціюють за схемою:
NH4Сl « NH4+ + Cl-.
Солі амонію – термічно нестійкі сполуки. При нагріванні вони розкладаються. Продукти розпаду залежать від характеру аніона.
1. Якщо у складі солі амонію перебуває аніон нелеткої кислоти, то сіль розкладається на вихідні сполуки – амоніак і кислоту. Наприклад:
NH4Сl
![]()
NH3 + НCl.
2. Якщо в складі солі перебуває аніон нелеткої кислоти-неокисника, то продукти розкладу значною мірою залежать не лише від природи аніона, але й від температури:
(NH4)2SO4
NH3 + NH4HSO4,
якщо температура менша 147ºС.
Якщо температура перевищує 147ºС, то розклад відбувається за схемою:
(NH4)2SO4
2NH3 + Н2О + (NH4)2S2O7.
3. Якщо до складу солі входить аніон кислоти-окисника, розклад набуває необоротного характеру:
NH4NO3
N2O + 2H2O,
NH4NO2
N2 + 2H2O.
Контрольні запитання і завдання
1. Напишіть чотири рівняння хімічних реакцій, в результаті яких утворюється амоніак.
2. Схарактеризуйте роль умов (тиск, температура, каталізатор) у промисловому синтезі амоніаку.
3. При пропусканні амоніаку через трубку з розжареним купрум (ІІ) оксидом утворюється металічна мідь. Напишіть рівняння цієї реакції, вкажіть окисник та відновник, покажіть перехід електронів.
4. Чому амоніак з кислотами реагує активніше, ніж з водою? Яка суть цих хімічних реакцій?
5. Розчин амоніаку у воді називають гідроксидом амонію та аміачною водою. Обґрунтуйте ці назви.
6. Складіть рівняння реакцій, в результаті яких утворюється:
а) дигідроортофосфат амонію;
б) гідроортофосфат амонію;
в) ортофосфат амонію.
7. Гідрокарбонат амонію іноді використовують при випіканні кондитерських виробів. Які властивості гідрокарбонату амонію при цьому використовуються?
8. Запишіть рівняння реакцій за схемами:
а) азот ® амоніак ® амоній гідроксид ® амоній нітрат;
б) амоній гідроксид ® амоній хлорид ® амоніак;
в) амоніак ® амоній гідроксид ® амоній ортофосфат.
9. Урівняйте методом електронного балансу, вкажіть перехід електронів, визначте окисника та відновника:
NH4NO3
N2O + H2O,
NH4NO2
N2 + H2O.
ЛІТЕРАТУРА:
Сухан В.В., Табенська Т.В. та ін. Хімія: Посібник для вступників до вузів. Київ: Либідь, 1996 рік – стор. 241-243.
ВИКОНАННЯ РОБОТИ
ДОСЛІД 1. ДОБУВАННЯ АМОНІАКУ ТА РОЗЧИНЕННЯ ЙОГО У ВОДІ.
Приготуйте суміш кристалічного амоній хлориду та калій гідроксиду у співвідношенні 1:1. Пробірку закрийте корком з газовідвідною трубкою і суміш нагрівайте у полум’ї спиртівки. Одержаний амоніак збирайте у перевернуту догори дном пробірку Наповнення пробірки амоніаком контролюйте зволоженим лакмусовим папірцем, підносячи його періодично до отвору пробірки-приймача.
По завершенні наповнену пробірку закрийте великим пальцем і опустіть у кристалізатор з водою. Що спостерігаєте? Напишіть рівняння реакцій добування амоніаку та розчинення його у воді.
Опишіть спостереження та фізичні властивості амоніаку.
ДОСЛІД 2. ДІЯ РОЗЧИНУ АМОНІАКУ НА ІНДИКАТОРИ.
Випробуйте розчин амоніаку лакмусовим папірцем та фенолфталеїном. Що спостерігаєте? Напишіть рівняння дисоціації амоній гідроксиду.
Зафарбований фенолфталеїном розчин амоній гідроксиду розділіть на дві пробірки. Одну залиште для контролю, а другу прокип’ятіть. Чому розчин поступово знебарвлюється? Відповідь підтвердіть рівнянням відповідної реакції.
ДОСЛІД 3. ВЗАЄМОДІЯ АМОНІАКУ З НІТРАТНОЮ КИСЛОТОЮ.
До газовідвідної трубки з амоніаком піднесіть скляну паличку, змочену концентрованою нітратною кислотою. Що спостерігаєте? Напишіть рівняння відповідної реакції.
ДОСЛІД 4. ВЗАЄМОДІЯ АМОНІЙ ГІДРОКСИДУ З ХЛОРИДНОЮ КИСЛОТОЮ.
До 1 мл зафарбованого фенолфталеїном розчину амоній гідроксиду додайте краплинами хлоридну кислоту. Що спостерігаєте? Напишіть рівняння реакцій у молекулярній, йонно-молекулярній та йонній формі.
ДОСЛІД 5. ВЗАЄМОДІЯ РОЗЧИНУ АМОНІАКУ З СОЛЯМИ.
Злийте попарно по 1 мл розчинів амоній гідроксиду і таких солей:
а) плюмбум (ІІ) нітрату;
б) ферум (ІІІ) хлориду.
Опишіть спостереження. Напишіть рівняння реакцій у молекулярній, йонно-молекулярній та йонній формі.
ДОСЛІД 6. РЕАКЦІЇ РОЗКЛАДУ СОЛЕЙ АМОНІЮ.
Насипте на термостійку пластинку у вигляді гірки солі дихромату амонію, ретельно розтертої у ступці. Розігрійте скляну паличку у полум’ї спиртівки і піднесіть до соляної гірки. Спостерігайте зміну забарвлення солі внаслідок горіння у вигляді виверження вулкана.
Напишіть рівняння реакції, урівняйте методом електронного балансу.
ВИСНОВОК: Зробіть узагальнення про добування амоніаку, його хімічні властивості, про властивості водного розчину амоніаку та солей амонію.
ЛАБОРАТОРНА РОБОТА №2
ХІМІЧНІ ВЛАСТИВОСТІ СУЛЬФАТНОЇ КИСЛОТИ
МЕТА: Розглянути загальнокислотні властивості сульфатної кислоти, якісну реакцію на сульфат-йон. Удосконалювати вміння ілюструвати властивості сульфатної кислоти відповідними рівняннями реакцій.
ТЕОРЕТИЧНА ЧАСТИНА
Фізичні властивості. Сульфатна кислота H2SO4 – (безводна) – важка, безбарвна, оліїста рідина, густина 98%-вої кислоти 1,84 г/см3, сильна кислота, нелетка, запаху не має, є водовідбираючим реагентом завдяки надзвичайній гігроскопічності, їдка речовина, при розчиненні у воді виділяється велика кількість теплоти.
Хімічні властивості.
1. Дисоціація кислоти.
І ступінь:
H2SO4
↔
Н+
+
НSO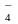 - гідроген сульфат-йон (гідросульфат-йон),
- гідроген сульфат-йон (гідросульфат-йон),
ІІ ступінь:
НSO
↔ Н+
+ SO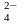 - сульфат-йон.
- сульфат-йон.
Сумарне рівняння:
H2SO4 ↔ 2Н+ + SO .
Відповідно солі сульфатної кислоти діляться на кислі і середні:
┌ солі ┐
гідрогенсульфати ← кислі середні → сульфати
(гідросульфати)
Взаємодія з основами.
Сульфатна кислота реагує з основами (розчинними у воді – лугами, нерозчинними у воді – гідроксидами важких металів, амфотерними гідроксидами) з утворенням кислих та середніх солей:
2КОН + H2SO4 = К2SO4 + 2Н2О (калій сульфат, середня сіль);
КОН + H2SO4 = КHSO4 + Н2О (калій гідрогенсульфат, кисла сіль).
Отже, гідрогенсульфати утворюються тоді, коли кислота перебуває у надлишку
Взаємодія з оксидами металів.
Сульфатна кислота реагує з оксидами металів – основними, кислотними, амфотерними:
СаО + H2SO4 = СаSO4 + Н2О (кальцій сульфат),
Al2O3 + H2SO4 = Al2(SO4)3 + Н2О (алюміній сульфат),
Взаємодія з солями.
Вступає в реакцію обміну з солями, утвореними слабшими або леткими чи нерозчинними у воді кислотами:
К2СО3 + H2SO4 = К2SO4 + СО2↑+ Н2О,
2КNO3 + H2SO4 = К2SO4 + 2НNO3,
ВаСl2 + H2SO4 = ВаSO4↓+ 2НСl↑,
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3.
5. Якісна реакція на сульфат-йон (на сульфатну кислоту та її солі) – взаємодія з йоном барію (тобто з розчинними солями барію чи з барій гідроксидом) – випадає молочно-білий осад, нерозчинний ні у воді, ні у кислотах:
Ва2+ + SO = ВаSO4 ↓.
Взаємодія з металами.
а) Розбавлена сульфатна кислота реагує з активними металами, що стоять в ряді активності металів до Гідрогену з утворенням солі і виділенням водню:
Zn + H2SO4 = ZnSO4 + H2↑,
Fe + H2SO4 = Fe SO4 + H2↑.
б) Концентрована сульфатна кислота – сильний окисник. Взаємодіє з металами, що в ряду активності металів стоять після Гідрогена:
Сu0
+ 2 H2S O4
= Cu+2SO4
+
S+4O4
+ H2O.
O4
= Cu+2SO4
+
S+4O4
+ H2O.
Сu0 – 2е → Cu+2
S + 2е → S+4
Продукти реакції залежать від концентрації сульфатної кислоти та активності металу. Сульфур може відновлюватися від ступеня окиснення +4 до –2 (SO4, S, H2S).
Залізо, алюміній та хром пасивуються концентрованою сульфатною кислотою на холоді, але реагують при нагріванні. Платина та золото не реагують навіть при нагріванні.
