Клетки иммунной системы
В иммунном ответе участвует целый ряд клеток и выделяемых ими растворимых продуктов. Центральная роль всегда принадлежит лейкоцитам, однако другие клетки также вносят свой вклад, посылая сигнал лимфоцитам и отвечая на сигнальные молекулы цитокины, выделяемые Т-клетками и макрофагами.

В поддержании иммунитета принимают участие лимфоциты и фагоциты.
Фагоциты поглощают антигены и патогенные микроорганизмы и разрушают их. Для выполнения этих функций фагоциты располагаются повсюду – в соединительной ткани, вокруг базальных мембран мелких кровеносных сосудов, в легких и печени. Кроме того, макрофаги презентируют антигены Т-лимфоцитам, выделяют многочисленные медиаторы воспаления.
Наиболее важная группа способных к фагоцитозу долгоживущих клеток, одна из разновидностей лейкоцитов крови - моноциты. После недолгого пребывания в крови моноциты мигрируют в ткани, где превращаются в тканевые макрофаги, способные поглощать и разрушать чужеродные антигены. На поверхности моноцитов (макрофагов) имеются рецепторы для связывания антител, белков системы комплемента, а также молекул МНС II класса.
Нейтрофилы (или микрофаги) – вторая значительная группа фагоцитирующих клеток, относящихся к зернистым лейкоцитам. Нейтрофилы составляют большинство среди лейкоцитов крови. Подобно моноцитам нейтрофилы мигрируют в ткани, отвечая на определенные стимулы, но в отличие от моноцитов относятся к короткоживущим клеткам, которые, поглотив чужеродный материал, разрушают его и затем погибают. На поверхности нейтрофилов присутствуют антигены главного комплекса тканевой совместимости MHC I класса, рецепторы для связывания антител, комплемента и хемотаксических пептидов.
Эозинофилы, относящиеся также к группе зернистых лейкоцитов, обладают цитотоксическим действием на многие паразитические формы, в том числе на крупных паразитических червей типа гельминтов, которые не могут быть фагоцитированы.
Лимфоциты представлены двумя большими популяциями – В-клетками и Т-клетками.
В-клетки. Каждая В-клетка генетически запрограммирована на синтез поверхностного рецептора, специфичного к одному определенному антигену. Встретив и распознав этот антиген, В-клетки размножаются и дифференцируются (созревают) в плазматические клетки, которые образуют и выделяют в растворимой форме большие количества таких рецепторных молекул, называемых антителами. Благодаря своей идентичности исходным рецепторным молекулам антитела взаимодействуют с тем антигеном, который первоначально активировал В-клетки.
Т-клетки. Существует два типа Т-клеток –хелперные Т-клетки (Тх, CD4+) и цитотоксические Т-клетки (Тц, CD8+).
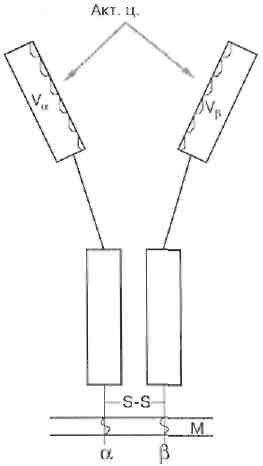
Т-клетки распознают антиген только тогда, когда он презентирован на поверхности других клеток в комплексе с молекулами МНС. В распознавании антигена участвует специфичный по отношению к нему Т-клеточный рецептор (ТкР), структурно и функционально сходный с той поверхностной молекулой антитела, которая у В-клеток служит антигенсвязывающим рецептором. Для распознавания соответствующего МНС-антигена Т-клетки несут на своей поверхности маркеры CD4+ (Тх) или CD8+ (Тц), специфичные к молекулам МНС-II или МНС-I соответственно.
Хелперные Т-лимфоциты (Тх, CD4+) или лимфоциты-помощники регулируют и координируют иммунный ответ путем контактных межклеточных взаимодействий и выделения в межклеточную среду молекул цитокинов. Цитокины помогают В-клеткам размножаться, созревать и образовывать антитела или взаимодействуют с фагоцитами, способствуя разрушению локализованных в них микроорганизмов.
Цитотоксические Т-лимфоциты (Тц, CD8+) осуществляют разрушение собственных клеток организма, зараженных вирусами или иными внутриклеточно размножающимися патогенными микробами, обеспечивают трансплантационный иммунитет.
Большие зернистые (гранулярные) лимфоциты (БГЛ) или нормальные киллеры (НК-клетки). НК-клетки являются цитотоксическими клетками. Они разрушают, главным образом, опухолевые и зараженные вирусом клетки. НК-клетки распознают и уничтожают также некоторые клетки-мишени (или патогенные микроорганизмы), если поверхность последних покрыта связавшимися с ней специфическими антителами.
|
|
Рис. 9. Принципиальная схема строения антител
и Т-клеточных рецепторов (ТкР).
Вспомогательные клетки регулируют воспаление. Их роль заключается в привлечении лейкоцитов и растворимых медиаторов иммунитета в очаг инфекции. К числу таких клеток относятся базофильные и тучные клетки. Эти клетки заполнены гранулами, содержащими медиаторы воспаления. Выделение медиаторов происходит при активации базофилов и тучных клеток. Эти клетки могут также синтезировать и выделять ряд медиаторов, регулирующих иммунный ответ. Тучные клетки располагаются вблизи кровеносных сосудов и воздействуют посредством некоторых своих медиаторов на клетки сосудистой стенки. Базофилы сходны по функциям с тучными клетками, но в отличие от них циркулируют в крови.
Цитокины – растворимые медиаторы иммунитета
В развитии иммунного ответа участвует целый ряд молекул-посредников, называемых цитокинами (от греч. cyto – клетка, kines – движение). Цитокины представляют собой эндогенные пептидыне и белковые молекулы, регулирующие рост, дифференцировку и миграцию клеток, участвующие в межклеточной передаче сигналов в ходе иммунного ответа, влияющие на процесс восстановления тканей. Они обладают чрезвычайно высокой активностью. Выделяют несколько групп цитокинов:
Интерфероны (ИФ) – белки, препятствующие размножению вирусов. Одну группу интерферонов (ИФ, ИФ) синтезируют клетки, инфицированные вирусами. Другой тип интерферона (ИФ) выделяют некоторые активированные Т-клетки. Интерфероны сообщают противовирусную устойчивость незараженным клеткам. Они образуются на ранних стадиях инфекции и создают первую линию защиты против большинства вирусов.
Интерлейкины (ИЛ) – большая группа цитокинов, ответственная за межклеточные взаимодействия между лейкоцитами. Описано более 30 интерлейкинов. Интерлейкины обладают разными функциями, но большинство из них стимулирует другие клетки для деления и дифференцировки. Каждый ИЛ действует на определенную группу клеток, несущих специфичные для данного ИЛ рецепторы.
Колониестимулирующие факторы (КСФ) участвуют в регуляции деления и дифференцировки стволовых клеток костного мозга и клеток – предшественников лейкоцитов крови. Балансом различных КСФ в определенной мере обусловлено соотношение между различными типами образующихся в костном мозге лейкоцитов. Некоторые КСФ стимулируют дальнейшую дифференцировку клеток и вне костного мозга.
Факторы некроза опухолей (ФНО и ФНО) и трансформирующий фактор роста (ТФР) выполняют разнообразные функции, но особенно важны как медиаторы воспаления и цитотоксических реакций.
Антитела
Антитела – белки, способные к специфическому связыванию с антигенными детерминантами (эпитопами) антигенов. Антитела относятся к белкам семейства -глобулинов (иммуноглобулинов).
Строение и функции иммуноглобулинов
Антитела (иммуноглобулины, Ig) по своей химической структуре относятся к гликопротеинам, помимо собственно полипептидной цепи содержат олигосахаридные фрагменты.
Некоторые молекулы иммуноглобулинов находятся на поверхности В-лимфоцитов и функционируют как антигенспецифичные рецепторы. Другие антитела присутствуют как свободные молекулы в плазме крови и тканевой жидкости.
Синтез антител осуществляют В-клетки после контакта с антигеном и созревания В-клеток в плазматические клетки.
Определение структуры иммуноглобулинов – важнейшее достижение иммунохимии. В 1958 г. профессор Оксфордского университета Родней Портер расшифровал структуру Ig, а в 1959 г. Джеральд Эдельман установил их аминокислотную последовательность. За эти исследования Р. Портеру и Д. Эдельману в 1972 году присуждена Нобелевская премия.
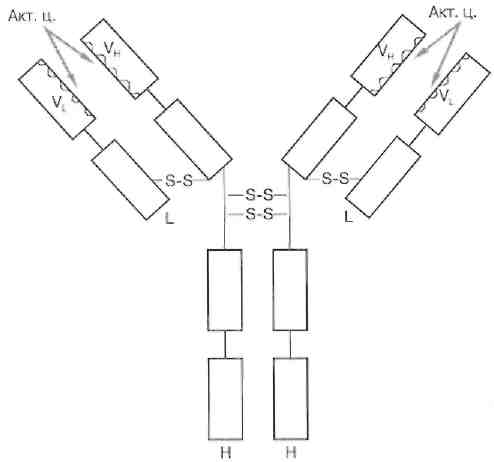
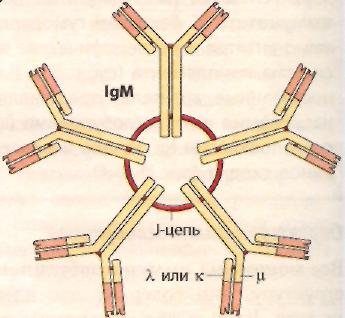
У большинства высших млекопитающих и человека обнаружено пять классов иммуноглобулинов – IgG, IgA, IgM, IgD и IgE, которые различаются по размерам молекул, заряду, аминокислотному составу и содержанию углеводов. Несмотря на видимое разнообразие, все мономеры имммуноглобулинов разных классов имеют универсальное строение и состоят из двух одинаковых тяжелых (Н-цепей, от англ. heavy, мол. массой 50 – 77 кДа) цепей и двух одинаковых легких (L-цепей, от англ. light, мол. массой 25 кДа) цепей, удерживаемых вместе дисульфидными (-S-S-) связями (рис. 10). Между N-концами Н- и L-цепей в углублении расположен активный центр – центр связывания антитела с антигеном. Активный центр называется «паратоп». Число активных центров в молекуле иммуноглобулина определяет валентность антитела.
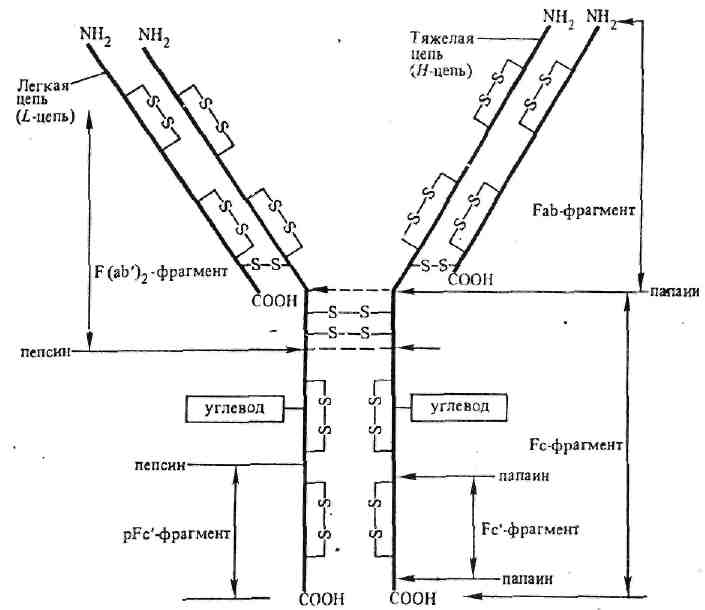
Рис. 10. Строение основного структурного фрагмента
молекул иммуноглобулинов
Под действием фермента папаина иммуноглобулин может быть расщеплен на три фрагмента: два из них одинаковые, обладают способностью связывать антиген и названы Fab-фрагменты (фрагмент антигенсвязывающий), третий фрагмент определяет физиологическую активность (Fc-фрагмент). Фермент пепсин расщепляет молекулу антитела по-другому. При этом образуются двухвалентный F(аb')2-фрагмент и несколько осколков Fс-фрагмента, из которых наиболее крупный назван рFс'-фрагментом.
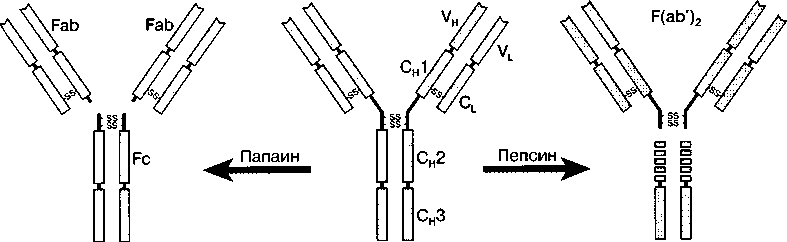
Рис. 11. Схема расщепления Ig
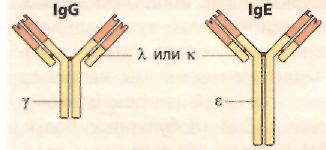
Как у Н-, так и у L-цепей выделяют две области: постоянную (константную) С-область и вариабельную (V-область). По различиям первичной структуры С-областей легкие цепи делятся на два типа: λ и χ, тяжелые цепи на 5 типов: γ, μ, α, ε и δ. Тип Н-цепи определяет принадлежность иммуноглобулина к определенному классу (G, M, A, E и D соответственно).
Н- и L-цепи образуют в молекуле иммуноглобулинов ряд глобулярных структур – доменов, которые удерживаются за счет дисульфидных связей. Активные центры образованы первыми доменами V-областей тяжелой и легкой цепи.
Активный центр имеет характерную пространственную конфигурацию, определенное распределение положительных и отрицательных зарядов, гидрофобных и гидрофильных остатков аминокислот на своей поверхности. От этого зависит его способность специфически связываться с конкретным эпитопом, имеющим комплементарную структуру. Взаимодействие эпитопа с активным центром идет по принципу «ключ – замок». Эпитоп удерживается в активном центре за счет всех типов невалентных связей (водородные связи, гидрофобные и электростатические взаимодействия, ван-дер-ваальсовы силы взаимного притяжения). Суммарная энергия связей определяется понятием «афинность». Чем больше суммарная энергия связей, т.е. афинность, тем прочнее удерживается эпитоп в активном центре.
Классы иммуноглобулинов
Иммуноглобулины класса G (IgG) составляют основную массу иммуноглобулинов сыворотки крови, на их долю приходится 70 – 80 % всех сывороточных иммуноглобулинов. IgG – мономер, имеет два антигенсвязывающих центра, т.е может связать две молекулы антигена. В отличие от других классов иммуноглобулинов эти антитела легко проходят через плаценту и обеспечивают естественный пассивный иммунитет у новорожденного.
Иммуноглобулины класса М (IgМ) – наиболее крупные молекулы из всех иммуноглобулинов. IgМ – пентамер, имеющий 10 антигенсвязывающих участков. На долю IgМ приходится 5 – 10 % всех сывороточных иммуноглобулинов. Антитела класса IgМ в своей первоначальной мембраносвязанной форме служат рецепторами В-клеток, при первичном иммунном ответе они первыми появляются в крови (ранние антитела). Действие их направлено прежде всего против микроорганизмов.
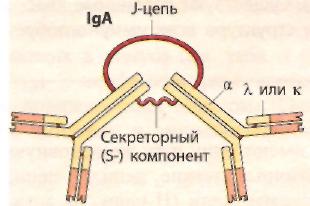
Иммуноглобулины класса А (IgА) существуют в сывороточной и секреторной формах. На долю сывороточного IgA приходится около 10 – 15 % всех сывороточных иммуноглобулинов. Секреторный иммуноглобулин в высокой концентрации (около 60 % всех IgA) присутствует в кишечном тракте и секретах (слюне, содержимом кишечника, секретах бронхов и носовой полости, грудном молоке) и препятствует адгезии микробов на эпителиальных клетках, а также респространению инфекции в пределах слизистых оболочек. Секреторный IgA представлен главным образом димерной формой.
Иммуноглобулины класса Е (IgЕ) составляют около 0,002 % всех циркулирующих иммуноглобулинов. IgE синтезируются В-лимфоцитами и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и желудочно-кишечного тракта. Антитела класса IgE связываются с базофилами и тучными клетками за счет высокоаффиных FC-фрагментов (рецепторов) и участвуют в развитии аллергической реакции. Наибольшее количество IgE образуется при паразитарных инфекциях кишечника, легких и кожи, выполняя функцию защитного фактора.
Иммуноглобулины класса D (IgD) содержатся в сыворотке крови и составляют около 0,2 % общего количества циркулирующих иммуноглобулинов. В мембраносвязанной форме IgD служат рецепторами В-клеток, при этом их функции пока не вполне ясны.
Ig G IgE |
IgA |
IgM |
|
|
|
|
|
150 кДа |
196 кДа |
360-720 кДа |
935 кДа |
Рис. 12. Схематичное изображение строения молекул Ig
Поликлональные и моноклональные антитела
Антитела вырабатываются В-лимфоцитами, на поверхности которых уже имеются рецепторы, специфически связывающие антиген. В результате межклеточной кооперации происходит активация В-лимфоцитов и их созревание в плазматические клетки, которые синтезируют и выделяют в кровь антитела, аналогичные по специфичности рецепторам на поверхности В-лимфоцитов. Если антиген поливалентен (например, белок), то в сыворотке крови образуются антитела, обладающие разной специфичностью связывания антигена. Такие антитела – поликлональные. Поликлональные антитела гетерогенны как по структуре антигенсвязывающего центра, так и по физико-химическим свойствам. Антитела с одной специфичностью связывания – моноклональные.
Для очистки и стандартизации поликлональных антител используется аффинная хроматография. В основе методов хроматографии лежит специфическое взаимодействие антител с антигеном, и последующее высвобождение антител из комплекса обработкой кислым или щелочным элюентом. Сыворотка крови от иммунизированного животного пропускается через колонку с твердофазным иммуносорбентом, представляющим собой антиген, ковалентно пришитый к инертной основе (например, частицам полисахарида декстрана). Специфические антитела связываются антигеном, все другие белки, и в том числе антитела с низким сродством к антигену, проваливаются через колонку. На следующем этапе специфически связанные антитела вымывают с поверхности сорбента буферным раствором, разрушающим связь антигена с антителом. В качестве буферных растворов используют ацетатный буфер (рН 3.0), диэтиламин (рН 11.5) и др.
Этим методом можно получить и очищенные препараты антигенов, если использовать иммуносорбент, содержащий антиген.
МЕХАНИЗМ ИММУННОГО ОТВЕТА
Иммунный ответ – это реакция иммунной системы организма, индуцированная антигеном и направленная на его разрушение и удаление из организма. Иммунный ответ зависит от свойств антигена, иммунологической реактивности организма и условий среды. В зависимости от того, какие механизмы лежат в основе реализации иммунного ответа, выделяют неспецифический (врожденный) и специфический (приобретенный) иммунный ответ. Факторы неспецифического и специфического иммунного ответа:

Неспецифический иммунный ответ
Неспецифический иммунный ответ (врожденный иммунитет) – это первый этап борьбы с инфекцией, определяет общую сопротивляемость организма. Он запускается сразу после попадания микроба в организм человека, его характер практически одинаков для всех типов. Механизм врожденного иммунитета включает действие физических, гуморальных и клеточных факторов. В ходе неспецифического иммунного ответа происходит первичное разрушение антигена и формирование очага воспаления. Воспалительная реакция – это универсальный защитный процесс, направленный на предотвращение распространения микроба.
Белки системы комплемента
Комплемент – система белков сыворотки крови, принимающая участие в регуляции воспалительных процессов, активации фагоцитоза и разрушающем (литическом) действии на клеточные мембраны.
В систему комплемента входит около двух десятков белков, их содержание составляет 5 % от всех белков плазмы крови, т. е. концентрация в крови 3 – 4 г/л. Белки комплемента обозначают символом «С» и цифрой, соответствующей хронологии их открытия, продукты расщепления компонентов комплемента – маленькой латинской буквой (С3b, C5a и др.). В наибольшем количестве в крови содержится компонент С3, который выполняет центральную роль в активации комплемента.
Для этой системы характерен быстрый, многократно усиленный ответ на антигеннный сигнал за счет каскадного процесса. При этом продукт одной реакции является катализатором последующей.
В отсутствие антигена компоненты комплемента находятся в неактивном состоянии. Существует два пути активации комплемента: без участия антител – альтернативный, и с участием антител – классический. Активацию комплемента по альтернативному пути вызывают компоненты микробных клеток, по классическому – комплексы антиген – антитело. Общим для обоих путей является образование фермента С3-конвертазы, который расщепляет компонент С3 на фрагменты С3а и С3b. Меньший фрагмент С3а принимает участие в развитии воспалительного процесса и хемотаксиса. Больший фрагмент С3b, связываясь с С3-конвертазой, образует С5-ковертазу – фермент, катализирующий расщепление С5 на фрагменты С5а и С5b. Высвобождающийся фрагмент С5b остается фиксированным на мембране и последовательно присоединяет С6, С7, С8 и С9, в результате чего образуется мембраноатакующий комплекс (МАК), который лизирует клетку-мишень за счет формирования трансмембранного канала. По этому каналу внутрь клетки поступают ионы Na+ и вода, клетка набухает и лопается, т. е. лизирует. Среди других эффектов системы комплемента необходимо отметить следующие:
развитие воспалительной реакции и хемотаксис. Компоненты комплемента С3а и С5а могут привлекать к месту воспаления иммунокомпетентные клетки, например фагоциты, которые атакуют бактерии и пожирают их.
Опсонизация (облегчение распознавания) микроорганизмов. Фрагменты С3b связываются с поверхностью бактерий, в результате чего создается метка для узнавания фагоцитами, имеющими рецепторы к этому компоненту комплемента.

Рис. 13. Активация белков системы комплемента
Активность системы комплемента контролируется ингибиторами плазмы крови, блокирующими избыточную реакцию.
Фагоцитоз («поедание» клетками) – первая реакция иммунной системы на внедрение чужеродного антигена. Механизм фагоцитоза включает 8 последовательных стадий (рис. 14):
Хемотаксис – направленное перемещение фагоцитирующих клеток к объекту по градиенту концентрации хемотаксических соединений.
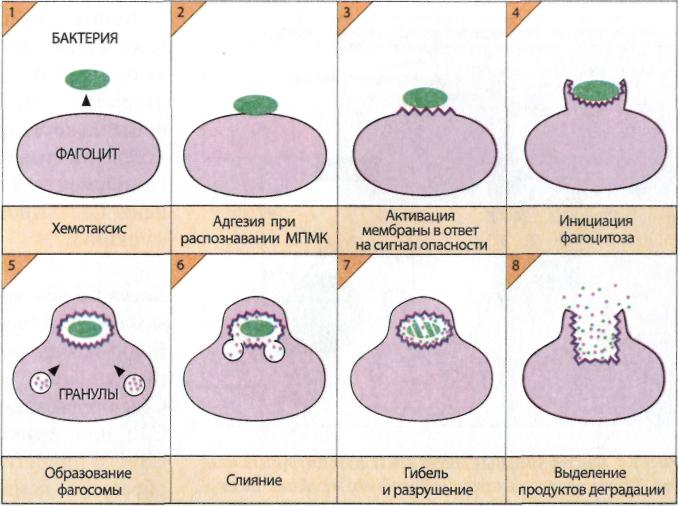
Рис. 14. Стадии фагоцитоза
Адгезия - распознавание и прикрепление чужеродного объекта к поверхности фагоцита. Процесс адгезии усиливают опсонины (комплемент С3b, антитела), обволакивающие объекты фагоцитоза. В этом случае связывание происходит с участием фагоцитарных рецепторов для С3b комлемента и /или Fc антитела.
Активация мембраны.
4. Инициация фагоцитоза - в результате активации мембраны фагоцит окружает чужеродный объект выростами плазматической мембраны (псевдоподиями).
5. Образование фагосомы – объект фагоцитоза, заключенный в оболочку из плазматической мембраны, - фагосома, поглощается фагоцитом. В фагосоме поглощенная чужеродная клетка погибает. Для осуществления киллинга макрофаги секретируют в фагосому реакционноспособные производные кислорода, тогда как нейтрофилы вызывают гибель поглощенной клетки, хелатируя железо и лишая тем самым ее необходимого элемента питания.
6. Слияние. Для переваривания поглощенного и убитого материала происходит слияние фагосомы с органеллами клетки, лизосомами, содержащими набор гидролитических ферментов, и образование фаголизосомы.
7. Гибель и разрушение. Активация гидролитических ферментов приводит к перевариванию поглощенного объекта.
Выделение продуктов деградации. Продукты расщепления антигена, представляющие собой антигенные детерминанты, выносятся на поверхность фагоцита в комплексе с белками МНС. Это имеет важное значение для индукции специфического иммунного ответа.
Таким образом, система врожденного иммунитета располагает достаточно эффективными механизмами для распознавания чужеродных антигенов, их обезвреживания и удаления из организма. К недостаткам врожденного иммунитета можно отнести однообразие, неспецифичность и необучаемость (отсутствие памяти) этой системы.
Специфический иммунный ответ
Специфический иммунный ответ (приобретенный иммунитет) – это второй этап защитной реакции организма. Его отличительной особенностью является распознавание чужеродного антигена и выработка факторов защиты, направленных специально против него. В реализации специфического иммунного ответа можно выделить три этапа:
– распознавание антигена;
– активацию лимфоцитов;
– эффекторное действие.
В основе специфического иммунного ответа лежит накопление антител и специализированных Т-клеток, которые связывают антиген, нейтрализуют его и в конечном итоге защищают организм от чужеродных антигенов.
Специфический иммунный ответ может быть двух видов: гуморальный и клеточный. Упрощенная схема иммунного ответа представлена на рис. 14.
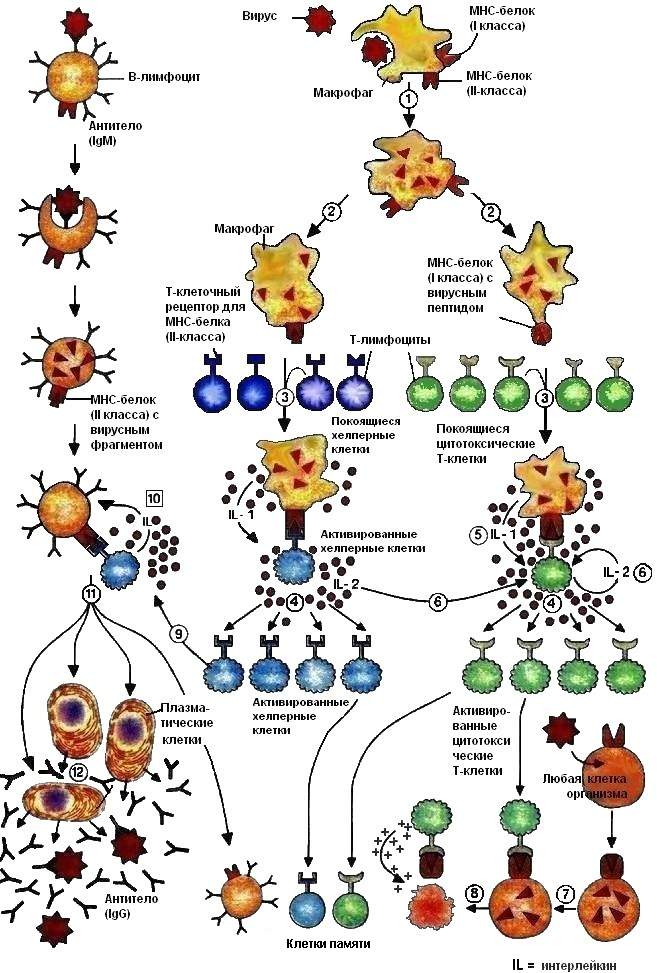
Рис. 14. Схема иммунного ответа
Гуморальный иммунитет. Эффекторные функции гуморального иммунитета обусловлены действием антител.
В-лимфоциты несут на своей поверхности мембраносвязанные антитела класса IgM, выполняющие функции антигенраспознающих рецепторов. Клетки каждого клона В-лимфоцитов несут рецепторы, специфичные к определенному антигену. Чтобы обеспечить связывание многочисленных антигенов, с которыми в течение жизни может столкнуться организм, изначально в нем должно существовать практически бесконечное разнообразие рецепторов разной специфичности. Исходное число клеток каждой специфичности до встречи с антигеном невелико. Когда антиген проникает в организм, он связывается с В-клетками, несущими рецепторы, специфичные к этому антигену, что является сигналом к началу интенсивного размножения (пролиферации) В-лимфоцитов. После определенного числа делений В-клетки дифференцируются в плазматические клетки, которые образуют и выделяют в растворимом виде в кровь антитела, специфические к данному антигену.
Продукция антител может протекать без участия Т-клеток, если антигенами являются молекулы биополимеров с повторяющимися эпитопами, например белковые и липополисахаридные антигены бактерий, вирусов. Структура этих антигенов позволяет им перекрестно связывать В-клеточные рецепторы, что приводит к дальнейшей активации, пролиферации и дифференцировке В-лимфоцитов. Развивающийся при этом иммунный ответ идет по IgM-типу. Переключение на синтез иммуноглобулинов других типов в отсутствие кооперации с Т-клетками либо невозможно, либо длится непродолжительное время.
Если антиген имеет мономерное или олигомерное строение, он не способен перекрестно связывать В-клеточные рецепторы, поэтому для активации В-лимфоцитов необходим дополнительный сигнал от Т-клеток. Т-лимфоциты распознают антиген только в комплексе с белками МНС. Поэтому после связывания антигена с рецептором происходит его фагоцитоз В-лимфоцитом и вынос антигенной детерминанты в комплексе с белками МНС-II на поверхность клетки. Связывание Тх, имеющего на своей поверхности рецептор, специфичный по отношению к данному антигену, стимулирует выработку в Тх-клетках медиаторов иммунного ответа – интерлейкинов. IL-2, воздействуя на В-лимфоцит, активируют процесс размножения и преобразования в плазматическую клетку.
Эффекторные функции антител. Антитела могут взаимодействовать с бактериальными токсинами, находящимися в крови. Токсины - это продукты жизнедеятельности бактерий, обладающие токсичностью по отношению к организму человека, например, столбнячный, гангренозный, дифтерийный. Связывание токсинов с антителами приводит к подавлению их токсичности, но не приостанавливает размножение бактерий.
Антитела могут взаимодействовать с вирусами, находящимися в крови, блокируя их антигены. Это препятствует связыванию вируса с рецепторами клетки и проникновению в нее.
Комплекс антиген-антитело (малый иммунный комплекс) активирует систему комплемента.
Клеточный иммунитет включает формирование клонов Т-лимфоцитов, способных разрушать клетки собственного организма, зараженные вирусом (противовирусный иммунитет), раковые клетки (противоопухолевый иммунитет), отторгать пересаженные органы и ткани (трансплантационный иммунитет), а также участвует в ликвидации некоторых видов бактериальных инфекций.
В первой фазе иммунного ответа, проникший в организм вирус захватывается антигенпрезентирующими клетками (АПК), частично расщепляется и его антигенная детерминанта выносится на поверхность клетки в комплексе с белками МНС-II для распознавания Тх-лимфоцитами или с молекулами МНС-I, распознаваемом Тк-лимфоцитами. Среди огромного количества Тх-клеток только немногие обладают подходящим Т-клеточным рецептором и могут специфически распознать линейный Т-эпитоп в комплексе с молекулой МНС II. Процесс распознавания активирует АПК, которые начинают секретировать сигнальные белки интерлейкины (IL-1), стимулирующие пролиферацию этих Тх-клеток. Активированные Тх-клетки продуцируют IL-2, стимулирующий их собственное деление.
Во второй фазе Тх-иммунного ответа активированные Тх-клетки распознают на поверхности В-клеток тот же комплекс: молекула МНС класса II – антигенный пептид, который присутствует на АПК.
Цитотоксические Т-лимфоциты (Тк) распознают процессированный вирусный антиген, представленный в комплексе с МНС-молекулами I класса. Клонированные и активированные Тц-лимфоциты способны узнавать и связывать инфицированные клетки организма, на поверхности которых есть вирусные фрагменты, связанные с МНС-молекулами I класса. Тц-клетки секретируют белок перфорин, который образует каналы в наружной мембране инфицированных клеток, что приводит к ее лизису.
После устранения инфекции сохраняется некоторая часть вновь cинтезированных В-, Тх- и Тц-лимфоцитов, способных снова активироваться, если вирус повторно попадет в организм.. Их называют клетки памяти, они являются наиболее долгоживущими клетками и обеспечивают долгосрочный иммунитет.
Таким образом, основными характеристиками специфического иммунитета являются специфичность и память.
Взаимосвязь неспецифического и специфического иммунитета
Неспецифический и специфический иммунитет, включают совершенно разные механизмы, но в реальном иммунном ответе действуют как единое целое, взаимно дополняя друг друга.
Известно, что антитела придают иммунитету специфичность. Вместе с тем, даже связавшись с антигеном, антитела не обладают способностью уничтожать его или удалять из организма. Антитела выступают как молекулы-наводчики, которые подключают механизмы неспецифического (врожденного) иммунитета: фагоцитоз, комплемент и т. д. Это становится возможным благодаря уникальному строению молекулы антитела, которая своим антигенсвязывающим участком (Fab-фрагментом) может связать антиген, а Fc-фрагментом активировать комплемент или связаться с рецепторами для Fc на фагоцитах.
Специфические Т-лимфоциты распознают антиген, если он представлен на поверхности клетки-мишени в комплексе с молекулами МНС. Т-хелперы сами по себе безвредны для внедрившихся микробов. Вместе с тем, распознавая на поверхности макрофага и других антигенпрезентирующих клеток фрагменты антигена в комплексе с МНС-молекулами, они активируются и выделяют биологически активные вещества, которые вызывают воспаление и фагоцитоз. Фрагмент антигена в комплексе с МНС-молекулами активирует секрецию Тх-лимфоцитами цитокинов, стимулирующих синтез В-лимфоцитами антител, и последующее подключение воспаления и фагоцитоза к иммунному ответу через систему комплемента.
Таким образом, первой линией защиты от инфекции является врожденный иммунитет, действие которого проявляется сразу при внедрении микроба в организм, а несколько позже образуются антитела и специфические лимфоциты, которые обладают механизмами специфического распознавания антигена и на заключительной стадии иммунного ответа снова подключают неспецифические механизмы врожденного иммунитета.
НАРУШЕНИЯ ФУНКЦИЙ ИММУННОЙ СИСТЕМЫ
Реакции гиперчувствительности (аллергии)
Аллергия (от греч. allos – иной, ergon – я действую) – это состояние повышенной чувствительности (сенсибилизация) к веществам с антигенными свойствами или даже без них. В настоящее время 30 – 40% населения развитых стран подвержено аллергии.
Термин «аллергия» введен в 1905 г. К.фон Пирке для обозначения особого чрезмерного реагирования организма на контакт с антигеном. В 1902 г. Рише и Портье (Институт Пастера) в опыте на собаках обнаружили явление анафилактического шока. Это было началом аллергологии.
Антигены, вызывающие аллергическую реакцию, принято называть аллергенами. Виды аллергенов:
бытовые (домашняя книжная пыль – продукт жизнедеятельности домашнего клеща);
эпиаллергены (волосы, шерсть, кожа, чешуя);
простые химические вещества;
поллинозы (пыльца растений);
лекарственные вещества (антибиотики, сульфаниламидные препараты);
пищевые аллергены;
инфекционные аллергены (антигены микроорганизмов);
аутоаллергены (первичные – антигены клеток тех органов, к которым не была сформирована врожденная иммунологическая толерантность (головной мозг, щитовидная и половые железы, ткани глаза; вторичные – макромолекулы клеток с измененной структурой в результате ожога, лучевой болезни, отморожения и др.)).
У 95% людей возникает аллергия к какому-то одному аллергену, т. е они моноаллергенны. Дети, как правило, полиаллергенны.
Виды гиперчувствительности. Реакции гиперчувствительности классифицируются на гиперчувствительность немедленного типа (ГНТ) и замедленного типа (ГЗТ) в зависимости от времени появления признаков после повторной встречи сенсибилизированного организма с аллергеном (табл. 1).
Таблица 1
Характеристика реакций гиперчувствительности
Признак |
ГНТ, реакции В-типа |
ГЗТ, реакции Т-типа |
Время после повторного введения аллергена |
Несколько минут |
5 – 7ч, максимум 12 – 24ч |
Аллергены |
Белки, полисахариды |
Пересаженные ткани, химические вещества, туберкулин, аутоаллергены |
Антитела в крови |
Присутствуют |
Отсутствуют |
Перенос другому организму |
Сывороткой и лимфоцитами |
Только лимфоцитами |
Десенсибилизация |
Эффективна |
Неэффективна |
Клинические проявления |
Анафилактический шок, атопии (необычные): мигрень, поллинозы, крапивница, бронхиальная астма |
реакции туберкулинового типа, аутоиммунные реакции, отторжение трансплантанта |
ГНТ, как и ГЗТ, протекают в 3 стадии:
1) иммунологическая,
2) патохимическая,
3) патофизиологическая.
Суть иммунологической стадии составляет наработка антител и сенсибилизированных лимфоцитов. В ходе иммунологической стадии происходит накопление аллергена, который фиксируется на поверхности тучных клеток соединительной ткани (контейнеры медиаторов). Антитела или сенсибилизрованные лимфоциты накапливаются на 12-й – 14-й день.
Патохимическая стадия характеризуется выбросом в кровь веществ – медиаторов аллергических реакций. При повторном введении аллергена он соединяется с антителами на поверхности тучных клеток, которые тем самым раздражаются, возбуждаются и выделяют в кровь медиаторы. Характеристики основных медиаторов аллергических реакций приведены в табл. 2.
Таблица 2
Основные медиаторы аллергических реакций
Медиатор |
Химическая природа |
Биологический эффект |
Гистамин |
Амин, производное гистидина |
Сужение коронарных артерий и бронхов, повышение проницаемости капилляров, подавление активности Т-лимфоцитов, ограничение дальнейшей активации тучных клеток |
Серотонин |
Амин, производное триптофана |
Активация процессов свертывания крови, сужение сосудов головного мозга |
Гепарин |
Гетерополисахарид |
Снижение свертываемости крови |
Медленно реагирующая субстанция анафилаксии (МРСА) |
Комплекс лейкотриенов – производных арахидоновой кислоты |
Тромбоз, расширение сосудов, стимуляция образования гистамина и брадикинина |
Брадикинин |
Пептид |
Расширение артерий, снижение артериального давления, стимуляция освобождения гистамина |
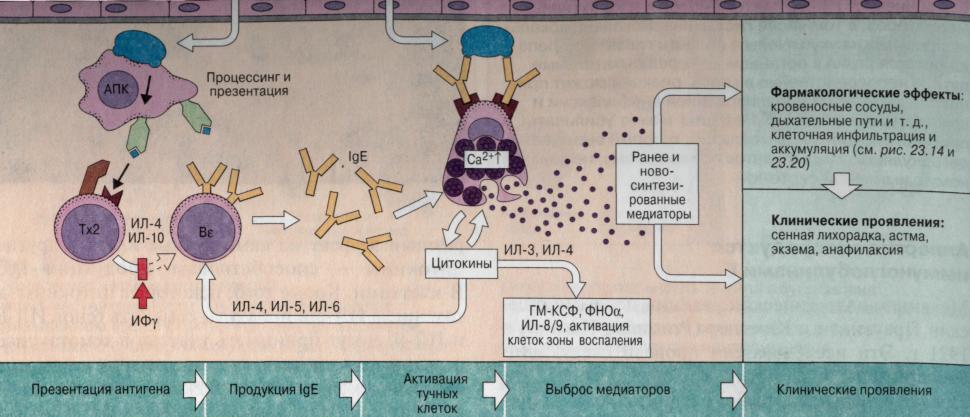
Рис. 15. Развитие аллергической реакции
Содержание патофизиологической стадии аллергии составляют изменения в деятельности различных органов под влиянием медиаторов аллергии. Медиатор расширяет мелкие сосуды, увеличивает их проницаемость, вызывает спазм гладкой мускулатуры, повышает секрецию слизистых желез дыхательной системы, пищеварительного тракта. Наблюдается спазм бронхов и кишечника, падение артериального давления, высыпание красных пятен на коже. Место развития процесса определяет симптомы. Если это подкожная жировая клетчатка, то зуда не наблюдается, если поверхностные слои кожи (крапивница), то появляется зуд, так как в коже есть болевые рецепторы.
Более сложную классификацию аллергических реакций предложили Кумбс и Джелл (Coombs, Gell). Они выделили четыре типа гиперчувствительности (типы I, II, III и IV). Данная классификация учитывает три критерия: место нахождения аллергена, место нахождения антитела, участие в реакции комплемента. Реакции первых трех типов опосредуются антителами, реакции четвертого – преимущественно Т-клетками и макрофагами.
Реакции I типа (реагиновые). При контакте с безвредными в норме антигенами (аллергенами) окружающей среды, например с цветочной пыльцой, перхотью животных и клещами домашней пыли, вырабатывается IgE, называемые реагинами. IgE связываются специфическими рецепторами тучных клеток соединительной ткани. При взаимодействии аллергена с IgE, связанным с тучными клетками, последние выделяют медиаторы, которые вызывают клинические симптомы аллергии. Типичные примеры аллергических реакций – сенная лихорадка, астма, атопическая экзема, лекарственная аллергия и анафилаксия. Для их лечения применяют антигистаминные препараты, бронхорасширяющие препараты, адреналин, кортикостероиды и специфические иммунотерапевтические средства.
Загрязнители внешней среды повышают уровень антигенспецифичных IgE. Такие загрязнители окружающей среды, как диоксид серы (сернистый газ), оксиды азота, присутствующие в воздухе частицы дизельных выхлопов (ЧДВ) и золы, могут повышать проницаемость слизистых оболочек, способствуя проникновению в организм аллергенов и возникновению IgE-реакций. ЧДВ способны играть роль мощного адъюванта, усиливающего продукцию IgE. Диаметр этих частиц меньше 1 мкм; они долго сохраняются в атмосфере загрязненных городов и воздействуют на дыхательные пути. Концентрация ЧДВ в городском воздухе составляет в среднем примерно 1 мкг/м3, а на главных магистралях может достигать 30 мкг/м3, возрастая в периоды особенно напряженного движения до 500 мкг/м3. При вдыхании ЧДВ вместе с антигеном содержание антигенспецифичного IgE резко возрастает. Такой адъювантный эффект проявляется и при низкой концентрации антигена, сопоставимой с той, которая присутствует в окружающей среде.
Частота заболеваний аллергическим ринитом и астмой в течение последних 30 лет нарастает параллельно с увеличением в атмосферном воздухе загрязнений. Таким образом, загрязнители внешней среды, способствующие IgE-ответу, могут вносить свой вклад в рост распространенности аллергических заболеваний.
Если с IgE связаны столь многочисленные отрицательные эффекты, возникает вопрос, почему вообще в эволюции появились антитела этого класса? В процессе эволюции антитела класса IgE появились, возможно, для защиты организма от гельминтов (поскольку примерно треть всего населения земного шара заражена гельминтами). Продукцию IgE в ответ на аллергены с последующим развитием аллергической реакции можно рассматривать как нежелательный побочный эффект.
Реакции II типа (антителозависимые цитотоксические) возникают, когда антитела обычно класса IgG связываются на поверхности клеток с собственным или чужеродным антигеном, вызывая в результате фагоцитоз, активацию киллерных клеток или комплемент-опосредованный лизис. Классическим примером данных реакций служат аутоиммунные гемолитические анемии, а также гемолиз при переливании несовместимой крови.
Реакции III типа (иммунокомплексные) развиваются при образовании большого количества иммунных комплексов или при нарушении их элиминации ретикулоэндотелиальной системой. При этом происходит активация комплемента, и в месте отложения комплексов накапливаются полиморфноядерные клетки, вызывая локальное повреждение тканей и воспаление.
Реакции IV типа (гиперчувствительность замедленного типа или ГЗТ) наиболее резко проявляется в тех случаях, когда макрофаги поглощают чужеродный материал (например, возбудителей туберкулеза), но не способны его элиминировать. При этом происходит стимуляция синтеза Т-клетками цитокинов, вызывающих различные воспалительные реакции. Другими проявлениями реакций ГЗТ являются отторжение трансплантата и аллергический контактный дерматит.
Аутоиммунные заболевания
Клетки иммунной системы помимо внедрившихся чужеродных антигенов сталкиваются и с компонентами собственного организма. Иммунные реакции не должны быть направлены на собственные молекулы. Иммунологическая толерантность, т. е. отсутствие иммунной реакции на собственные антигены, приобретается в период внутриутробного развития или сразу после рождения, когда иммунная система проходит специальную подготовку, чтобы не реагировать на собственные молекулы. В процессе дифференцировки Т-лимфоцитов в тимусе уничтожаются те из них, которые не обладают иммунологической толерантностью. Часть таких клеток может уцелеть. Каждый из нас обязательно имеет в крови некоторое количество аутоиммунных клеток, но не во всех случаях это приводит к развитию аутоиммунных заболеваний. Не до конца изученная система контроля и противодействия в норме не дает аутоиммунной клетке делать свое «черное дело».
Известно много случаев сбоя в работе иммунной системы, когда она теряет способность отличать «свое от чужого», что приводит к возникновению аутоиммунных заболеваний. Сущность этого явления состоит в том, что иммунная система начинает вырабатывать антитела к тканям собственного организма в повышенном количестве. Заболевания, связанные с поражением аутоантителами тканей, могут быть вызваны:
антигенами (1.),
антителами (2.),
патологией органов иммунной системы (3.).
Ткани собственного организма либо без изменения своего антигенного состава, либо после его изменения под действием внешних факторов воспринимаются иммунной системой как чужеродные.
Во-первых, такие ткани закладываются позднее иммунной системы, поэтому к ним сохраняются иммунокомпетентные клетки. Во-вторых, особенности их кровоснабжения таковы, что продукты их деградации не попадают в кровяное русло и в норме не достигают иммунокомпетентных клеток. При травмах, операциях эти первичные антигены попадают в кровь, стимулируют выработку антител, которые, проникая через поврежденные барьеры, вновь действуют на орган.
У этого вида патологии есть несколько вариантов:
а) чужеродный антиген имеет сходные эпитопы с антигенами тканей собственного организма, в связи с чем антитела, образовавшиеся на чужой антиген, «ошибаются» и начинают повреждать собственные ткани. Это явление получило название «молекулярной мимикрии». Например, антитела, вырабатываемые организмом против бактерии стрептококка, могут взаимодействовать с нормальными антигенами сердечной мышцы и суставов. Развивается ревматизм – хроническое воспаление суставов, сосудов сердца и легких;
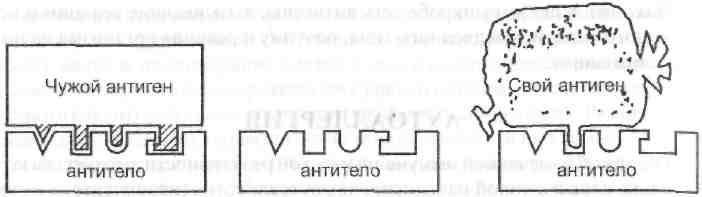
б) попадающий в организм чужой гаптен, соединяется с белком организма, образуя комплекс, на который вырабатываются антитела. Эти антитела способны затем реагировать с собственным белком даже в отсутствие гаптена.
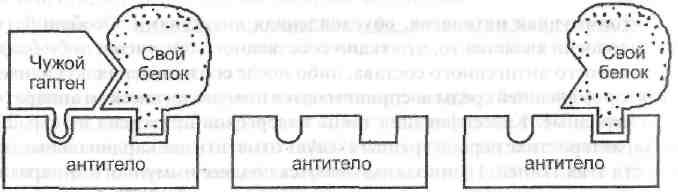
в) этот вариант похож на вариант б. В организм попадает чужой белок, реагирует с гаптеном организма, на комплекс нарабатываются антитела, продолжающие реагировать не только с комплексом, но и с гаптеном даже после выведения белка из организма.
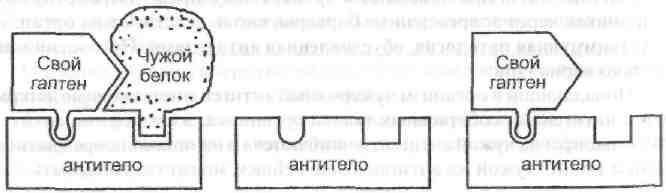
Иммунокомпетентные клетки к тканям собственного организма в норме уничтожаются либо подавляются Т-лимфоцитами-супрессорами (Тс). Ослабление Тс при старении, действии лекарственных препаратов, внешних воздействий приводит к стимуляции деления «запрещенных» клонов В-лимфоцитов и Тх-клеток, осуществляющих гуморальные и клеточные аутоиммунные реакции.
Аутоиммунные заболевания входят в число основных медицинских проблем человечества. Например, только в США 6,5 млн человек поражено ревматоидным артритом – самым распространенным аутоиммунным заболеванием. В настоящее время иммунологам известно более 120 различных аутоиммунных заболеваний. Часто эти болезни возникают в юношеском и молодом возрасте, приводя к инвалидизации и даже смерти. Ряд примеров аутоиммунных заболеваний, представлен в табл. 3.
Сахарный диабет 1 типа (диабет молодых) – разрушение островковых клеток поджелудочной железы, вырабатывающих гормон инсулин, регулирующий уровень сахара в крови. В крови больных обнаруживаются аутоантитела, в очагах поражения – множество Т-лимфоцитов. Наибольшее разрушение происходит именно за счет атаки клеток поджелудочной железы цитотоксическими Т-лимфоцитами. Клинические симптомы дефицита инсулина проявляются тогда, когда 90% β-клеток разрушено. Дефицит инсулина вызывает грубые нарушения всех видов обмена веществ в организме
Рассеянный склероз – хроническое аутоиммунное заболевание ЦНС, связанное с разрушением миелиновой оболочки аксона. Утрата оболочки аксоном нарушает проведение нервного импульса по нейрону. Больные страдают различными неврологическими нарушениями, начиная с неразборчивости речи, кончая параличом.
Таблица 3
Аутоиммунные заболевания человека
Заболевание |
Антиген |
Проявления |
Сахарный диабет 1 типа |
Белки β-клеток поджелудочной железы, вырабатывающие инсулин |
Дефицит инсулина и грубые нарушения углеводного, липидного и белкового обмена |
Рассеянный склероз |
Основной белок миелина нервных волокон |
Разрушение миелина, нарушение проведения нервного импульса |
Системная красная волчанка |
ДНК, гистоновые белки хромосом |
Поражение мелких сосудов всех органов с преимущественным вовлечением почек, сердца, головного мозга |
Миастения |
Рецептор ацетилхолина в нервно-мышечном синапсе |
Нарушение нервно-мышечной передачи, патологическая слабость мышц |
Ревматоидный артрит |
Белки и гликопротеины хряща |
Воспаление суставов и их стойкая деформация |
Системная красная волчанка – аутоиммунное заболевание, которое затрагивает многие органы, в них происходит разрушение тканей и возникают внутренние кровотечения, поражаются и клетки крови. Ведущая роль в развитии заболевания принадлежит В-лимфоцитам. Антитела связываются с ДНК и другими компонентами ядер всех без различия клеток организма и расщепляют ДНК. Связанные с ядерными антигенами антитела взаимодействуют с белками системы комплемента и образуют крупные аутоиммунные комплексы, которые приводят к развитию патологии. Около 90% больных – молодые женщины, что указывает на влияние половых гормонов на развитие этой болезни.
Для развития любого аутоиммунного заболевания необходимо сочетание множества факторов, среди которых главными являются
гормональный статус человека
наследственная предрасположенность
факторы окружающей среды.
Миастения относится к заболеваниям, в развитии которых преобладают гуморальные аутоиммунные реакции. Аутоантигеном-мишенью при миастении является ацетилхолиновый рецептор в нервно-мышечных синапсах, где происходит передача нервного импульса с нервной клетки на мышечную. Аутоантитела блокируют присоединение ацетилхолина к рецептору. Это прекращает прохождение импульса с нерва на мышцу, вызывая выраженную мышечную слабость: больному трудно не только выполнять физическую работу, но даже жевать, глотать, открывать глаза. В тяжелых случаях поражаются дыхательные мышцы и наступает смерть.
До настоящего времени лечение аутоиммунных заболеваний сводится в основном к неспецифическому подавлению иммунитета, что является обоюдоострым оружием, поскольку снижает сопротивляемость организма инфекциям. Кроме того, врачи борются с воспалением и симптомами каждого заболевания в отдельности. Главнейшей задачей иммунологии является создание методов избирательного подавления аутоиммунной патологии, для чего требуется глубокое знание всех механизмов этого сложнейшего заболевания у каждого конкретного больного.
Иммунодефицитные состояния
Иммунодефицитные состояния (иммунодефициты) – это нарушения иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. Иммунодефициты проявляются снижением иммунной реактивности и иммунной резистентности (устойчивости), высокой восприимчивостью к инфекциям. Различают иммунодефициты врожденные (первичные) и приобретенные (вторичные). Причинами, вызывающими первичные дефициты, являются генетические дефекты, связанные с выпадением одного из звеньев иммунитета:
дефицит макрофагов,
дефицит В-лимфоцитов – болезнь Брутона,
дефицит Т-лимфоцитов – синдром ди Джорджи,
дефицит стволовых клеток,
комбинированные формы (атаксия – потеря чувствительности, нарушение координации; телеангиэктазия – расширение сосудов на коже, сетчатке, внутренних органов).
Основными симптомами врожденных иммунитетов являются длительные, переходящие одна в другую инфекции. Встречаются редко.
Вторичные иммунодефициты наблюдаются у лиц с нормально функционировавшей от рождения иммунной системой и обусловлены ее повреждением в результате различных причин. В зависимости от вызвавших причин различают иммунодефициты:
приобретенные (СПИД),
индуцированные (γ -облучение, тяжелая болезнь, медикаментозные воздействия, старение),
спонтанные (причины не ясны, на их долю приходится до половины всех иммунодефицитов).
Наиболее ярким и драматичным примером вторичных иммунодефицитов является синдром приобретенного иммунодефицита человека (СПИД).
В лабораториях Люка Монтанье (Франция, 1983 год) и Роберта Галло (США, 1984 год) впервые выделен и охарактеризован вирус иммунодефицита человека (ВИЧ), вызывающий это заболевание. Этот вирус избирательно поражает Тх-лимфоциты, регулирующие работу иммунной системы. Попав в клетку, вирус может оставаться в латентном (неактивном) состоянии до 8-10 лет. В этот период явных симптомов болезни нет, что способствует распространению заболевания. Активация Тх-лимфоцитов под действием вторичной инфекции стимулирует стремительное размножение вирусных частиц. Последние, покидая клетку, полностью разрушают клеточную мембрану, что приводит к гибели Тх-лимфоцитов. Организм, лишенный естественной защиты, подвержен многочисленным, в том числе редким, болезням, обычно неопасным для организма здорового молодого человека.
Коварство ВИЧ усугубляется его чрезвычайно высокой способностью к мутациям. Выделены многочисленные варианты ВИЧ, различающиеся по первичной структуре РНК. Число жертв ВИЧ-инфекции на планете уже сопоставимо с числом погибших в двух последних мировых войнах. По мнению экспертов, заболевание быстро распространяется по континентам (стадия пандемии), реально угрожая человеческой популяции.
Строение и жизненный цикл вируса. ВИЧ относится к вирусам, содержащим две одинаковые молекулы РНК. Оболочка вируса сформирована липидами и трансмембранными белками gp120 и gp41.
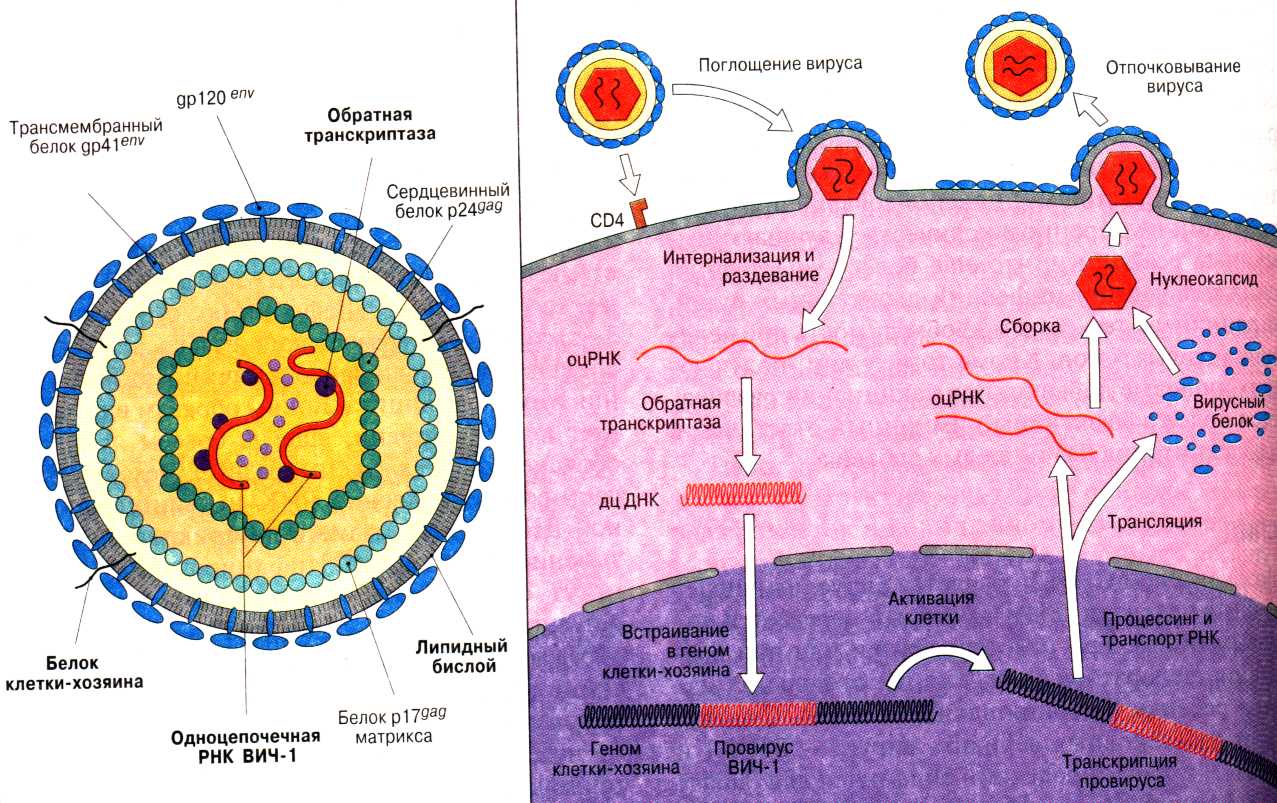
Рис. 16. Структура и жизненный цикл ВИЧ
ВИЧ избирательно связывается с Тх-лимфоцитами, несущими на своей поверхности маркеры CD4+, обладающие специфичностью по отношению к антигенам вируса белкам gp120 и gp41. Происходит слияние мембраны вируса с плазматической мембраной Тх-лимфоцита и РНК вируса попадает в цитоплазму. Затем идет процесс обратной транскрипции – синтез вирусной ДНК, которая встраивается в геном клетки-хозяина как провирус ВИЧ. В таком состоянии ретровирус может долгое время сосуществовать с инфицированным организмом. Активация клетки (при получении определенных молекулярных сигналов) ведет к транскрипции провирусной ДНК с образованием вирусной мРНК и последующему синтезу белков, формирующих структуру вирусной частицы. На завершающих этапах жизненного цикла ВИЧ происходит сборка многочисленных вирусных частиц. Ежедневно из инфицированных клеток высвобождается 109 – 1010 вирусных частиц, и сходное число новых клеток подвергается инфицированию и погибает.
Нарушения иммунных функций под влиянием ВИЧ состоят в истощении субпопуляции Т-клеток CD4+ и угнетении их реакций на антигены, снижении продукции цитокинов. В результате этих нарушений утрачивается способность цитотоксических Т-клеток к ВИЧ-специфичному ответу.
Задача лекарственной терапии СПИДа в современном понимании сводится к блокированию одной или нескольких стадий жизненного вируса ВИЧ при помощи химических соединений определенного строения.
Реакции антиген – антитело
и их практическое применение
В основе иммунохимических методов анализа лежит иммунная реакция взаимодействия антигена с антителом:
![]()
Общие закономерности реакции антитела с антигеном
Для возникновения сил связывания между антигеном и антителом необходимо тесное сближение взаимодействующих участков антигена и антитела, что достигается комплементарностью (или соответствием) конформаций эпитопа и паратопа. Чем ближе это соответствие, тем интенсивнее силы межмолекулярного притяжения. При неполном соответствии конформаций силы притяжения ослабевают и нарастают силы отталкивания. Если электронные оболочки эпитопов и паратопов перекрываются, то возникают силы отталкивания.
При взаимодействии специфических антител с антигеном между аминокислотными остатками антигенсвязывающего центра (паратопа) антитела и антигенной детерминантой (эпитопом) антигена образуются многочисленные нековалентные связи: водородные связи, электростатические, Ван-дер-Ваальсовы и гидрофобные взаимодействия.
Водородные связи образуются в результате взаимодействия атома водорода, ковалентно связанного с каким-либо электроотрицательным атомом одной молекулы, и неподеленной парой электронов электроотрицательного атома, как азот или кислород, другой молекулы. В реакции антиген – антитело в качестве таких групп обычно выступают амино- и гидроксигруппы. Водородная связь в 10 – 20 раз слабее обычной ковалентной связи.
Электростатическое взаимодействие возникает в результате притяжения противоположно заряженных атомных групп, расположенных на боковых цепях связывающихся белков. Электростатические силы возникают, например, при взаимодействии ионизированных амино- (-NH3+) и карбоксильной (-СОО-) групп.
Силы Ван-дер-Ваальса притягивают все молекулы через облако электронов, но действуют на очень коротких расстояниях.
Гидрофобное взаимодействие – это сильное притяжение в воде между неполярными (гидрофобными) фрагментами, которое почти полностью устраняет их контакт с водой.
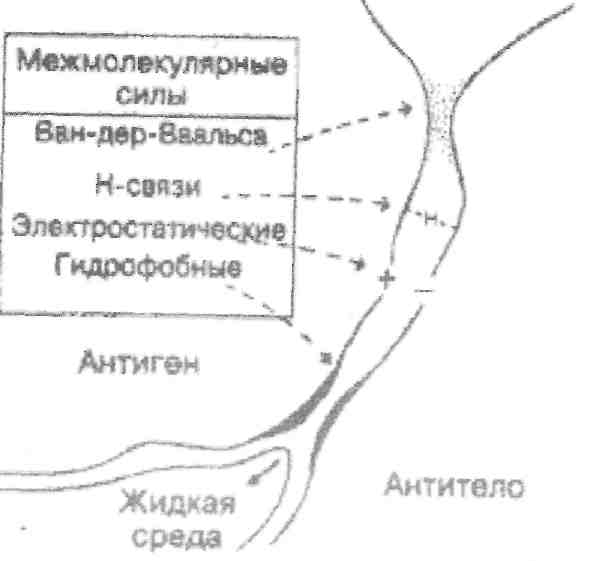
Рис. 17. Связи, участвующие в образовании
комплекса антиген – антитело
Конечно, по сравнению с ковалентными связями нековалентные межмолекулярные взаимодействия по отдельности слабы, но при большом количестве таких слабых взаимодействий суммарная энергия получается весьма значительной, что позволяет прочно удерживать антиген в активном центре антитела.
Аффинность (сродство) – степень специфического сродства антигенсвязывающего центра антитела (паратопа) к антигенной детерминанте (эпитопу) антигена.
Аффинность антитела к антигену – это результирующая силавозникающих между ними сил притяжения и отталкивания. Высокоаффинные антитела точно комплементарны по конформации антигену, а низкоаффинные – неточно.
Соединение антигена с антителом обратимо, поскольку нековалентные связи между паратопами и эпитопами способны диссоциировать.
К реакции антиген – антитело можно применить закон действующих масс и определить константу равновесия Кр, которая и представляет собой константу аффинности (сродства).
![]()
Аффинность относится к связыванию антитела с одной антигенной детерминантой (эпитопом) или моновалентным гаптеном.
Вместе с тем, количество антигенсвязывающих участков в молекуле антитела может быть два и более. Антигены, со своей стороны, могут быть как моновалентными (например, гаптены), так и поливалентными (например, микробная клетка). Сила взаимодействия поливалентных антител с поливалентными гаптенами получила название авидность.
Авидность – суммарная сила взаимодействия антитела с антигеном.
Поливалентность антигена и антител существенно усиливает прочность их соединения, так как для диссоциации комплексов антиген – антитело необходим разрыв сразу всех связей.
Авидность – степень прочности связывания молекулы антитела с молекулой антигена.
Чем выше аффинность (степень сродства), тем выраженнее и авидность (прочность связывания). Авидность тем сильнее, чем больше связывающих центров.
Иммунодиагностические реакции
Реакции преципитации
Реакции преципитации (от лат. precipitation – стремительное падение вниз) основаны на формировании и осаждении (выпадении в осадок) комплекса растворимый молекулярный антиген – антитело в присутствии электролита.
Максимум преципитации достигается при смешивании растворимых антигена и антитела в эквивалетных или близких к эквивалентым количествах. Для получения реакции преципитации антиген в возрастающих концентрациях добавляют к раствору антитела. Количество осаждающихся иммунных комплексов вначале возрастает, а затем падает. В кривой преципитации можно выделит три зоны:
– избытка Ат (количество добавляемого антигена недостаточно для того, чтобы связать все антитела);
– эквивалентности (когда все Ат и Аг связаны в комплексы);
– избытка
антигена (количество антигена превышает
необходимое для связывания всех антител).
избытка
антигена (количество антигена превышает
необходимое для связывания всех антител).
Рис. 18. Кривая преципитации
Различают несколько разновидностей реакций преципитации.
Реакции кольцепреципитации. В узкую пробирку наливают иммунную сыворотку, содержащую антитела, затем сверху осторожно наслаивают раствор, содержащий растворимый антиген. При оптимальном соотношении антигена и антител на границе этих двух растворов образуется непрозрачное кольцо преципитата.

Рис. 19. Реакция кольцепреципитации
Радиальная иммунодиффузия по Манчини – метод, позволяющий количественно определять антигены и антитела.
Антитела смешивают с агаровым гелем, затем полученную смесь наносят на предметные стекла и оставляют для застывания. В застывшем геле вырезают лунки, вносят в них раствор антигена в различных концентрациях и оставляют не менее чем на 24 ч. Антиген диффундирует в гель, связывается с антителами, и при достижении точки эквивалентности происходит осаждение комплексов антиген – антитело в виде кольца, диаметр которого прямо пропорционален концентрации антигена. Таким способом получают калибровочную кривую, с помощью которой можно количественно определить исследуемый антиген.
Гель, содержащий антитела
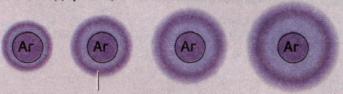
Кольцо преципитации
(Диаметр
кольца)2





Рис. 20. Калибровочная кривая
Для количественного определения антител применяют этот же метод в обратной последовательности: в гель добавляют антиген, а в лунки – антитела.
Иммуноэлектрофорез представляет собой сочетание метода электрофореза и иммунопреципитации. Смесь антигенов вносится в лунки геля и разделяется в геле с помощью элекрофореза, затем в канавку параллельно зонам элекрофореза вносят иммунную сыворотку, антитела которой диффундируют в гель и образуют в месте встречи с антигеном линии преципитации.
1. Разделение антигенов (а, б, в) |
||
+ |
|
− |
2. Внесение иммунной сыворотки в канавку |
||
|
||
3. Диффузия и преципитация |
||
|
||
Рис. 23. Схема иммуноэлектрофореза
Реакция агглютинации
Реакция агглютинации (от лат. agglutinatio – склеивание) – склеивание корпускулярных антигенов (бактерий, эритроцитов) антителами в присутствии электролитов (например, NaCl), в результате чего выпадает осадок. Реакция агглютинации основана на формировании и осаждении (выпадении в осадок) комплекса растворимый молекулярный антиген – антитело в присутствии электролита.
Иммуноферментный анализ
Рассмотренные методы в большей степени носят качественный или полуколичественный характер. При очень низких концентрациях компонентов образование комплекса антиген – антитело не может быть зарегистрировано ни визуально, ни простыми инструментальными средствами. Индикация комплекса антиген – антитело в таких случаях может быть осуществлена, если в один из исходных компонентов – антиген или антитело – ввести метку, которую можно легко детектировать в концентрациях, сопоставимых с определяемой концентрацией анализируемого вещества. В качестве метки могут использоваться радиоактивные изотопы (например, 125I), флюоресцентные вещества, ферменты. В зависимости от используемой метки различают радиоиммуный (РИА), флюоресцентный иммунный (ФИА), иммуноферментый (ИФА) методы анализа и др. В последние годы широкое практическое применение получил ИФА, что связано с возможностью количественных определений, высокой чувствительности, специфичности и автоматизации учета.
Иммуноферментные методы анализа – группа методов, которые позволяют выявить комплекс антиген – антитело с помощью субстрата, который расщепляется ферментом с появлением окраски.
Суть метода заключена в соединении компонентов реакции антиген – антитело с измеряемой ферментной меткой. Антиген или антитело, вступающие в реакцию, метятся ферментом. По превращению субстрата под действием фермента можно судить о количестве вступившего во взаимодействие компонента реакции антиген – антитело. Фермент в данном случае служит маркером иммунной реакции и позволяет наблюдать ее визуально или инструментально.
Ферменты представляют собой очень удобные метки, поскольку их каталитические свойства позволяют им действовать в качестве усилителей, так как одна молекула фермента может способствовать образованию более 1105 молекул продукта каталитической реакции в минуту. Необходимо подобрать такой фермент, который длительно сохраняет свою каталитическую активность, не теряет ее при связывании с антигеном или антителом, и обладает высокой специфичностью по отношению к субстрату.
Основные способы получения антител или антигенов, меченых ферментом, – конъюгатов: химические, иммунологические и генно-инженерные. Для постановки ИФА наиболее часто используются ферменты: пероксидаза хрена, щелочная фосфатаза, галактозидаза и др.
Для выявления активности фермента в комплексе антиген-антитело с целью визуального и инструментального учета реакции используют хромогенные субстраты, растворы которых, изначально бесцветные, в процессе ферментативной реакции приобретают окраску, интенсивность которой пропорциональна количеству фермента. Так, для выявления активности пероксидазы хрена в твердофазном ИФА в качестве субстрата используют 5-аминосалициловую кислоту, дающую интенсивное коричневое окрашивание, орто-фенилендиамин, образующий оранжево-желтое окрашивание. Для выявления активности щелочной фосфатазы и β-галатозидазы используют нитрофенилфосфаты и нитрофенилгалактозиды соответственно.
Результат реакции при образовании окрашенного продукта определяют визуально или с помощью спектрофотометра, измеряющего поглощение света с определенной длиной волны.
Известно много вариантов постановки ИФА. Различают гомогенный и гетерогенный варианты.
По методике постановки различают конкурентный и неконкурентный методы ИФА. Если на первой стадии в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод является неконкурентным. Если на первой стадии присутствуют анализируемое соединение (антиген) и его аналог (меченый ферментом антиген), конкурирующие между собой за связывание с имеющимися в недостатке центрами специфического связывания (антителами), то метод является конкурентным. В этом случае чем больше исследуемого антигена содержит раствор, тем меньше количество связывающихся меченых антигенов.
Гомогенный ИФА
Гомогенные методы ИФА характеризуются тем, что все иммунохимические и ферментативные реакции происходят в однофазной системе (в растворе) и не требуют механического разделения и удаления промежуточных продуктов и непрореагировавших компонентов. В основе гомогенного ИФА лежит ингибирование активности фермента при его соединении с антигеном и восстановление ее в результате реакции антиген – антитело или же, наоборот, потеря активности фермента в результате реакции.
Необходимым условием гомогенного ИФА является изменение наблюдаемой активности фермента при взаимодействии меченого антигена с антителом. Основанный на этом принципе гомогенный ИФА получил в литературе название EMIT – анализ или иммуноаналитический метод с регуляцией ферментатавной активности (от англ. enzyme multiplied immunoassay techniqje).
Конъюгат Аг-Е, подобно свободному ферменту, катализирует превращение субстрата S в продукт реакции P, а комплекс Ат–Аг-Е не проявляет ферментативной активности:

Потеря активности может быть вызвана изменением конформации молекулы фермента и нарушением структуры его активного центра, а также пространственной недоступностью активного центра вследствие присоединения антитела. Если теперь добавить свободный антиген, то он, конкурируя за антитело, вызовет регенерацию конъюгата Аг-Е и появление ферментативной активности.
Схема гомогенного анализа довольно проста: меченые ферментом антигены (конъюгаты) конкурируют с антигенами анализируемой пробы за связывание с антителами, количество которых ограничено. Все компоненты находятся в жидкой фазе или в растворе. Чем больше антигена в анализируемом образце, тем больше его свяжется с антителами и тем больше конъюгата (меченых ферментом антигенов) останется в растворе несвязанным и проявит ферментативную активность по отношению к субстрату, изменяя цвет раствора. Таким образом, ферментативная активность конъюгата прямо пропорциональна количеству свободного антигена в исследуемой пробе.
При отсутствии же в исследуемом растворе анализируемого антигена конъюгат этого антигена с ферментом свяжется с соответствующими антителами, и входящий в комплекс Ат–Аг-Е фермент потеряет или существенно снизит свою каталитическую активность.
При наличии калибровочной кривой, отражающей зависимость между концентрацией Аг и ферментативной активностью конъюгата Аг-Е, можно определить концентрацию антигена в исследуемом образце.
Существенным достоинством гомогенного ИФА является экспрессность определения, которая составляет 2 – 5 минут. В настоящее время налажен промышленный выпуск различных тест-систем для быстрого выявления токсинов, стероидных гормонов, гаптенов, лекарственных соединений в биологических жидкостях. К недостаткам следует отнести меньшую чувствительность, чем в гетерогенном ИФА ( 1 мкг/мл).
Гетерогенный ИФА
Гетерогенные ИФА (или твердофазные ИФА) включают методы, в которых анализируемое соединение находится в двух фазах. Для разделения компонентов иммунохимической реакции используют твердую фазу (нерастворимый носитель, как правило, пластик) с иммобилизованными на ней антителами или антигеном, которую отмывают на каждой стадии с целью удаления промежуточных продуктов и непрореагировавших компонентов.
Иммобилизацию можно проводить путем ковалентного связывания антител (антигенов) с активированным носителем, используя химические подходы, а также путем физической адсорбции антител (антигенов) на поверхности твердых полимеров (например, полистирольных пластин). В зарубежной литературе это направление получило название ELISA-тест или энзимсвязанный иммуносорбентный метод (от англ. enzyme-linked immunosorbent assay).
Неконкурентный ИФА определения антигенов на примере использования меченых ферментом специфических антител и иммобилизованных антител.
К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген. В процессе инкубации образуется специфический комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся антигенов и добавляют меченые антитела – конъюгат. При этом количество связавшегося конъюгата прямо пропорционально количеству антигена в исследуемом образце.
После вторичной инкубации и удаления избытка конъюгата добавляют хромогенный субстрат для используемого фермента, который изменяет цвет под действием фермента, т. е. происходит ферментативная реакция с окрашиванием раствора в лунках. Степень окраски прямо пропорциональна количеству меченых ферментом специфических антител, фермента и, соответственно, исследуемого антигена. Измерения оптической плотности раствора в лунках при определенной волне (в зависимости от используемого субстрата) проводят с помощью специальных спектрофотометров, адаптированных для микропланшетов – ридеров. Количественную оценку концентрации антигена в пробе определяют, сравнивая результаты с калибровочной кривой зависимости оптической плотности раствора от концентрации стандартного раствора антигена.

Поскольку на стадии выявления специфического иммунокомплекса антиген оказывается связанным с молекулами иммобилизованных и меченых антител, в литературе этот метод часто называют «сэндвич»-метод (от англ. sandvich) или двухцентровый метод ИФА (от англ. two-site assay).
Этот метод может быть использован для анализа только тех антигенов, на поверхности которых имеется, по крайней мере, две антигенные детерминанты. Для анализа большого количества моновалентных антигенов (лекарственных соединений, пестицидов и др.) он неприемлем.
Основное достоинство данного метода – высокая чувствительность. Предел обнаружения соединений данным методом в настоящее время достигает величины порядка 10-21 моль, что соответствует обнаружению в образце всего 600 молекул анализируемого вещества. Максимальная чувствительность достигается при проведении каждой иммунологической реакции в равновесном режиме, что сказывается на длительности проведения анализа, которая в среднем составляет 4 – 6 часов.
Неконкурентный ИФА определения антител на примере использования меченых ферментом вторичных антител и иммобилизованных антигенов.
К иммобилизованному антигену добавляют исследуемую сыворотку. После инкубации и отмывания от несвязавшихся антител добавляют меченые вторичные антитела, которые специфичны к анализируемым антителам. После вторичной инкубации и удаления избытка меченых вторичных антител содержание ферментной метки на носителе пропорционально концентрации специфических антител в сыворотки.

Данная схема является одной из наиболее распространенных ИФА определения антител, поскольку позволяет выявлять антитела к разным антигенам.
Гетерогенный конкурентный ИФА определения антигена на примере использования меченого антигена и иммобилизованных антител.
К иммобилизованным на носителе антителам добавляют раствор, содержащий анализируемый антиген и фиксированную концентрацию конъюгата антигена с ферментом. После проведения инкубации носитель отмывают от несвязавшихся свободного и меченого антигена и регистрируют ферментативную активность на носителе, которая обратно пропорциональна концентрации определяемого антигена.


Рис. 24. Калибровочная кривая, отражающая зависимость
оптической плотности раствора от концентрации антигена
Иммунобиосенсоры
Биосенсоры находят все более широкое применение в клинической диагностике для определения важнейших параметров организма человека (глюкозы, холестерина, ионов натрия, калия и кальция и др.); в пищевой и пивной промышленности для контроля качества продуктов питания (измерения температуры, рН, содержания углекислого газа и кислорода, отдельных реагентов и продуктов производства), а также в мониторинге состояния окружающей среды, когда требуется определить содержание тех или иных вредных веществ в воздухе, почве, воде и других средах.
Принципиально биосенсоры состоят из двух преобразователей – биохимического и физического, которые находятся в тесном контакте между собой. Биохимический преобразователь состоит из биораспознающего элемента, который способен реагировать на присутствие определяемого компонента и изменение его содержания. В качестве биораспознающих реагентов широко используются ферменты, антитела, антигены, клетки, ткани, микроорганизмы в иммобилизованном состоянии. Физический преобразователь – трансдьюсер – преобразует первичный сигнал, возникающий в результате реакции биочувствительного элемента с определяемым компонентом, в электрический или световой сигнал, который затем регистрируется с помощью светочувствительного или электронного устройства.
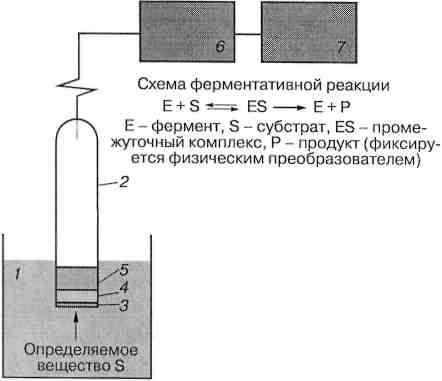
Рис. 25. Принципиальная схема биосенсора
Для повышения избирательности на входном устройстве перед биочувствительным слоем помещают полупроницаемые мембраны, через которые определяемое вещество диффундирует в биочувствительный слой, взаимодействует с ним, в результате чего формируется аналитический сигнал на компонент.
Иммунобиосенсоры – аналитические устройства, использующие антитела для «узнавания» определенных молекул и выдающие информацию об их присутствии и количестве в виде электрического сигнала. Антитела – наиболее универсальные биореагенты, которые могут обеспечить необходимую селективность. Кроме того, в настоящее время антитела можно получить практически к любому веществу (антигену).
Биосенсоры с антителами в качестве распознающего элемента имеют следующие достоинства:
исключительная селективность;
очень высокая чувствительность;
прочное связывание с антигеном.
К недостаткам работы био- и иммуносенсоров можно отнести то, что они не позволяют, как правило, определять несколько соединений одновременно.
Часто определение анализируемого вещества (антигена) проводят с помощью конкурентного иммуноанализа с применением электрохимического трансдьюсера (например, йодид-селективного электрода). На поверхности электрода адсорбирована желатиновая мембрана с иммобилизованными в ней антителами против определяемого антигена. Электрод помещают в раствор, содержащий как свободный антиген, так и его конъюгат (антиген, меченый ферментом). Меченый и свободный антиген конкурируют за связывание с антителами, причем чем меньше концентрация свободного антигена, тем больше меченого антигена свяжется с антителами, и наоборот, чем больше концентрация анализируемого антигена, тем меньше меченого антигена свяжется с мембраной на поверхности электрода. При добавлении в раствор перекиси водорода и йодид-ионов в качестве субстратов пероксидазы в мембране электрода протекает ферментативная реакция:
 ,
,
в ходе которой происходит окисление йодид-ионов с образованием йода. При этом возникающий на йодид-селективном электроде потенциал пропорционален количеству связанного фермента (меченого антигена), а значит, обратно пропорционален логарифму концентрации анализируемого антигена.

Количественную оценку концентрации антигена в пробе определяют, сравнивая результаты с калибровочной кривой зависимости электродного потенциала от концентрации стандартного раствора антигена (рис. 26).

Рис. 26. Калибровочная кривая, отражающая зависимость
электродного потенциала от концентрации антигена.
Иммунная система и экология
Влияние вредных факторов окружающей среды
на иммунную систему человека
Среди экологических факторов, влияющих на организм человека можно выделить физические, химические, биологические и факторы. Реакции адаптации (приспособления) проявляются на уровне различных, и в первую очередь, регуляторных систем (нервной, эндокринной, иммунной). Антропогенные факторы вносят дополнительный вклад и нередко приводят к срыву адаптационных возможностей организма. С этой точки зрения, иммунная система является индикаторной системой экологического неблагополучия, поскольку она чутко реагирует на изменение условий окружающей среды,
В качестве примера воздействия на иммунную систему производственных факторов можно привести результаты обследования рабочих двух нефтепромыслов (Осинского и Гежского), добывающих нефть в зоне проведения подземных атомных взрывов, которые проводились в 70 – 80-х гг. в целях увеличения нефтеотдачи. У обследованных нефтяников по сравнению с группой здоровых взрослых мужчин, проживающих в экологически благополучных районах, были обнаружены тотальное снижение количества Т- и В-лимфоцитов, угнетение активности фагоцитоза и повышение уровня иммуноглобулинов всех классов.
Наблюдение за детьми, проживающими в условиях экологического неблагополучия в течение 10 лет показало, что в этой группе детей, обследованных к пятилетнему возрасту, формируется экологическая иммуносупрессия: снижается численность Т-лимфоцитов, возрастает количество В-лимфоцитов, уменьшаются концентрации иммуноглобулинов классов М, G, A в крови. Вместе с тем у пятилетних детей из зоны неблагополучия зафиксирована стимуляция активности фагоцитов. К девятилетнему возрасту повышение активности сменялось угнетением фагоцитоза, а к пубертатному периоду данный уровень снова превышал уровень поглотительной способности фагоцитов детей, проживающих в благоприятном районе. Таким образом, при анализе возрастной динамики мы сталкиваемся с проявлением варианта адаптационной реакции на воздействие комплекса антропогенных факторов. Для отдельно взятых параметров регистрируется волнообразность изменений: фаза стимуляции чередуется с последующим угнетением. Это наглядно демонстрирует пластичность компенсаторных возможностей иммунной системы растущего организма.
Общий результат клинических и экспериментальных исследований: антропогенные факторы влияют на функционирование иммунной системы и могут приводить к срыву адаптационных механизмов и развитию экологически обусловленного вторичного иммунодефицитного состояния (ЭОВИДС).
Иммунитет и стресс
Понятие стресс было введено в 30-х годах ХХ в. для обозначения реакции организма на сверхсильные раздражители внешней или внутренней среды. Автор концепции стресса канадский ученый Г. Селье установил, что действие различных по природе сильных раздражителей (физических, химических, биологических) вызывает в организме подопытных животных однотипные изменения, среди которых увеличение коры надпочечников, снижение массы тимуса и лимфоидной ткани, появление язв в желудочно-кишечном тракте (триада Селье). Концепция стресса получила дальнейшее плодотворное развитие, сегодня расшифрованы его молекулярные механизмы. Именно при стрессе в наибольшей степени проявляется единство и взаимодействие трех регулирующих систем организма: нервной, эндокринной и иммунной.
Стресс (общий адаптационный синдром) – универсальная неспецифическая нейрогормональная реакция организма в виде напряжения неспецифических адаптационных механизмов в ответ на повреждение или сигнал угрозы жизни или благополучию организма, проявляющаяся в повышении резистентности (устойчивости) организма.
В качестве стрессорных агентов могут выступать психоэмоциональные факторы, оказывающие психотравмирующее воздействие на организм, а также физические, механические, химические и биологические факторы, приводящие к биологическому повреждению организма.
Современный человек подвержен действию разнообразных стрессовых факторов: интоксикаций, травм, инфекций, изнурительных физических нагрузок. Особую актуальность приобретает сегодня психоэмоциональный стресс при интенсивной умственной или физической работе в условиях дефицита времени и недостаточности сна, при неблагоприятных событиях в семье, на работе и в обществе, угрозе жизни и социальному статусу. К числу стрессовых факторов относят и экзаменационные сессии, интенсивные спортивные тренировки и соревнования.
В развитии стресса выделяют три стадии: тревоги и мобилизации, повышенной резистентности и истощения. Способность организма сопротивляться внешним повреждающим факторам изменяется в ходе этих стадий, как показано на графике (рис. 27). Стадия тревоги, характеризующаяся временным снижением сопротивляемости, переходит затем в стадию резистентности, т. е. на качественно более высокий уровень. Если действие вызвавшего стресс фактора слишком сильное или длительное, то закономерно наступает последняя стадия стресса – стадия истощения, которая может привести к гибели организма. Такую разновидность стресса Г. Селье назвал дистрессом – «плохой стресс». Однако при действии менее сильных факторов сопротивляемость организма возвращается к исходному уровню. Этот благоприятный вариант развития событий был назван эустрессом – «хороший стресс».
Стадия
мобилизации
Стадия
повышенной
резистентности
Стадия
истощения
Рис. 27. Динамика уровня резистентности организма
в зависимости от стадии стресса
В смене фаз стресса ведущую роль играют системы нейроэндокринной регуляции: симато-адреналовая и гипоталамо-гипофизарно-надпочечниковая. По современным данным, иммунная система также вовлечена в развитие стресса, отвечая на действие стресс-реализующих гормонов. Иммунокомпетентные клетки (Т- и В-лимфоциты, макрофаги, нейтрофилы и эозинофилы, клетки тимуса) имеют рецепторы ко многим гормонам, в том числе к адреналину и кортизолу. Кратко остановимся на их биологических эффектах.
Адреналин – гормон мозгового вещества надпочечников – выделяется в кровь под влиянием стимуляции симпатического отдела вегетативной нервной системы. По химической природе он представляет собой производное аминокислоты тирозина, хорошо растворим в воде и действует на большинство клеток человеческого организма через специфические α- и β-адренорецепторы. В результате взаимодействия гормона с этими рецепторами клеточной мембраны приходят в действие системы внутриклеточных посредников, осуществляющие активацию ферментов распада гликогена, триглицеридов, ускоряющих окисление глюкозы, тем самым мобилизуя резервные вещества для энергетического обмена. Адреналин увеличивает частоту и силу сокращений сердца, повышает артериальное давление, расширяет бронхи и сосуды мышц, подготавливая организм к физической нагрузке. Известно, что адреналин угнетает функцию Т-хелперов, через α-адренорецепторы активирует, а через β-адренорецепторы угнетает активность фагоцитирующих клеток.
В ответ на действие экстремальных факторов головной мозг стимулирует выработку кортиколиберина гипоталамусом, который, в свою очередь, вызывает секрецию в кровь адренокортикотропного гормона (АКТГ) гипофизом. Пептидный гормон АКТГ служит главным стимулятором секреции корой надпочечников стероидного гормона кортизола – главного представителя группы глюкокортикоидов. В отличие от адреналина кортизол обладает липофильностью, поэтому проникает через клеточную мембрану и связывается с белком-рецептором внутри клетки. Это событие запускает транскрипцию ряда генов, отвечающих за синтез ферментов. Вот почему биологическое действие кортизола развертывается медленнее, но более продолжительно по сравнению с адреналином. Кортизол вызывает гидролиз белков во всех органах, кроме печени, а образовавшиеся свободные аминокислоты служат для синтеза глюкозы или окисляются для получения энергии АТФ. Кортизол подавляет синтез антител В-лимфоцитами, вызывает гидролиз белка в клетках тимуса и лимфоузлов, нарушает активацию макрофагов и T–хелперов типа Тh1, угнетает продукцию ИЛ-1 и ИЛ-2. Сверхвысокие концентрации кортизола, наблюдаемые при сильном стрессе, способны вызвать запрограммированную гибель – апоптоз лимфоцитов и клеток тимуса.
При травме или инфекциях существенный вклад в развитие стресса может внести синтезируемый макрофагами в очаге воспаления ИЛ-1, способный индуцировать секрецию АКТГ гипофизом. Стимуляторами продукции кортиколиберина гипоталамусом являются синтезируемый T-лимфоцитами ИЛ-6, а также макрофагальный TNF-α. Активация продукции этих цитокинов при стресcе оказывает существенное угнетающее действие на функции клеток системы иммунитета через соответствующие рецепторы. Особую роль в развитии стресc-реакции под действием инфекции, особенно инфекции вирусной, играет разновидность АКТГ, синтезируемого лимфоцитами. Результатом всех этих воздействий служит стимуляция секреции кортизола надпочечниками. Таким образом, в развитии стресс-реакции существуют трехсторонние связи между нервной, эндокринной и иммунной системами.
Стресс умеренной интенсивности (эустресс) вызывает преимущественно перераспределение лимфоцитов. Количество клеток в селёзенке и тимусе уменьшается непосредственно после начала воздействия стрессового фактора. Незрелые кортикальные тимоциты мигрируют из тимуса и поступают в основном в костный мозг. В период мобилизации клеток лимфоидных тканей популяция лимфоцитов костного мозга увеличивается на 40 – 60%. Под влиянием гормонов коры надпочечников усиливается миграция в костный мозг зрелых T-лимфоцитов и части тимоцитов, прошедших селекцию на способность распознавать чужродные для данного конкретного организма клоны, но не аутологичные белки. Увеличивается доля лимфоцитов фенотипа CD4. Поступающие в костный мозг при стрессе клетки обладают высокой способностью к иммунному ответу. Увеличение количества лимфоцитов в костном мозгу совпадает по времени с мобилизацией гранулоцитарного резерва, с резким увеличением числа нейтрофилов и снижением содержания лимфоцитов в крови. Биологический смысл перераспределения лимфоидных клеток при стрессе можно представить следующим образом. Организм жертвует частью функций, а именно возможностью развития интенсивного иммунного ответа, для того чтобы использовать все ресурсы ради сохранения жизни или целостности системы. В то же время усиливается неспецифическая составляющая иммунной защиты с целью недопустить проникновения патогенных микроорганизмов. Отражением этого процесса служит мобилизация гранулоцитарного резерва, резкое увеличение числа нейтрофильных гранулоцитов в крови. В костном мозгу создаётся резерв зрелых иммунокомпетентных клеток как на случай прорыва в организм патогенов, так и для быстрого восстановления иммунокомпетентности после прекращения стрессорного воздействия.
При длительных и интенсивных стрессах (дистрессе) под действием кортизола тормозится синтез ИЛ-1 – ИЛ-6, ИЛ-8, ИЛ-11, ИЛ-12, ИЛ-13, ИФНγ, TNFα. Многочисленными исследованиями доказано подавляющее действие кортизола и его синтетических аналогов на воспаление, вызванное самыми разнообразными причинами. Введение этих веществ угнетает сопротивляемость организма инфекции. Кортизол активирует синтез липокортинов, которые тормозят активность фосфолипазы-А2 и снижают действие таких медиаторов воспаления, как простагландины и лейкотриены, а также брадикинин и гистамин. Аналогичная ситуация складывается и при стрессе: активизируются скрытые очаги инфекции (например, герпес, туберкулез), возникают тяжелые инфекционные заболевания от внешних бактерий и вирусов, безопасных в обычных условиях. Наконец, при интенсивном стрессе кортизол вызывает апоптоз, приводящий к снижению числа функционирующих клеток иммунной системы. Но даже в таком развитии событий присутствует биологическая целесообразность. Так, стресс высокой интенсивности приводит к апоптозу большей части клеток тимуса, среди которых содержатся и потенциально аутоагрессивные, не прошедшие отбор T-лимфоциты. При повреждении зоны тимуса они могут выйти в кровь или окружающие ткани и нанести существенный вред организму в результате развития аутоиммунных реакций. Высокая концентрация кортизола предотвращает эти нарушения. Длительный интенсивный стресс заканчивается стадией истощения. Надпочечники уменьшаются в размерах, значительно снижается содержание кортизола в крови, вслед за этим нормализуется синтез белков и уменьшается уровень апоптоза клеток. Усиливается миграция стволовых клеток из костного мозга в повреждённую ткань, что способствует её восстановлению. Таким образом, в благоприятных условиях эта стадия стресса способствует восстановлению повреждённых органов и систем.
У людей, длительное время подвергающихся физическим, химическим и биологическим воздействиям (в металлургической, радиотехнической, химической промышленности и др.) изменения иммунитета носят стадийный характер, сходный со стадиями развития стресса. Для первой стадии характерно повышение уровня только иммуноглобулина IgA, для второй – повышение уровней Ig всех классов. При этом отсутствуют клинические проявления заболеваний. При развитии третьей стадии уровни Ig всех классов либо восстанавливаются до нормы, либо снижаются дальше. Снижается также численность Тх-лимфоцитов, что приводит к срыву адаптационных ресурсов организма и развитию вторичной иммунологической недостаточности (ЭОВИДС).
Питание и иммунологическая реактивность. Как правило, иммунные реакции при недостаточном питании нарушаются. Более всего этот фактор влияет на пять форм иммунологической реактивности:
клеточный иммунитет,
фагоцитарную функцию,
активность системы комплемента,
секрецию антител,
синтез цитокинов.
Белково-калорийная недостаточность оказывает выраженное негативное влияние на лимфоидную ткань и клеточный иммунитет, на это указывает снижение числа Т-хелперов CD4+ и уменьшение соотношения CD4+/CD8+, снижение концентраций в крови иммуноглобулинов всех классов. Недостаток в пище отдельных микроэлементов, таких как цинк, селен, медь или железо, а также витаминов А, Е, В6 и фолата ингибирует активность клеточного и гуморального иммунитета. Однако не следует думать, что избыточное питание обеспечит усиление иммунитета. Избыток в пище животных жиров и легкоусвояемых углеводов приводит к ожирению, при котором развивается снижение Т-клеточной функции, фагоцитарной активности нейтрофилов, повышения уровня провоспалительных цитокинов в крови. Высокий риск развития атеросклероза, сахарного диабета и сердечно-сосудистых заболеваний у тучных людей отчасти обусловлен этими иммунологическими нарушениями. Поэтому полноценное питание здоровых и больных следует рассматривать как обязательное условие нормальной работы иммунной системы.
ИММУНОБИЛОГИЧЕСКИЕ ПРЕПАРАТЫ
Вакцины
Вакцины – это препараты, способные создать активный иммунитет против заболевания, получаемые из цельных микроорганизмов, их отдельных компонентов или продуктов жизнедеятельности. Вакцины используются для активной иммунизации человека и животных.
Вакцины можно разделить на следующие типы:
Живые вакцины – это препараты, содержащие жизнеспособные штаммы патогенных микроорганизмов, способные размножаться в организме, но ослабленные (аттенуированные) до степени, исключающей возникновение заболевания, с сохранением высокой иммуногенной активности. При введении в организм живые вакцины вызывают так называемый вакцинальный процесс, который заключается в размножении вакцинного штамма и его воздействии на иммунокомпетентные клетки. Результатом является формирование специфического иммунитета к возбудителю данной инфекционной болезни.
Примеры: вакцины против полиомиелита, туберкулеза, кори, паротита, краснухи, сибирской язвы, туляремии, гриппа, чумы.
Преимущества живых вакцин:
1) высокая напряженность и длительность иммунитета;
2) однократная иммунизация;
3) использование небольших доз;
Недостатки:
1) вакцины достаточно реактогенны, так как содержат до 99% балласта;
2) противопоказаны при различных иммунодефицитах;
3) сохраняется возможность обратных мутаций с приобретением вирулентных свойств;
4) требуют специальных условий хранения.
Принципы получения живых вакцин.
Аттенуация – снижение вирулентных свойств возбудителя инфекции, достигается путем создания условий, неблагоприятных для размножения и развития микроорганизма, но не вызывающих его гибель. Для этого могут использоваться следующие способы.
Культивирование микроорганизмов при неблагоприятных температурных условиях. Именно таким путем Л. Пастер получил в 1881 г. противосибироязвенную вакцину. Он культивировал сибироязвенный микроб на жидкой питательной среде при 42,5 – 43оС. В этих условиях бациллы сибирской язвы не образуют спор и постепенно теряют вирулентность.
Культивирование микроорганизмов при добавлении вредных веществ. Этим методом в 1924 г. французскими учеными А. Кальметтом и С. Гереном была получена противотуберкулезная вакцина. В течение 13 лет они культивировали микобактерии туберкулеза бычьего типа на картофельной среде с добавлением бычьей желчи и 5%-го раствора глицерина. Непрерывное неблагоприятное действие желчи привело к ослаблению вирулентных свойств туберкулезной палочки.
Облучение ультрафиолетовыми лучами. Примером может служить сухая живая вакцина против листериоза. В 1965 г. А. В. Селивановым с соавторами из мозга больной овцы был выделен возбудитель листериоза. Путем сочетания облучений УФ-лучами и направленной селекции был получен аттенуированный штамм бактерии.
Многократные пассажи возбудителя через организм невосприимчивых или маловосприимчивых к этой болезни животных. Для этой цели часто применяют кроликов, которых впервые использовал Л. Пастер для аттенуации возбудителя рожи свиней.
Живые вакцины могут быть получены путем отбора авирулентных штаммов, которые возникают в естественных условиях под влиянием неблагоприятных факторов или в лаборатории путем селекции и длительного выращивания.
Для получения инактивированных вакцин на биофабриках высевают производственный вакцинный штамм на жидкую питательную среду и культивируют для наработки достаточного количества микробной массы. Полученную микробную массу затем подвергают воздействию физико-химических факторов.
Для повышения иммуногенной эффективности живых и инактивированных вакцин применяют адъюванты. Такие вакцины называются депонированными. Механизм действия адъювантов состоит в том, что в месте введения они вызывают воспалительную реакцию. Поступление антигена из очага воспаления происходит медленно, что приводит к увеличению продолжительности его иммуностимулирующего действия.
Химические вакцины состоят из антигенов, полученных из микроорганизмов преимущественно химическими способами. Они обладают слабой реактогенностью, могут вводиться в больших дозах и многократно. Химические вакцины отличаются неограниченными возможностями для приготовления ассоциированных вакцин и возможностью длительного хранения в небольших объемах. К химическим относятся вакцины против холеры и брюшного тифа.
Поливалентные вакцины – биопрепараты, приготовленные из различных серологических типов данного вида микроорганизмов. В медицине применяется поливалентная вакцина против полиомиелита – живая вакцина, составленная из 3 аттенуированных штаммов вируса. Для вакцинации животных используются поливалентные вакцины против ящура, африканской сонной болезни лошадей и др.
Ассоциированные (смешанные) вакцины – это биопрепараты приготовленные в отличие от поливалентных вакцин из микробных культур нескольких возбудителей инфекционных болезней. Ассоциированные вакцины используют для одновременной иммунизации против нескольких инфекций. Так, широко применяемая в практике вакцина АКДС, представляющая собой убитую коклюшную вакцину в ассоциации с дифтерийным и столбнячным анатоксином, позволяет осуществлять одновременную профилактику против коклюша, дифтерии и столбняка. Секстаанатоксин, содержащий сорбированные на гидроксиде алюминия столбнячный, ботулинические и гангренозные анатоксины, используют для иммунизации против столбняка, ботулизма и газовой гангрены. Находит применение живая ассоциированная вакцина против кори, паротита и краснухи.
Рекомбинантные вакцины – препараты, полученные при культивировании рекомбинантных штаммов бактерий и вирусов, – новейшее достижение генной инженерии и молекулярной иммунологии. В настоящее время получены рекомбинантные штаммы дрожжевых клеток, кишечной палочки, вируса осповакцины, в геном которых встроены гены патогенных микробов, в результате чего они приобретают способность продуцировать их антигены. При культивировании таких рекомбинантных штаммов они, в соответствии с заданной генетической программой, синтезируют антигены возбудителей, которые затем выделяют из культуральной жидкости и на их основе конструируют молекулярные вакцины.
Имеются рекомбинантные штаммы кишечной палочки и дрожжей, продуцирующие антигены вирусов гепатитов А и В, кори, гриппа, полиомиелита, бешенства, антигены бактерий бруцеллеза, туляремии, сифилиса. На рис. 28 показана принципиальная схема получения вакцины Энджерикс/вакцины против гепатита В.
Рис. 28. Биотехнологическая схема получения вакцины Энджерикс
Иммунные сыворотки и иммуноглобулины
Иммунные сыворотки и иммуноглобулины – препараты, содержащие готовые антитела, используемые для пассивной иммунизации человека и животных, а также для лечения многих инфекционных заболеваний. Иммунные сыворотки получают от иммунизированных животных (гетерологичные сыворотки) или от переболевших и вакцинированных людей (гомологичные сыворотки). Гетерологичные иммунные сыворотки изготовляют на биофабриках, используя в качестве продуцентов чаще всего лошадей, мулов, ослов, волов, овец, свиней. Проводят гипериммунизацию животных возрастающими дозами антигена. Схемы гипериммунизации в зависимости от вида препарата и животного-продуцента отличаются по своей продолжительности, кратности, интервалом между циклами иммунизации, дозой антигена. На пике антителообразования, когда в сыворотке крови животного установлен максимальный уровень специфических антител (на 7 – 10 день после последнего введения антигена), у иммунизированных животных забирают кровь (до 6 мл/кг массы животного), освобождают ее от форменных элементов и белка фибрина, фильтруют, стандартизуют по концентрации антител, добавляют консервант.
Различают четыре вида иммунных сывороток: антибактериальные (содержащие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша), противовирусные (коревая, гриппозная, антирабическая), антитоксические (сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены) и смешанные (содержащие антитела против бактерий и токсинов).
Иммунные сыворотки содержат готовые специфические антитела, способные нейтрализовать действие патогенных возбудителей и токсичных продуктов их жизнедеятельности. Иммунные сыворотки при введении здоровым организмам создают пассивный иммунитет, поэтому их применяют как профилактическое средство при вспышках некоторых инфекционных заболеваний.
Однако иммунные сыворотки имеют относительно низкую концентрацию антител и содержат много балластных белков, что может вызывать побочные эффекты при их применении. Поэтому из них выделяют иммуноглобулины, препараты которых лишены этих недостатков.
Иммуноглобулины представляют собой водный раствор глобулиновой фракции белка иммунной сыворотки крови, который содержит гамма- и бета-глобулины. В основу приготовления препаратов иммуноглобулинов положено фракционирование сывороточных белков различными методами. Из физико-химических способов разделения применяют высаливание нейтральными солями (сульфатом натрия или аммония и др.), экстракцию органическими растворителями или разделение с помощью ионообменных смол. К физическим методам относятся электрофорез, ультрафильтрация и ультрацентрифугирование.
Иммунные сыворотки и иммуноглобулины создают пассивный иммунитет практически сразу же после их введения. Однако срок циркуляции антител в организме – относительно непродолжительный (15 – 20 дней), поэтому возникает необходимость повторных введений.
Эубиотики
Неблагоприятная экологическая обстановка, возрастание стрессовых воздействий, нерациональная антибиотикотерапия создают условия для повсеместного распространения дисбактериоза желудочно-кишечного тракта, активизации хронических бактериальных инфекций, аллергизации организма взрослых и детей. Для профилактики и лечения дисбактериозов в медицинской практике широко используются эубиотики.
Эубиотики (синоним «пробиотики») – это иммунобиологические препараты, действующим началом которых являются живые лиофильно высушенные культуры микроорганизмов – представителей нормальной микрофлоры. Эубиотики получают путем выращивания бактерий на искусственных питательных средах, концентрирования, сушки, стандартизации и изготовления готовой формы в виде порошка или таблеток.
В эубиотиках чаще всего присутствуют наиболее распространенные в организме человека бактерии: кишечная палочка, бифидумбактерии, лактобациллы или их комбинации. Отсюда препараты эубиотиков имеют названия «колибактерин», «бифидумбактерин», «лактобактерин», «бификол». Например, ацилакт содержит три штамма лактобацилл, а также лактобактерин, представляющий собой микробную массу лактобактерии plantarum и fermentum.
Иммунокорректоры
Иммунокорректоры – это препараты, восстанавливающие функции иммунной системы. Активное использование иммунокорректоров началось в 70-х гг. ХХ века, когда было показано, что использование ряда различных препаратов способствовало восстановлению иммунологических показателей.
Препараты, повышающие активность иммунной системы, называются иммуностимуляторами. Их применяют при иммунодефицитных состояниях. Для снижения функций иммунной системы используют иммунодепрессанты, подавляющие активность иммунной системы. Их применяют при трансплантации органов и тканей, при аутоиммунных заболеваниях. Иммуномодуляторы – это препараты, которые в зависимости от дозы, схемы применения, состояния иммунной системы способны вызывать разнонаправленный иммунный ответ – повышать пониженные и понижать повышенные показатели иммунного статуса.
В соответствии с существующими классификациями (А.А. Ярилин, Б. В. Пинегин) выделяются следующие группы иммуномодуляторов:
препараты микробного происхождения (нуклеинат натрия, рибомунил, имудон и др.);
пептидные препараты (Т-активин, миелопид, тимоген и др.);
цитокины и препараты на их основе (интерфероны, интерлейкины);
синтетические препараты (полиоксидоний, ликопид и др.);
препараты на основе природных факторов (препараты иммуноглобулинов, экстракты растений).
В настоящее время свыше 40 препаратов, обладающих иммуномодулирующими свойствами, разрешены к применению в России; это в основном цитокины, препараты тимуса и синтетические препараты. Большинство иммуномодуляторов обладает хорошо изученным механизмом действия с преимущественным влиянием на то или иное звено иммунной системы, хотя в зависимости от различных условий препарат может оказывать влияние и на другие ее компоненты. Все это указывает на необходимость предварительной оценки параметров иммунной системы в каждом конкретном случае с последующим назначением соответствующего препарата
В группу иммуномодуляторов выделяют препараты животного, микробного, дрожжевого и синтетического происхождения, обладающие специфической способностью стимулировать иммунные процессы и активировать иммунокомпетентные клетки (Т- и В-лимфоциты) и дополнительные факторы иммунитета (макрофаги и др.). Усиление общей сопротивляемости организма может в той или другой степени происходить под влиянием ряда стимулирующих и тонизирующих средств (кофеина, элеутерококка и др.), витаминов, дибазола, производных пиримидина – метилурацила, пентоксила (ускоряют регенерацию, интенсифицируют лейкопоэз), дериватов нуклеиновых кислот и биогенных препаратов, получивших общее название – адаптогены. Способность этих препаратов повышать резистентность организма, ускорять процессы регенерации послужила основанием для широкого применения в комплексной терапии вялотекущих регенерационных процессов, инфекционных, инфекционно-воспалительных и других заболеваний. Особенно важным стало в последние годы изучение иммунологических свойств эндогенных соединений – лимфокинов, интерферонов. Терапевтическую эффективность ряда лекарственных средств – продигиозана, полудана, арбидола и др. – объясняют в определенной мере тем, что они стимулируют образование эндогенного интерферона, т. е. являются интерфероногенами). Важнейшую роль в функционировании клеточного и гуморального иммунитета играет вилочковая железа (тимус). В ней происходят дифференциация стволовых клеток в лимфоциты, а также секреция специфических веществ (гормонов), оказывающих влияние на развитие и созревание определенных клеток лимфоидной ткани. Из вилочковой железы выделен ряд гормонов полипептидной (тимозин, гомеостатический тимусный гормон, тимопоэтин I и II, тимусный гуморальный фактор) и стероидной (тимостерин) структуры. Получен ряд экстрактивных препаратов (тималин, тактивин, тимоптин, вилозен), применяющихся в качестве иммуностимуляторов; все они содержат вышеперечисленные гормоны вилочковой железы (в том числе альфа-тимозин) и в значительной мере близки между собой по действию. Из другого органа иммунной системы – костного мозга – получен препарат В-активин. К синтетическим иммуностимуляторам относятся левамизол, ряд пептидных иммуностимуляторов (тимоген и др.).
Диагностические препараты
Многие диагностические препараты относятся к иммунобиологичесикм препаратам, поскольку их действие основано на иммунологических принципах и реакциях. Эти препараты и системы широко используются для диагностики инфекционных и неинфекционных болезней, индикации и идентификации бактерий, вирусов, грибов и простейших, для определения иммунного статуса, аллергических и иммунологических расстройств, иммунологической совместимости тканей, иммунных взаимоотношений матери и плода.
В соответствии с целевым назначением диагностических препаратов они содержат те или иные специфические иммунореагенты (антигены, антитела, аллергены, иммуномодуляторы, факторы неспецифического иммунитета), которые используют для выявления объекта исследования в определенных реакциях или тест-системах. Эффект реакции в соответствии с характером иммунореагентов и механизмом взаимодействия реагентов регистрируют по физическим (мутность), химическим (изменение цветности) или клиническим (симптомы проявления) показателям.
Абзимы – каталитические антитела
Приемы и методы синтеза химических веществ с течением времени постоянно совершенствуются. Одной из основных проблем синтетической химии по-прежнему остается создание высокоэффективных катализаторов. В 80-х г.г. прошлого века получило практическое воплощение новое направление – создание биокатализаторов, так называемых абзимов. Абзимы - моноклональные каталитически активные антитела, обладающие свойствами ферментов.
Теоретические основы этого научного направления были заложены еще в 1950-х г.г. американским физиком и химиком Л. Полингом. Он исходил из сходства биокатализаторов ферментов и антител: те и другие являются белками с определенной пространственной конфигурацией, способными к специфическому связыванию с лигандами, субстратом биохимической реакции в первом случае и антигеном – во втором. В то же время если антигенсвязывающий участок антител изначально строго комплементарен антигенной детерминанте, то полное взаимосоответствие активного центра фермента и субстрата достигается только в момент переходного состояния реакции. Идеи Л. Полинга были развиты У. Дженксом, который в 1969 г. предположил, что если получить антитела, комплементарные структуре переходного состояния реакции, то они должны катализировать эту реакцию, ускоряя достижение переходного состояния. Для получения таких антител в качестве антигена или гаптена для иммунизации животного следовало использовать вещества, моделирующие переходное состояние реакции.
Реально работы по получению таких антител были начаты в конце 1980-х г.г. Толчком к началу этих исследований послужило с одной стороны накопление необходимых научных знаний о молекулярных механизмах органических реакций, структуре переходных состояний, с другой – была разработана гибридомная технология получения гомогенных по структуре антител (моноклональных). Подробнее эта технология будет рассмотрена в следующем разделе.
Работы по созданию биокатализаторов с заданными свойствами были одновременно начаты в нескольких исследовательских центрах. Первые успехи привели к интенсификации этих исследований и становлению нового научного направления. Антитела, обладающие каталитическими свойствами, по аналогии с энзимами (принятое в англоязычной литературе название ферментов) стали называть абзимами. К настоящему времени получены десятки абзимов, катализирующих разнообразные химические реакции. В качестве примера рассмотрим две реакции.
На рис. 29А приведена схема заключительной стадии биосинтеза гема, катализируемой ферментом феррохелатазой. В переходном состоянии этой реакции связывание иона Fe2+ сопровождается некоторым структурным искажением молекулы субстрата – протопорфирина IX. конкурентным ингибитором данной реакции является N-метилпротопорфирин IX (рис. 29Б), имеющий структурное сходство с субстратом. Однако в нем по сравнению с протопорфирином IX за счет метилирования одного из пиррольных колец имеет место искажение структуры, характерное для переходного состояния реакции. N-метилпротопорфирин IX был использован в качестве гаптена. Каталитические антитела, выработанные на этот гаптен, по своей эффективности всего лишь в десять раз уступали природному ферменту. Это пример абзима, каталитическое действие которого основано на стабилизации переходного состояния реакции.
Рис. 29. Заключительная стадия биосинтеза гема (А) и структура N-метилпротопорфирина IX, ингибитора этой реакции (Б).
Абзимы могут увеличивать скорость химической реакции не только за счет стабилизации переходного состояния, но и по механизму кислотно-основного катализа. Примером могут служить антитела, катализирующие гидролиз сложных эфиров карбоновых кислот. Механизм разрыва сложноэфирной связи включает образование переходного состояния тетраэдрической структуры с отрицательным зарядом на карбонильном атоме кислорода (рис. 30). В качестве аналога переходного состояния реакции был взят эфир фосфоната, имеющий сходную геометрическую и электронную конфигурацию. Использование эфиров фосфоната в качестве гаптенов позволило получить абзимы, обладающие каталитической активностью, сопоставимой с активностью ферментов.
Интерес, который проявляется к абзимам, обусловлен тем, что они могут быть получены для катализа практически любой химической реакции, и их наработка возможна в любых количествах. Применение абзимов в органической химии представляет огромный интерес. Поскольку абзимы, как и ферменты, обладают стереоспецифичностью, с их помощью можно решать задачу разделения энантиомеров, что особенно важно в производстве лекарственных средств. При изучении структуры белков и пептидов оказывается чрезвычайно важной возможность селективного расщепления определенных пептидных связей при использовании абзимов, многократно увеличивающих селективность катализа. Кроме того, абзимы открывают перспективу катализа трудно идущих химических реакций.
Особую роль могут сыграть абзимы в биотехнологии. Если в генетический аппарат дрожжевой клетки, используя методы генной инженерии, ввести ген, отвечающий за синтез того или иного абзима, то можно заставить ее продуцировать необходимые человеку катализаторы. Работы в этом направлении проводятся и имеется целый ряд достижений.
Гибридомная технология
получения моноклональных антител
При введении антигена в организм возникает большое семейство антител, направленных к разным его детерминантам и различающихся даже внутри группы антител, направленных к одной и той же детерминанте. Однако иногда требуется определённый вид антител, специфичных лишь к одной детерминанте антигена и имеющих одни и те же характеристики.
Моноклональные антитела – это антитела строго определённой специфичности, продукт одного клона. Моноклональные антитела гомогенны как по специфичности, так и по физико-химическим свойствам. В природе почти никогда не наблюдается истинный моноклональный ответ.
Получение моноклональных антител стало возможным благодаря работам Георга Келера и Цезаря Мильштейна, которые в 1984 г. стали лауретами Нобелевской премии. Они применили оригинальный подход, получив гибрид нормальной антителообразующей клетки (АОК) и опухолевой клетки (гибридому). Гибридома наследовала от нормальной клетки способность к синтезу антител, а от опухолевой клетки – способность к неограниченному числу делений (бессмертие).
Для получения гибридом наиболее подходящими оказались клетки плазмоциты, опухоли, происходящей из плазматических клеток. Эти клетки по своей дифференцировке наиболее соответствовали антителообразующим клеткам, так как сохраняли способность к синтезу иммуноглобулинов. С использованием специальных приемов были получены мутантные плазмоцитомные клетки, не способныесинтезировать нуклеиновые кислоты по резервному пути из гипоксантина и тимидина.
Для получения АОК животных (мышей или крыс) активно иммунизировали определенным антигеном. Когда продукция антител достигала высокого уровня, из селезенки и лимфоузлов животных (мест скопления АОК) готовили суспензию клеток.
Затем вызывали слияние АОК с клетками плазмоцитомы, применяя для этой цели полиэтиленгликоль (ПЭГ) – полиэлектролит, способствующий слиянию клеточных мембран. Гибридома сохраняла способность к клеточному делению, в процессе которого хромосомы обоих ядер перемешивались и образовывали одно общее ядро, содержащее гены иммуноглобулинов обеих клеток – предшественников.
Для того чтобы отделить заданную гибридому от присутствующих в системе отдельных неслившихся клеток и от гибридов иного состава или иной специфичности, чем требуемые, авторы разработали специальную схему, использующую отбор клеток в селектирующей ГАТ-среде, содержащей гипоксантин, аминоптерин и тимидин. Аминоптерин является высокотоксичным агентом, блокирующим синтез пуриновых оснований, необходимых для дальнейшего синтеза нуклеиновых кислот. Это приводит к гибели опухолевых клеток, имеющих метаболический дефект, не позволяющий использовать резервный путь синтеза пуриновых оснований. АОК способны расти в ГАТ-среде, но будучи смертными погибают естественным путем через 1 – 2 недели. Гибридомы же сохраняют жизнеспособность, поскольку сочетают свойства «бессмертной» опухолевой клетки и АОК, использующих обходной метаболический путь синтеза пуринов.
Выжившие в ГАТ-среде гибридомные клетки рассеивают в пластиковые планшеты на 96 лунок ёмкостью 0,2 см3 (в каждую по 10 гибридом), через несколько дней содержимое лунок проверяют на наличие антител нужной специфичности (т. е. моноклональных). Клетки из лунок, содержащих таковые, клонировали, рассеивая по 1 клетке в лунку. Эта клетка-предшественник дает начало формированию «бессмертного» клона, продуцирующего моноклональные антитела. Процедура повторяется до 2 раз.
Полученные клоны гибридомных клеток можно хранить длительное время при -70 оС, как угодно долго культивировать на питательных средах, накапливая антитела, перевивать от одного подопытного животного другому. Секретируемые этими клетками антитела не содержат посторонних антител, физико-химически однородны и могут рассматриваться как чистые химические реактивы.
Следует отметить альтруизм создателей гибридомной технологии. В интересах развития науки Г. Келер и Ц. Мильштейн отказались от патентования своего метода, более того предоставили клеточную линию плазмоцитомы для исследования во все ведущие исследовательские лаборатории в мире.
В настоящее время гибридомная технология лежит в основе получения абзимов, о чем говорилось выше. Моноклональные антитела в силу своей высочайшей специфичности, стандартности и технологичности широко применяются как диагностикумы для определения широкого спектра биологически активных веществ: белков, гормонов, медиаторов воспаления, бактериальных и вирусных антигенов, различных ядов.
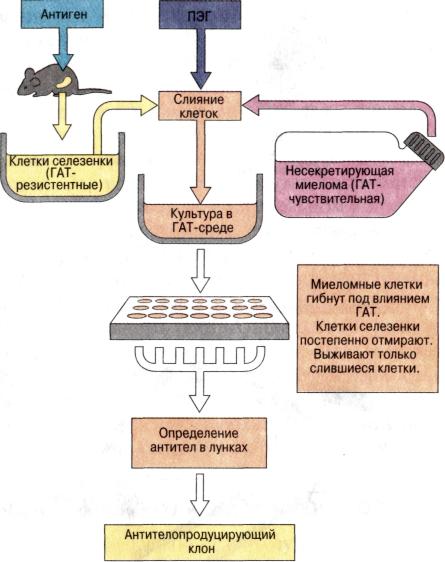
Рис. 31. Получение моноклональных антител
Моноклональные антитела широко используются в онкологии, с их помощью доставляются радиоактивные метки в опухоли и их метастазы, что позволяет по локализации радиоактивности обнаружить даже небольшие скопления опухолевых клеток. Сейчас во всем мире активно ведутся исследования по применению моноклональных антител как переносчиков токсических веществ в места локализации опухолей.