
- •Санкт-Петербург
- •Содержание
- •Введение
- •Аннотация
- •1. Значение, общие принципы и методы технического анализа Основные понятия: технический контроль производств, технический анализ
- •Технический анализ – важнейшая составная часть технического контроля производств
- •Классификация методов технического анализа
- •Аналитический процесс Пробоотбор и пробоподготовка
- •Измерение и оценка результата Чувствительность аналитической методики
- •Случайная и систематическая погрешности
- •2. Гравиметрический (весовой анализ) Сущность гравиметрического анализа, его возможности и точность. Практическое значение метода
- •Разновидности гравиметрического анализа Форма осаждения и весовая форма
- •Требования, предъявляемые к форме осаждения и весовой форме
- •Контроль полноты осаждения
- •Образование осадков, их свойства, зависимость характера осадков от условий осаждения
- •Гравиметрическая форма.
- •Выбор осадителя; органические осадители.
- •Расчеты в гравиметрическом анализе; соотношение эквивалентности, аналитический фактор
- •Основные методы титриметрического анализа. Основные приемы титрования
- •Метод кислотно-основного титрования (нейтрализации)
- •Индикаторы в методе кислотно-основного титрования
- •Кривые титрования
- •Окислительно-восстановительное титрование (оксидиметрия), его разновидности
- •Титрование по методу осаждения. Комплексометрическое титрование
- •Выражение концентрации рабочих растворов. Расчеты в титриметрии
- •Термометрическое титрование.
- •Кондуктометрия. Кондуктометрическое титрование
- •Вольтамперометрия. Прямая полярография. Амперометрическое титрование
- •Контрольные вопросы к главе 1.3.
- •1.4. Спектральные и оптические методы анализа
- •Оптические спектры
- •Величины светопоглощения
- •Спектр поглощения
- •Выбор длины волны и светофильтра
- •Чувствительность фотоколориметрических и спектрофотометрических методов
- •Основные приемы фотометрического анализа
- •Приборы фотометрического анализа Для количественной оценки интенсивности окраски или светопоглощения применяют различные приборы:
- •Электронные спектры поглощения органических соединений
- •Типы электронных переходов
- •Инфракрасная спектроскопия
- •Устройство ик - спектрометра
- •Ядерный магнитный резонанс
- •Химический сдвиг
- •Спин-спиновое взаимодействие
- •Контрольные вопросы к теме 1.4
- •1.5. Хроматографический анализ и хромато-масс-спектрометрия хроматографические методы анализа
- •Области применения хроматографии
- •Молекулярная адсорбционная хроматография жидких веществ
- •Адсорбенты
- •Растворители
- •I. По механизму разделения
- •II. По форме проведения процесса
- •Газовая хроматография
- •Хромато-масс-спектрометрия
- •Контрольные вопросы к теме 1.5.
- •Заключение
- •Список литературы к разделу 1.1.-1.3.
- •Список литературы к разделу 1.4.-1.5.
- •Терминологический словарь к разделу 1
Выбор осадителя; органические осадители.
Зависит от перечисленных требований к осадкам (см.рис.1). Кроме того:
1. Удобно, чтобы осадитель был веществом летучим (при испарении он увлекает из раствора посторонние вещества).
2. Осадитель должен обладать избирательными, специфическими свойствами.
Органические реагенты, используемые для осаждения в неорганическом анализе, обладают более высокой селективностью по сравнению с неорганическими осадителями. Осадки неорганических ионов с органическими реагентами наиболее полно отвечают требованиям, предъявляемым к форме осаждения и гравиметрической форме. Растворимость соединений, получаемых при взаимодействии органических реагентов с неорганическими ионами очень мала и полнота осаждения, как правило, достигается уже при небольшом избытке осадителя.
Осадки неорганических ионов с органическими соединениями характеризуются достаточной чистотой, почти все обладают кристаллической структурой, имеют стехеометрический состав и небольшой фактор пересчета.
Установлено, что возможность взаимодействия иона с органическим реагентом зависит от наличия в молекуле так называемых функциональных или характерных атомных групп на данный ион.
Классическим
представителем органических реагентов
в гравиметрическом анализе является
диметилглиоксим
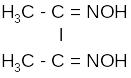 (реагент Чугаева).
(реагент Чугаева).
Общее число органических реагентов, применяемых для осаждения неорганических ионов, насчитывает несколько тысяч и это количество непрерывно увеличивается.
Расчеты в гравиметрическом анализе; соотношение эквивалентности, аналитический фактор
Если m – масса осадка Ba3(РO4)2, а в результате анализа требуется определить массу фосфора Р, то результат рассчитывают по пропорции:
из M(Ba3(РO4)2)г Ba3(РO4)2 получается 2·M(Р)г Р
m(Ba3(РO4)2) – х г Р
где M(Ba3(РO4)2) – молярная масса Ba3(РO4)2, г
M(Р) – молярная масса Р, г.
тогда
![]() (14)
(14)
Отношение молярной массы определяемого компонента к молярной массе гравиметрической формы называют фактором пересчета или гравиметрическим фактором F.
![]() (15)
(15)
Молекулярные (атомные) веса нужно брать с такими коэффициентами, чтобы они были эквивалентны друг другу, то есть чтобы в них содержалось одинаковое количество атомов соответствующего элемента.
Контрольные вопросы к главе 1.2
1. Назовите основные операции гравиметрического анализа.
2. Что называется формой осаждения и какие требования к ней предъявляются?
3. Что такое весовая форма и какие требования к ней предъявляются?
4. Какие процессы происходят при выстаивании растворов и созревании кристаллических осадков?
5. Что такое соосаждение? Какие физико-химические процессы в растворе приводят к соосаждению?
1.3. ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ АНАЛИЗ)
Сущность метода и его возможности
Точка эквивалентности
Титриметрический анализ основан на точном количестве реактива израсходованного на реакцию с определяемым веществом.
Титр – это количество граммов растворенного вещества в 1 мл раствора.
Титрованный или стандартный раствор – это раствор, концентрация которого известна с высокой точностью. Титрование – прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Титрующий раствор часто называют рабочим раствором или титрантом.
Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности. Для определения этой точки к исследуемому раствору прибавляют вещества способные резко изменять свою окраску при переходе через точку эквивалентности. Такие вещества называются индикаторами.
Реакции, применяемые в титриметрии, должны удовлетворять следующим основным требованиям:
1. реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика;
2. реакция должна протекать с большой скоростью;
3. реакция не должна осложняться протеканием побочных реакций;
4. должен существовать способ определения окончания реакции.
